近年來����,連續(xù)制造技術(shù)在制藥行業(yè)中備受關(guān)注���,該技術(shù)以其降本增效、提高生產(chǎn)率等顯著優(yōu)勢備受追捧���,并成為未來制藥行業(yè)的發(fā)展趨勢。相比傳統(tǒng)的批量生產(chǎn)方式����,連續(xù)制造技術(shù)具有實時可控、綠色智能等特點(diǎn)�,能夠幫助制藥企業(yè)更加高效地生產(chǎn)藥品。然而���,在中藥制藥領(lǐng)域中�,連續(xù)制造技術(shù)的推廣應(yīng)用緩慢���。一方面����,符合中藥制劑特點(diǎn)的連續(xù)制造設(shè)備和技術(shù)研究還不夠充分����;另一方面,復(fù)合型人才匱乏等問題也影響了其發(fā)展���。因此�,為了促進(jìn)中藥制藥行業(yè)的現(xiàn)代化和升級�,該文結(jié)合中藥產(chǎn)業(yè)發(fā)展現(xiàn)狀,概述連續(xù)制造技術(shù)的發(fā)展?fàn)顩r和監(jiān)管要求����。同時,還將對現(xiàn)有中藥制造模式的問題進(jìn)行分析�,探討連續(xù)制造技術(shù)在中藥制藥領(lǐng)域中的應(yīng)用前景和存在的挑戰(zhàn)。在分析中���,將重點(diǎn)剖析連續(xù)制造控制策略����、技術(shù)工具和制藥裝備等方面����,以期提出具有針對性的建議,推動中藥制藥行業(yè)的發(fā)展���。
《中醫(yī)藥發(fā)展戰(zhàn)略規(guī)劃綱要(2016—2030 年)》提出“到2030 年���,中醫(yī)藥工業(yè)智能化水平邁上新臺階”的發(fā)展目標(biāo),并將“促進(jìn)中藥工業(yè)轉(zhuǎn)型升級����,推進(jìn)中藥工業(yè)數(shù)字化、網(wǎng)絡(luò)化����、智能化建設(shè)����,加強(qiáng)技術(shù)集成和工藝創(chuàng)新,提升中藥裝備制造水平”列為重要任務(wù)����。然而,目前我國中藥行業(yè)生產(chǎn)工藝水平與國際領(lǐng)先技術(shù)仍然有較大差距���,中藥制藥裝備自動化程度較低���,制造過程以落后的單元操作為主[1],數(shù)據(jù)顯示�,2014 年到2020 年,我國大健康產(chǎn)業(yè)整體營收規(guī)模超過7 萬億元[2]���,但現(xiàn)有整體技術(shù)水平仍停留在工業(yè)2.0 階段�,中藥高質(zhì)量制造需要產(chǎn)業(yè)技術(shù)和裝備升級����,中藥制藥行業(yè)面臨新的機(jī)遇和挑戰(zhàn)�。
連續(xù)制造(continuous manufacturing,CM)是指物料連續(xù)地投入并在工藝中完成轉(zhuǎn)換����,同時加工后的物料被連續(xù)地從系統(tǒng)中移除,其作為一種先進(jìn)的生產(chǎn)模式���,具有提高生產(chǎn)效率并降低成本的顯著優(yōu)勢���,在汽車、食品�、石油化工等行業(yè)已成功應(yīng)用多年,但在制藥領(lǐng)域中的發(fā)展仍相對緩慢[3]。2022年11 月16 日����,國際人用藥品注冊技術(shù)協(xié)調(diào)會 (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)發(fā)布《Q13:原料藥與制劑的連續(xù)制造》指南的最終采納版本����,在該指南中���,連續(xù)制造范圍涉及生產(chǎn)過程中輸入物料的持續(xù)投料���,物料的持續(xù)轉(zhuǎn)化,以及輸出物料的同步去除�。目前�,我國中藥制劑生產(chǎn)仍以傳統(tǒng)批量制造模式為主,與傳統(tǒng)模式相比�,連續(xù)制造通過將各個單元生產(chǎn)環(huán)節(jié)組合為連續(xù)生產(chǎn)線,借助過程分析技術(shù)(processanalytical technology���,PAT)實現(xiàn)了許多優(yōu)勢:僅需較小的生產(chǎn)場地�、生產(chǎn)靈活迅速�、過程質(zhì)量實時可控、綠色智能化程度高,在經(jīng)濟(jì)效益建模中成本相比傳統(tǒng)制造降低了55%[4]����。將連續(xù)制造技術(shù)與我國中藥制藥相結(jié)合,不僅有助于中藥制藥行業(yè)發(fā)展轉(zhuǎn)型���,更有利于我國從中藥大國邁向中藥強(qiáng)國���。
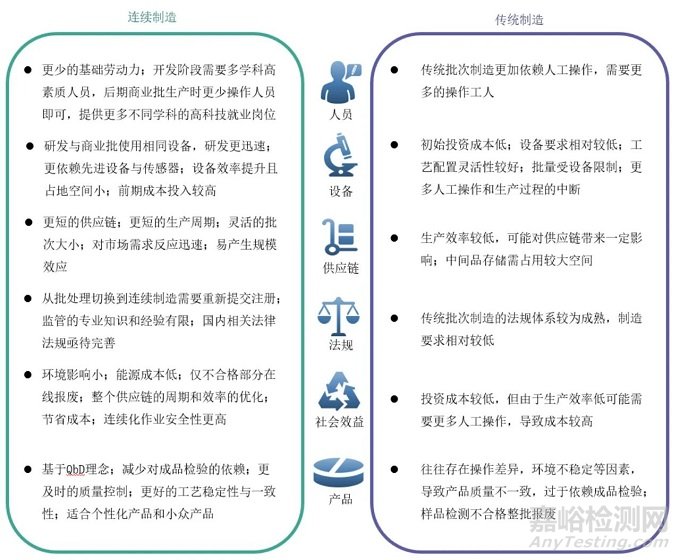
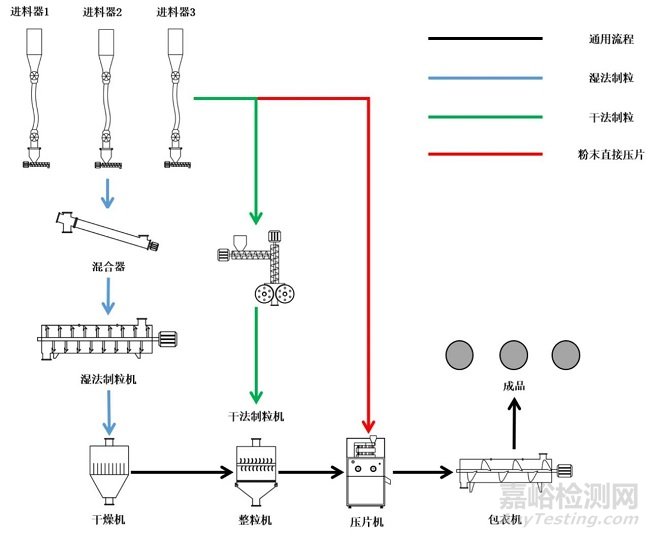
雖然連續(xù)制造相比傳統(tǒng)制造存在諸多優(yōu)點(diǎn),見圖1����,但全球范圍內(nèi)應(yīng)用連續(xù)制造技術(shù)生產(chǎn)商品化藥品的制藥企業(yè)仍較少,國內(nèi)外現(xiàn)已上市品種均為口服固體制劑�,多采取連續(xù)制造工藝與批次生產(chǎn)組合的“單元連續(xù)”或“半連續(xù)”方式進(jìn)行生產(chǎn),與其他類型的制劑(例如液體���、注射劑等)相比�,固體口服制劑的生產(chǎn)過程更容易實現(xiàn)自動化和數(shù)字化控制���,物理和化學(xué)特性相對穩(wěn)定并具有良好的耐儲存性能����,實現(xiàn)難度也更小。
圖1 連續(xù)制造與傳統(tǒng)制造模式對比
1����、連續(xù)制造發(fā)展概況
制造業(yè)實行連續(xù)制造可以追溯到工業(yè)革命時期,隨著現(xiàn)代科技發(fā)展����,石油化工、制漿造紙、食品烹飪等行業(yè)應(yīng)用連續(xù)制造技術(shù)已較為常見,制藥行業(yè)由于法規(guī)監(jiān)管的特殊性及對藥品質(zhì)量的嚴(yán)格要求�,新技術(shù)�、新裝備的使用仍然較為緩慢���,但研究人員對于連續(xù)制造的探索從未停止���。
美國一直以來積極探索CM 在制藥中的應(yīng)用,將藥品連續(xù)生產(chǎn)認(rèn)定為國家重點(diǎn)技術(shù)�,美國食品藥品監(jiān)督管理局(FDA)將原料藥與藥品的連續(xù)制造列為公認(rèn)的新興技術(shù)名單[5]���,2016 年美國國會通過法案授權(quán)衛(wèi)生與公眾服務(wù)部部長可向高等教育機(jī)構(gòu)和非營利組織撥款�,以研究和建議改進(jìn)藥品和生物制品的連續(xù)生產(chǎn)過程以及類似的創(chuàng)新監(jiān)測和控制技術(shù)[6]�。CM 被認(rèn)為接近于FDA 在2004 年發(fā)表的《藥品制造的創(chuàng)新和持續(xù)改進(jìn)》[7]中描述的藥品制造“理想狀態(tài)”,貫徹了FDA 一直倡導(dǎo)的質(zhì)量源于設(shè)計(quality by design,QbD)理念����。為幫助實施創(chuàng)新制藥技術(shù),F(xiàn)DA 創(chuàng)建了新興技術(shù)團(tuán)隊(emerging technology team����,ETT)和生物制品評價與研究中心先進(jìn)技術(shù)小組(CBER advanced technology team,CATT)����,2018 年美國藥典委員會(US Pharmacopeia,USP)發(fā)布《藥品連續(xù)生產(chǎn)的USP 視角》����,內(nèi)容涉及CM 中的術(shù)語和定義、批量定義���、控制策略�、風(fēng)險管理���、PAT���、監(jiān)管預(yù)期等方面���。同時其他發(fā)達(dá)國家和地區(qū)也成立了專注藥品制造現(xiàn)代化、關(guān)注連續(xù)制造的產(chǎn)學(xué)研聯(lián)盟����,例如藥品連續(xù)制造技術(shù)知識中心(美國)、結(jié)構(gòu)化有機(jī)顆粒系統(tǒng)工程研究中心(美國)����、諾華-麻省理工學(xué)院連續(xù)制造研究中心(美國)、連續(xù)制造和先進(jìn)結(jié)晶中心(英國)�、合成和固態(tài)制藥中心(愛爾蘭)、制藥工程研究中心(奧地利)���。
我國積極投入CM 的研究與實踐中����,2021 年10 月����,國家藥品監(jiān)督管理局藥品審評中心公開向社會征求ICH 指導(dǎo)原則《Q13:原料藥和制劑的連續(xù)制造》意見[8],并于2023 年3 月20 日發(fā)布《化藥口服固體制劑連續(xù)制造技術(shù)指導(dǎo)原則(試行)》[9]使得該進(jìn)程向前更進(jìn)一步�,國內(nèi)暫無中藥連續(xù)制造相關(guān)指導(dǎo)原則與品種審批���,相關(guān)政策亟待建設(shè)完善����。目前批準(zhǔn)的連續(xù)化生產(chǎn)品種多為單一制劑產(chǎn)品。
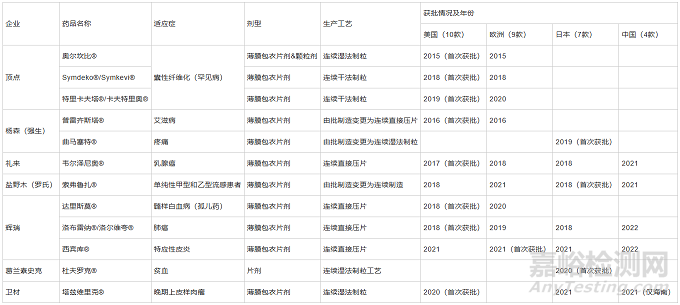
目前���,全球已有12 款使用CM 生產(chǎn)的藥物獲批���,見表1,F(xiàn)DA2022 年審計表明�,與傳統(tǒng)批處理方式相比,CM 藥品評審時間平均快9 個月���,批準(zhǔn)和上市時間較短�,這意味著收益的增多和快速占領(lǐng)市場[10]����。其劑型與生產(chǎn)工藝集中在口服固體制劑產(chǎn)品,這體現(xiàn)了連續(xù)制造在口服固體制劑中的應(yīng)用潛力���。
表1近年來使用連續(xù)工藝生產(chǎn)的企業(yè)與獲批藥物
2�、中藥制造模式
中藥是中醫(yī)藥事業(yè)傳承和發(fā)展的重要載體����,升級中藥制造模式、提升中藥生產(chǎn)效能對于推動中藥產(chǎn)業(yè)高質(zhì)量發(fā)展至關(guān)重要���。隨著我國新版《藥品管理法》于2019 年頒布實施����,國家大力推動完善中藥全過程質(zhì)量控制體系���,構(gòu)建中藥全過程質(zhì)量追溯體系�,一方面遵循以臨床價值為導(dǎo)向的原則����,另一方面強(qiáng)調(diào)重視“QbD”“全過程質(zhì)量控制”等理念,指導(dǎo)中藥生產(chǎn)企業(yè)更加有效地控制藥品質(zhì)量���。
2.1 中藥制劑生產(chǎn)過程管理
隨著國內(nèi)疫情政策的調(diào)整���,藥品的可及性問題突出,依賴傳統(tǒng)設(shè)備的生產(chǎn)模式正暴露出越來越多的問題����,例如設(shè)備性能發(fā)揮較為依賴員工����;關(guān)鍵設(shè)備容量大小桎梏生產(chǎn)批量���;提升產(chǎn)量依賴人員加班加點(diǎn)。目前我國中藥制劑的主要生產(chǎn)模式為批次間斷生產(chǎn)���,即通過單元式設(shè)備���,在完成每一單元生產(chǎn)步驟后由操作人員對中間品進(jìn)行離線檢驗,期間物料暫存于設(shè)備內(nèi)或暫存間���,結(jié)果合格后放行至下一環(huán)節(jié)����,重復(fù)過程直至形成最終產(chǎn)品�,通常耗時1 周以上,不僅時間漫長�,繁瑣重復(fù)的過程也帶來了質(zhì)量管理風(fēng)險隱患,在CM 中�,可通過4 種主要方式定義生產(chǎn)批量:①輸出物料量;②輸入物料量���;③規(guī)定的質(zhì)量流量下的運(yùn)行時間���;④基于CM 工藝特征的科學(xué)合理方法[8]����,企業(yè)可通過運(yùn)行時間定義批次和批量使中試至商業(yè)化過程變得簡單���,使用連續(xù)化設(shè)備自動轉(zhuǎn)移物料縮短供應(yīng)鏈����,通過改變設(shè)備運(yùn)行時間����、增加質(zhì)量流量或增加設(shè)備等方式來增加產(chǎn)量,通過停留時間分布(residence time distribution���,RTD)確定分流和收集時間�,并可用于追溯物料����,助力中藥生產(chǎn)的全過程質(zhì)量管理。
2.2 中藥制劑產(chǎn)品質(zhì)量管理
中藥全過程質(zhì)量控制強(qiáng)調(diào)從藥材源頭入手,傳統(tǒng)生產(chǎn)過程常年對于不同批次飲片使用相同的工藝參數(shù)進(jìn)行生產(chǎn)�,中間品檢驗依賴水分、密度等單一指標(biāo)����,對于多組分、多靶點(diǎn)的中藥制劑來說����,難以有效地在過程中發(fā)現(xiàn)質(zhì)量風(fēng)險隱患����,從而過于依賴成品檢驗確定制劑質(zhì)量好壞,在使用隨機(jī)化控制試驗設(shè)計的中藥研發(fā)方案中�,多重視考察工藝參數(shù)的變化,較少考慮關(guān)鍵物料屬性與關(guān)鍵工藝參數(shù)(critical process parameters, CPPs)���,關(guān)鍵質(zhì)量屬性(critical quality attributes, CQAs)之間的交互[11]����。使用CM 可以大幅改善這種局面�,通過在關(guān)鍵工藝點(diǎn)使用PAT 監(jiān)測生產(chǎn)過程中的CQAs,利用反饋和前饋回路系統(tǒng)自主控制CPPs�,以保證過程和最終的產(chǎn)品CQAs 在規(guī)定范圍內(nèi),管理者在生產(chǎn)過程中能夠?qū)崟r掌握過程數(shù)據(jù),系統(tǒng)的自主決策減少了人工干預(yù)���,并可利用積累的生產(chǎn)數(shù)據(jù)持續(xù)優(yōu)化工藝�,改善中藥制劑質(zhì)量���。
2.3 建立符合中藥特點(diǎn)的連續(xù)制造技術(shù)體系
與化學(xué)藥品多采用規(guī)定固定工藝參數(shù)的模式不同����,中藥原料的質(zhì)量波動性較大���,生產(chǎn)中的關(guān)鍵工藝參數(shù)和質(zhì)量屬性應(yīng)保持在經(jīng)優(yōu)化驗證的設(shè)計空間內(nèi)���,并非穩(wěn)定不變。中藥復(fù)方工藝對物料等輸入性因素過度嚴(yán)格控制可能會造成適得其反的結(jié)果[12]���,中藥連續(xù)制造技術(shù)體系需要考慮中藥制劑的特點(diǎn)����,包括中藥的復(fù)雜組成����、藥效成分的多樣性和易揮發(fā)性等�。同時對投入物料的控制����、過程檢測、物料的分離和收集能力���、數(shù)據(jù)處理和分析能力�、穩(wěn)定性能力具有一定要求����,因此����,建立符合中藥特點(diǎn)的連續(xù)制造技術(shù)體系可從以下部分考慮:
①連續(xù)化改造,特別是中藥制藥裝備自動化與單元智能化設(shè)備程度低的環(huán)節(jié)(如藥材前處理)重點(diǎn)突破����、積累關(guān)鍵工序的共性技術(shù)方法(如算法、建模���、PAT 等)���。
②良好的控制策略,解決在線檢測技術(shù)沒有和工藝、設(shè)備有效結(jié)合的現(xiàn)實問題�,實現(xiàn)制造過程中的產(chǎn)品可追溯性、開發(fā)中藥連續(xù)制造其中的一個關(guān)鍵就在于對過程動力學(xué)的理解[13]����,常見的方法是通過各個工序或整體生產(chǎn)系統(tǒng)的RTD 來描述物料從進(jìn)入到離開所需的時間分布情況,該函數(shù)可以用數(shù)學(xué)模型進(jìn)行建模和預(yù)測�,并作為取樣和追溯物料的依據(jù),這對于設(shè)計連續(xù)生產(chǎn)工藝的控制策略至關(guān)重要����。
③質(zhì)量預(yù)測技術(shù),通過建立實時數(shù)據(jù)庫并結(jié)合歷史數(shù)據(jù)庫和知識庫(如中藥物料屬性數(shù)據(jù)庫)進(jìn)行實時過程監(jiān)控����、診斷和優(yōu)化,并對不斷更新和積累的質(zhì)量大數(shù)據(jù)進(jìn)行重復(fù)利用和深度挖掘����,實現(xiàn)質(zhì)量追溯、工藝優(yōu)化�、設(shè)備運(yùn)行優(yōu)化等任務(wù),最終實現(xiàn)提前預(yù)測質(zhì)量變化趨勢����,變被動防御為主動預(yù)防�。
3�、連續(xù)制造技術(shù)
QbD 理念的貫徹實施離不開良好的控制策略[14],越來越多的企業(yè)借助連續(xù)制造關(guān)鍵技術(shù)實現(xiàn)良好的控制策略����,進(jìn)行高效、精確和可持續(xù)的生產(chǎn)����。
3.1 過程分析技術(shù)
過程分析技術(shù)被定義[15]為“一個在加工過程中通過及時測量原材料、加工材料和工藝的關(guān)鍵質(zhì)量和性能屬性來設(shè)計����,分析和控制制造的系統(tǒng),目的是確保最終產(chǎn)品質(zhì)量”����。主要包括過程認(rèn)知���、過程檢測����、過程建模����、過程控制����、持續(xù)改進(jìn)5 個關(guān)鍵技術(shù)步驟[16]�,通過使用光譜傳感器和化學(xué)計量模型等工具可以實時監(jiān)控產(chǎn)品質(zhì)量,使產(chǎn)品符合法規(guī)要求���。將PAT 納入工藝監(jiān)控的控制策略中����,通過整合集成各環(huán)節(jié)數(shù)據(jù)信息實現(xiàn)對生產(chǎn)過程自動化控制����,從而有效保證藥品質(zhì)量穩(wěn)定。強(qiáng)大的PAT 在線數(shù)據(jù)和預(yù)測性工藝模型���,結(jié)合基于QbD 的工藝設(shè)計�,可以實現(xiàn)過程控制的自動化�,并實現(xiàn)實時放行檢測,而不是靠生產(chǎn)結(jié)束后的離線檢測�。產(chǎn)品的上市時間將會更短,批次問題率將更低�,生產(chǎn)率可提高約20%[17]����。
現(xiàn)場可編程門陣列作為PAT 的硬件基礎(chǔ)�,在數(shù)據(jù)多通道采集和并行處理領(lǐng)域正發(fā)揮快速數(shù)據(jù)處理、高性能�、低功耗等技術(shù)優(yōu)勢,在諸多領(lǐng)域已被廣泛使用�,利用其創(chuàng)建實時放行檢測是解決中藥制藥過程中參數(shù)混雜問題的重要手段[18],在軟件系統(tǒng)層面���,有CAMO���、Umetrics、Siemens 等知名公司先后推出PAT 軟件系統(tǒng)����。由于在端到端連續(xù)制造過程中需要監(jiān)控多個過程,PAT 及其實時過程監(jiān)控功能在確保最終產(chǎn)品質(zhì)量方面發(fā)揮著重要作用����。MIYAI Y 等 [19]討論了在CM 上實施PAT 的策略與試驗方法�,在合成裝置上使用在線傅里葉變換紅外和拉曼光譜實時監(jiān)測環(huán)丙沙星中間體和藥物活性成分濃度,通過在線模型處理軟件和PAT 數(shù)據(jù)收集和管理軟件實現(xiàn)了中間體和產(chǎn)物濃度的實時預(yù)測����。在水分含量在線監(jiān)測方面�,王晴等[20]利用在線近紅外光譜技術(shù)�,采集樣本數(shù)據(jù)進(jìn)行建模,實現(xiàn)了用于生產(chǎn)規(guī)模的桂枝茯苓膠囊流化床干燥過程水分含量在線監(jiān)測����。
3.2 信息化智能化技術(shù)
制造業(yè)的轉(zhuǎn)型需要“智能化”賦能,需要信息技術(shù)的加持����,將生產(chǎn)過程中數(shù)據(jù)作為基礎(chǔ),發(fā)揮大數(shù)據(jù)優(yōu)勢����, 將連續(xù)制造與人工智能結(jié)合, 目前制藥行業(yè)應(yīng)用較為廣泛的有生產(chǎn)執(zhí)行管理系統(tǒng) (manufacturing execution system���,MES)���、PDM 研發(fā)過程數(shù)據(jù)集成系統(tǒng)、LIMS 實驗信息管理系統(tǒng)等���。
數(shù)據(jù)采集與監(jiān)視控制系統(tǒng)(supervisory control and data acquisition����,SCADA)是結(jié)合了軟件和硬件的自動化控制系統(tǒng),可將工藝參數(shù)�、進(jìn)料和再加工物料屬性以及最終產(chǎn)品質(zhì)量屬性的測量與工藝動態(tài)模型相結(jié)合,使用這些數(shù)據(jù)來控制和優(yōu)化工藝�,從而支持實時放行檢測,該系統(tǒng)廣泛用于石化����、自來水輸送系統(tǒng)等一系列工業(yè)過程中,可實現(xiàn)持續(xù)監(jiān)控過程�、實時控制、自動化和保護(hù)���、遠(yuǎn)程控制和操作功能����。多元統(tǒng)計工藝控制 (multivariate statistical process control, MSPC) 可分析具有潛在相關(guān)變量的復(fù)雜工藝數(shù)據(jù)�,用于確定工藝中的可變性是否隨時間穩(wěn)定,檢測工藝中的異常事件����。近年來,陸續(xù)有新適用于CM 信息化智能化系統(tǒng)涌現(xiàn)���,涉及開發(fā)�、生產(chǎn)���、維護(hù)等方面����,如薛啟隆等[21]完成了以中藥真空帶式干燥工藝為例的工藝自主決策模型的構(gòu)建與驗證���,實現(xiàn)了工藝參數(shù)組合自主優(yōu)化策略發(fā)現(xiàn)和最優(yōu)過程控制路徑規(guī)劃���。提高產(chǎn)品質(zhì)量一致性,降低生產(chǎn)成本���,提升企業(yè)效益����。余雅婷等[22]利用人工智能中的專家系統(tǒng)���,輸入人類專家的專業(yè)知識和經(jīng)驗���,用計算機(jī)模擬人類專家的思維過程解決藥品生產(chǎn)領(lǐng)域問題���,于佳琦等[23]以QbD 為基礎(chǔ),將智能工具納入生產(chǎn)系統(tǒng)中����,提出由連續(xù)制造、信息集成�、智能模擬和智慧應(yīng)用組成的中藥智能制造關(guān)鍵技術(shù)體系。蕭偉[24]基于目前的生產(chǎn)控制設(shè)備和工藝基礎(chǔ)�,開發(fā)來了可用于中藥連續(xù)制造的過程知識系統(tǒng),可根據(jù)生產(chǎn)數(shù)據(jù)的持續(xù)累計����,通過AI 算法計算最佳調(diào)控策略以實現(xiàn)產(chǎn)品質(zhì)量的持續(xù)優(yōu)化。GANESH S 等[25]介紹了一種基于狀態(tài)的口服固體藥物產(chǎn)品維護(hù)系統(tǒng)����,該系統(tǒng)可主動監(jiān)測可能導(dǎo)致系統(tǒng)故障或性能出現(xiàn)偏差的情況并闡述了實現(xiàn)該系統(tǒng)所需的系統(tǒng)架構(gòu),這對于管理藥品生命周期中的過程風(fēng)險至關(guān)重要���。國內(nèi)的浙江海正藥業(yè)股份有限公司也正積極推進(jìn)智能制造信息化系統(tǒng)建設(shè)�,包括MES 系統(tǒng)���、SCADA 系統(tǒng)����、BI 建設(shè)等。MES 系統(tǒng)能自動生成符合《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂)》(good manufacturing practice���,GMP)和FDA要求的電子批記錄,將制藥生產(chǎn)各環(huán)節(jié)的人員����、設(shè)備、物料���、環(huán)境���、規(guī)程進(jìn)行有機(jī)結(jié)合,實現(xiàn)整個生產(chǎn)過程的規(guī)范化���、電子化����、可視化�,確保生產(chǎn)數(shù)據(jù)的可靠性和性���。SCADA 系統(tǒng)提供數(shù)據(jù)監(jiān)控一體化平臺,實現(xiàn)全廠生產(chǎn)設(shè)備/系統(tǒng)運(yùn)行監(jiān)控���。BI 建設(shè)使任務(wù)操作���、設(shè)備工況可視化管理,實時反映生產(chǎn)任務(wù)完成情況���,實時監(jiān)控設(shè)備參數(shù)����,異常報警����。
3.3 虛擬仿真技術(shù)
通過VR 虛擬現(xiàn)實、3D 仿真技術(shù)等虛擬仿真技術(shù)模擬現(xiàn)實環(huán)境�,將一些不可視的結(jié)構(gòu)和原理可視化,進(jìn)行信息化與工業(yè)化的融合����,并通過建立三維仿真模型進(jìn)行虛擬現(xiàn)實的模擬[26],通過在預(yù)設(shè)好的軟件中更改條件可直觀了解工序?qū)Ξa(chǎn)品的影響����,該技術(shù)具有降低成本����、高效安全���、易于拓展的特點(diǎn)���,對連續(xù)制造中可能涉及的工藝�、設(shè)備改造、人員培訓(xùn)等方面可起到重要作用���,其包括仿真目標(biāo)定義�、基礎(chǔ)數(shù)據(jù)收集�、仿真建模、仿真分析���、仿真優(yōu)化5 個主要步驟���,德國GEA 公司使用VR 展示連續(xù)固體制劑生產(chǎn)的運(yùn)作方式,使每個員工可在設(shè)備安裝之前接受培訓(xùn)���,從典型的9 個月入職時間縮短到僅3 個月���,節(jié)省了66%的時間[27]����。于洋通過采用Aspen Plus 軟件對甘草多糖水溶液的濃縮工段進(jìn)行仿真模擬����,使用機(jī)械蒸汽壓縮技術(shù)對傳統(tǒng)濃縮工藝進(jìn)行改造[28]。通過對現(xiàn)階段工藝仿真模擬���、改造工藝和成本節(jié)約率的模擬仿真���,得到改造后的最佳操作工藝。DAMMACCO L 等[29]將物理世界與虛擬世界高水平連接����,提出使用基于虛擬現(xiàn)實技術(shù)作為解決復(fù)雜制造系統(tǒng)設(shè)計問題的設(shè)計方法。JELSCHM 等[30]將模型預(yù)測控制(model predictive control����,MPC)從石油化工行業(yè)推廣至藥物連續(xù)制造,MPC 是一類控制算法并依賴于過程模型���,能在每個單位的已知時間點(diǎn)預(yù)測未來輸出物料的質(zhì)量����,在仿真研究中,可在考慮干擾和不確定因素的情況下自動采取糾正措施�,使產(chǎn)品質(zhì)量向期望值方向移動。
4����、連續(xù)制造裝備
未來連續(xù)制造技術(shù)應(yīng)用于中藥生產(chǎn),從裝備開發(fā)的角度主要有2 個路徑:一是串聯(lián)現(xiàn)有最先進(jìn)的單元制造設(shè)備����,重點(diǎn)解決和突破單元設(shè)備之間的物料定量輸送問題����;二是開發(fā)全新的整體連續(xù)制造設(shè)備,這需要有全新的設(shè)備開發(fā)思路�,有些要突破傳統(tǒng)的工藝單元制造設(shè)備的理念,從單元設(shè)備開始就實現(xiàn)物料的連續(xù)化生產(chǎn)����。
4.1 單元裝備的集成創(chuàng)新
將現(xiàn)有生產(chǎn)設(shè)備進(jìn)行串聯(lián)改造,可實現(xiàn)部分連續(xù)的生產(chǎn)模式���,在該模式下�,部分單元操作為批生產(chǎn)模式,其他2 個或2 個以上單元操作直接相連為連續(xù)模式�。考慮到連續(xù)制造的投入較大����,目前應(yīng)用該模式較為廣泛。
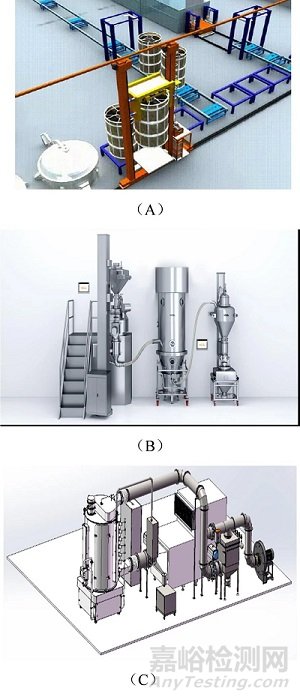
在中藥的前處理環(huán)節(jié)�,中藥傳統(tǒng)提取下開蓋的出料方式與雙效濃縮方式存在藥材利用率低、出料密封圈易老化����、現(xiàn)場環(huán)境差、生產(chǎn)環(huán)境溫度高�、濕度大等問題。華潤江中制藥集團(tuán)使用自動喂料機(jī)����,采取“吊籃式循環(huán)提取”技術(shù),見圖2A�,實現(xiàn)整條提取線無人化,所有輸送設(shè)備可沖洗或擦洗����,所有輸送線均帶有接水����、接渣的料槽�,使得工作環(huán)境得到極大改善,藥液經(jīng)管道輸送至MVR 濃縮設(shè)備�,降低能耗、減少污染物的排放�,實現(xiàn)低溫濃縮。在制粒工序�,將制粒、干燥�、整粒、混合等功能整合密閉���,采用密閉輸送及齊墻的方式����,使用PAT 等手段掌握生產(chǎn)過程進(jìn)而主動控制產(chǎn)品關(guān)鍵質(zhì)量特征�,更加符合EHS 管理體系���,設(shè)備之間可獨(dú)立操作也可實現(xiàn)批次的連續(xù)生產(chǎn)���,現(xiàn)有設(shè)備如宜春萬申制藥機(jī)械有限公司的高密閉連續(xù)制粒線�,見圖2B���,OEB4&OEB5 抗腫瘤制粒線�。在中藥丸劑的連續(xù)化干燥工序����,江西赫柏康華制藥設(shè)備有限公司的中藥丸劑連續(xù)干燥系統(tǒng)將濕物料自智能離心振動干燥機(jī)頂部進(jìn)料口自動進(jìn)入,在重力與振動激振力作用下物料做規(guī)律性離心運(yùn)動���,同時與自下而上的熱空氣進(jìn)行逆流的充分接觸���,濕熱空氣經(jīng)除塵后從排風(fēng)口排出,而干燥完成的物料自干燥塔底部出料口自動排出�,多層逆流干燥降低能耗,連續(xù)化的自動進(jìn)�、出料在增高產(chǎn)量的同時避免人員接觸物料造成污染。
圖2 吊籃式循環(huán)提取示意圖(A)����、高密閉連續(xù)制粒線(B)、中藥丸劑連續(xù)干燥系統(tǒng)(C)外觀示意圖
4.2 新型連續(xù)制造裝備
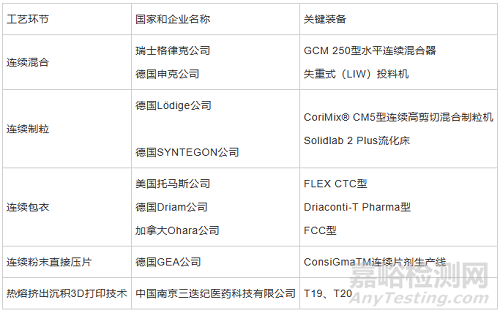
設(shè)計開發(fā)新型連續(xù)制藥裝備�,可實現(xiàn)部分連續(xù)甚至是全過程連續(xù)的生產(chǎn)模式。繼GEA Pharma Systems 公司在全球率先推出制藥連續(xù)制造設(shè)備后,設(shè)備制造商紛紛跟進(jìn)�,L.B. Bohle 公司推出全連續(xù)流化床干燥并建立技術(shù)中心����,將研發(fā)重點(diǎn)從批量生產(chǎn)轉(zhuǎn)移到了連續(xù)制造,Glatt�、Fette 等其他設(shè)備供應(yīng)商也在連續(xù)制造領(lǐng)域推出了相應(yīng)的產(chǎn)品[31],在平臺與系統(tǒng)方面���,GLATT 推出了Modcos 連續(xù)直接壓片系統(tǒng)�、L.B. Bohle 推出了QbCon®連續(xù)生產(chǎn)系統(tǒng)���、SYNTEGON 推出了連續(xù)化生產(chǎn)平臺Xelum�,GEA 推出了ConsiGma® 4.0 連續(xù)制造平臺�,一些固體制劑環(huán)節(jié)的新型連續(xù)制造裝備見表2。
表2固體制劑環(huán)節(jié)的新型連續(xù)制造裝備
在中藥領(lǐng)域����,除了連續(xù)逆流提取、連續(xù)濃縮�、連續(xù)醇沉等單元的物料連續(xù)化生產(chǎn)����,也可考慮單一設(shè)備多功能化。以固體制劑中常見的片劑為例�,其連續(xù)化生產(chǎn)流程見圖3。
圖3 連續(xù)化生產(chǎn)片劑制造流程
4.3 關(guān)鍵核心部件
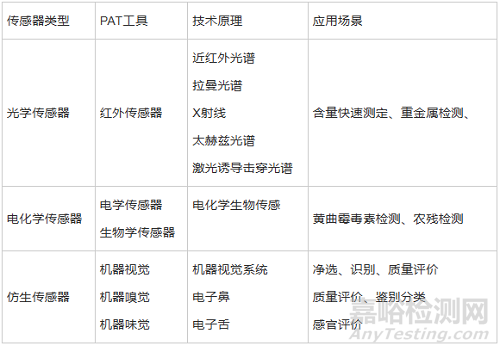
傳感器為連續(xù)制造中關(guān)鍵核心部件���,其適用于組合式連續(xù)制造和獨(dú)立開發(fā)連續(xù)制造2 種模式���,高精度傳感器目前多依賴于國外進(jìn)口,應(yīng)用較多的PAT 供應(yīng)商有Bruker����、Vaivi�、Thermo、Kaiser����、Cobalt 等公司,連續(xù)制造常用傳感器見表3�。傳感器的數(shù)據(jù)被用作過程控制策略的一部分,可用于改變參數(shù)確保CQAS 保持在可接受的范圍內(nèi)�,傳感器的放置位置�、探針深度和清潔采樣面積����、取樣量和采樣頻率等都需要經(jīng)過充分的驗證,同時在傳感器發(fā)生故障時的預(yù)防與糾正措施����、傳感器的校準(zhǔn)和維護(hù)等策略也需充分考慮,傳感器的采樣頻率是實現(xiàn)實時放行檢測的關(guān)鍵���,它需要足夠快以檢測瞬時變化�,并能通過收集足夠的測量數(shù)據(jù)進(jìn)行趨勢分析來檢測過程漂移���,從而根據(jù)可靠的統(tǒng)計數(shù)據(jù)對批次的質(zhì)量進(jìn)行分析。
表3連續(xù)制造常用傳感器
飼料器作為生產(chǎn)過程中的整個物料起始�,是產(chǎn)品性能變異的第一來源,其性能在CM 中非常關(guān)鍵���,需滿足向每個單元輸送物料���,維持產(chǎn)品的處方量并穩(wěn)態(tài)運(yùn)行,達(dá)到隨著時間的推移能夠持續(xù)提供準(zhǔn)確數(shù)量的物料���,確保過程的穩(wěn)定性���,目前常用設(shè)備有失重模式飼料器(loss-in-weight feeders,LIW)����,其進(jìn)料速率由螺桿的轉(zhuǎn)速控制,LIW 控制器根據(jù)對失重速率的監(jiān)控來調(diào)整進(jìn)料器速度以獲得所需的設(shè)定值���。
在中藥制劑過程中����,前處理工序是生產(chǎn)過程的第一道工序����,中藥材的揀選、清洗���、炮制等相關(guān)操作均在前處理工序完成�。前處理過程的處理結(jié)果的好壞���,直接影響后工序的提取效果�。吳志生團(tuán)隊對于紅花染色和摻假問題,結(jié)合計算機(jī)視覺和近紅外���,實現(xiàn)了紅花的快速無損分析�,分析方法快速可靠����,為市場紅花質(zhì)量分類標(biāo)準(zhǔn)的制定提供重要參考[32]。通過基于機(jī)器視覺的中藥藥材自動篩選裝置�,在智能識別系統(tǒng)的基礎(chǔ)上,可搭建紅參自動化分選平臺�,改變了傳統(tǒng)生產(chǎn)方式,等級分選能力極大提高���,增加特等品和一等品的檢出量[33]�。
5����、中藥連續(xù)制造的挑戰(zhàn)
5.1 政策與監(jiān)管方面
在監(jiān)管方面,我國在注冊審評�、核查檢驗方面實施連續(xù)制造存在經(jīng)驗不足、專業(yè)領(lǐng)域人員缺乏等問題���,與國際其他監(jiān)管機(jī)構(gòu)仍有一定的差距�,相關(guān)監(jiān)管配套文件如涉及連續(xù)制造現(xiàn)場檢查、上市后變更等指導(dǎo)文件仍待發(fā)布���,如何將現(xiàn)行GMP 與連續(xù)制造銜接值得思考����。在效益方面���,中藥企業(yè)存在連續(xù)制造初期投入大、老設(shè)備改造難度大���、涉及工藝變更周期長����、數(shù)據(jù)服務(wù)商可靠性不足等問題����,結(jié)合近年來我國中藥集采的推進(jìn),企業(yè)對投入后的利潤產(chǎn)出存在一定擔(dān)憂�,應(yīng)提倡業(yè)界合作,鼓勵藥廠在研發(fā)或建設(shè)階段申請監(jiān)管提前介入���,廣泛聽取意見組織開展實地調(diào)研交流�,深化對先進(jìn)技術(shù)的理解與掌握。
5.2 關(guān)鍵技術(shù)與裝備
中藥產(chǎn)品種類豐富���,不同產(chǎn)地����、不同季節(jié)的中藥表現(xiàn)出的特征圖譜可能不一致����,各類劑型工藝差異較大,加大了中藥作為連續(xù)化控制的難度���,在硬件層面���,我國目前的中藥制劑設(shè)備整體缺乏創(chuàng)新,普遍相互模仿重復(fù)�。符合中藥固體制劑生產(chǎn)特點(diǎn)的設(shè)備仍然不足,一些企業(yè)將化藥設(shè)備稍加改進(jìn)便簡單照搬���,導(dǎo)致了工藝與設(shè)備的適宜性問題����;設(shè)備迭代緩慢;能實現(xiàn)在線數(shù)據(jù)采集���、導(dǎo)入���、處理的自動控制設(shè)備較少。在軟件層面�,國家政策的支持與市場規(guī)范管理為中藥智能化、自動化升級提供了保障����,但在中藥固體制劑領(lǐng)域應(yīng)用人工智能技術(shù)����、自動化技術(shù)、產(chǎn)業(yè)數(shù)字化的范例仍不多����,共性技術(shù)開發(fā)不足,技術(shù)關(guān)注點(diǎn)主要集中在下游生產(chǎn)階段����,對于上游的藥材種植管理關(guān)注不夠。國內(nèi)大部分企業(yè)對中藥工藝質(zhì)量規(guī)律理解還不充分���,對于智能化信息化的理解和數(shù)據(jù)的利用有待深入���,各個生產(chǎn)模塊總設(shè)備接口不同����,未建立設(shè)備通信的標(biāo)準(zhǔn)接口協(xié)議����,企業(yè)手握大量生產(chǎn)數(shù)據(jù)但各個環(huán)節(jié)之間的數(shù)據(jù)缺乏流動與分析,當(dāng)前連續(xù)制造的啟動階段物料損耗仍較大�,中藥浸膏類在線檢測器放置位置的選擇和探頭易污染的問題仍需研究解決。
5.3 新工科制藥工程類人才匱乏
中藥口服制劑連續(xù)制造技術(shù)的技術(shù)人員培養(yǎng)是一個重要課題�,CM 是一種新型的生產(chǎn)工藝,本土制藥企業(yè)對連續(xù)制造工藝具有一定的關(guān)注度�,但認(rèn)識不夠深入,動力不足�,在專業(yè)人才、技術(shù)儲備和儀器設(shè)備開發(fā)等方面存在實際困難�,較為可行的方案是在原有裝備的基礎(chǔ)上進(jìn)行一定的技術(shù)改造。企業(yè)人員面對傳統(tǒng)與智能并行的制造雙通道模式工作量將增加����,從管理層到一線員工都需要加強(qiáng)培訓(xùn),CM 需要藥學(xué)����、工程���、數(shù)學(xué)、計算機(jī)等多領(lǐng)域?qū)W科知識專家支持配合����,但現(xiàn)有技術(shù)人員多為純藥學(xué)研究或純軟件開發(fā),缺少復(fù)合交叉型人才����,高校也未設(shè)置相關(guān)藥品智能制造專業(yè)和課程。下一步可考慮高校開設(shè)相關(guān)課程或與企業(yè)進(jìn)行聯(lián)合培養(yǎng)����,加強(qiáng)技術(shù)人員的在職培訓(xùn)���,使單一的藥學(xué)人才轉(zhuǎn)化為復(fù)合型人才,加速中藥智能制造產(chǎn)業(yè)化���。
6、結(jié)語
《醫(yī)藥工業(yè)發(fā)展規(guī)劃指南》提出引導(dǎo)企業(yè)推動“制造執(zhí)行系統(tǒng)”“過程分析技術(shù)(PAT)”在生產(chǎn)過程中的應(yīng)用����,整合集成各環(huán)節(jié)數(shù)據(jù)信息實現(xiàn)對生產(chǎn)過程自動化控制,有效保證藥品質(zhì)量穩(wěn)定。2019 年新版《藥品管理法》規(guī)定���,國家鼓勵運(yùn)用現(xiàn)代科學(xué)技術(shù)和傳統(tǒng)中藥研究方法開展中藥科學(xué)技術(shù)和藥物研究���,面對突發(fā)疫情,連續(xù)制造技術(shù)可以有效縮短供應(yīng)鏈���,保證藥物的可及性和有效性����。
對于現(xiàn)有批次制造的企業(yè)�,目前仍然存在設(shè)備利用、專業(yè)人才缺口以及前期投資較大等挑戰(zhàn)���。未來制造現(xiàn)場所需人員將大幅減少, 但對技術(shù)人員要求更高����。先進(jìn)裝備不能解決目前制藥行業(yè)的所有問題���,操作人員需要在項目前期跟進(jìn)�,加強(qiáng)對制藥工藝過程和產(chǎn)品質(zhì)量設(shè)計的理解����,以便靈活應(yīng)對生產(chǎn)中可能的出現(xiàn)的狀況�。我國連續(xù)制造發(fā)展尚在起步階段���,需要更多不同行業(yè)的專家參與進(jìn)來���,無論是企業(yè)還是監(jiān)管機(jī)構(gòu),在CM 這一新技術(shù)的實踐上����,都需要化學(xué)工程、處方開發(fā)����、建模仿真、流程控制�,以及傳統(tǒng)藥學(xué)等領(lǐng)域的多學(xué)科復(fù)合型人才共同參與,以加快我國中藥連續(xù)制造技術(shù)和裝備的發(fā)展����,推進(jìn)我國中藥產(chǎn)業(yè)高質(zhì)量高效益發(fā)展�。
參考文獻(xiàn)
[1] 楊明,伍振峰�,王芳���,等.中藥制藥實現(xiàn)綠色,智能制造的策略與建議[J].中國醫(yī)藥工業(yè)雜志����,2016,47(9):1205.
[2] 艾媒咨詢. 2021 全球與中國大健康產(chǎn)業(yè)運(yùn)行大數(shù)據(jù)及決策分析報告[EB/OL] . ( 2021-04-30 ) [2022-12-21] . https ://baijiahao.baidu.com/s?id=1698447533452464968&wfr=spider&for=pc.
[3] PEDERSEN T, KARTTUNEN A P, KORHONEN O, et al. Determination of residence time distribution in a continuous powder mixing process with supervised and unsupervised modeling of in -line near infrared (NIR) spectroscopic data[J]. J Pharm Sci, 2021, 110(3): 1259.
[4] WALTHER J, GODAWAT R, HWANG C, et al. The business impact of an integrated continuous biomanufacturing platform for recombinant protein production[J]. J Biotechnol, 2015, 213: 3.
[5] FOOD AND DRUG ADMINISTRATION. Examples of Accepted Emerging Technologies[EB/OL]. (2022 -02-22)[2023-03-28].https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/examples-accepted-emerging-technologies.
[6] CONGRESS OF THE UNITED STATES. Senate and house of representatives of the united states of America in congress[EB/OL]. (2016-11-13)[2023-03-28]. https://www.gpo.gov/fdsys/pkg/PLAW-114publ255/pdf/PLAW-114publ255.pdf.
[7] Food And Drug Administration. Innovation and continuous improvement in pharma ceutical manufacturing[EB/OL]. (2004-01-01)[2023-03-28].https://www.pharmaceuticalonline.com/doc/innovation-and-continuous-improvement-in-phar-0004.
[8] 國家藥品監(jiān)督管理局藥品審評中心.關(guān)于公開征求ICH 指導(dǎo)原則《013:原料藥和制劑的連續(xù)制造》意見的通知[EB/OL].(2021-10-18) [2023-03-28]. https://www.cde.org.cn/main/news/viewInfoCommon/d30747763265e07fae058d565519070.
[9] 國家藥品監(jiān)督管理局藥品審評中心. 國家藥監(jiān)局藥審中心關(guān)于發(fā)布《化藥口服固體制劑連續(xù)制造技術(shù)指導(dǎo)原則(試行)》的通告( 2023 年第19 號) [EB/OL] . ( 2022-03-20 ) [2023-03-28].https ://www.cde.org.cn/main/news/viewInfoCommon/fcd2eeca1882b5782411bf00fe21e123
[10] FISHER A C, LIU W, SCHICK A, et al. An audit of pharmaceutical continuous manufacturing regulatory submissions and outcomes in the US[J]. Int J Pharm, 2022, 622: 121778.
[11] 徐冰�, 史新元, 羅贛����,等. 中藥工業(yè)大數(shù)據(jù)關(guān)鍵技術(shù)與應(yīng)用[J]. 中國中藥雜志, 2020�,45(2):22.
[12] 伍振峰,林瑞華�,王學(xué)成,等.基于中藥制藥工程質(zhì)量觀的質(zhì)量控制模式研究[J].中國中藥雜志�,2022,47(1):271.
[13] Food And Drug Administration. Quality considerations for continuous manufacturing[S]. New York: Food and Drug Administration, 2019.
[14] LEE S L, O’CONNOR T F, YANG X, et al. Modernizing pharmaceutical manufacturing: from batch to continu ous production[J]. J Pharm Innov, 2015, 10(3): 191.
[15] AFNAN A. PAT-A framework for innovative pharmaceutical development, manufacturing and quality assurance[R]. FDA/RPSGB Guidance Workshop, 2004.
[16] 熊皓舒����,張嬙,章順楠�,等.中藥制藥過程分析技術(shù)方法學(xué)研究與應(yīng)用進(jìn)展[J].中國中藥雜志,2023���,48(1):22.
[17] SCHMIDT A, HELGERS H, LOHMANN L J, et al. Process analytical technology as key‐enabler for digital twins in continuous biomanufacturing[J]. J Chem Technol Biotechnol, 2022, 97(9): 2336.
[18] 李小莉����,薛啟隆,苗坤宏���,等.FPGA 技術(shù)在中藥智能制藥中的應(yīng)用探討[J].中草藥�,2023���,54(1):283.
[19] MIYAI Y, FORMOSA A, ARMSTRONG C, et al. PAT implementation on a mobile continuous pharmaceutical manufacturing system: real -time process monitoring with in-line FTIR and raman spectroscopy[J]. Org Process Res Dev, 2021, 25(12): 2707.
[20] 王晴�, 徐芳芳���, 張欣�, 等. 在線近紅外光譜監(jiān)測桂枝茯苓膠囊流化床干燥過程水分的方法研究[J].中草藥�,2019, 50( 22):5429.
[21] 薛啟隆����,苗坤宏,于洋���,等.基于深度強(qiáng)化學(xué)習(xí)的中藥制藥過程自主優(yōu)化決策方法研究[J].中國中藥雜志���,2023,48(2):562.
[22] 余雅婷���,趙立杰�,杜若飛����,等.淺析專家系統(tǒng)在實現(xiàn)中藥智能制造中的作用與地位[J].世界科學(xué)技術(shù)(中醫(yī)藥現(xiàn)代化),2020����,22(3):843.
[23] 于佳琦,徐冰���,姚璐����,等.中藥質(zhì)量源于設(shè)計方法和應(yīng)用:智能制造[J].世界中醫(yī)藥���,2018���,13(3):574.
[24] 蕭偉����,劉雪松���,凌婭����,等. 一種中藥生產(chǎn)過程知識系統(tǒng)[P]. CN107578104A�, 2018-01-12.
[25] GANESH S, SU Q, PEPKA N, et al. Design of condition -based maintenance framework for process operations management in pharmaceutical continuous manufacturing[J]. Int J Pharm, 2020, 587: 119621.
[26] 曹婷婷,王耘.中藥智能制造理論模型的構(gòu)建[J].中國中藥雜志����, 2019,44(14):3123.
[27] GEA. Improving the ConsiGma 4.0 customer experience with virtual reality[EB/OL]. (2020 -08-25) [2023-03-28].https://www.gea.com/en/stories/improving -consigma-4-customer-experience-virtual-reality.jsp.
[28] 于洋����,司夢蘭,高雪地�,等.MVR 技術(shù)在中藥濃縮過程中節(jié)能優(yōu)化的仿真研究[J].中國醫(yī)藥工業(yè)雜志,2017����,48(11):1610.
[29] DAMMACCO L, CARLI R, LAZAZZERA V, et al. Designing complex manufacturing systems by virtual reality: a novel approach and its application to the virtual commissioning of a production line[J]. Comput Ind, 2022, 143: 103761.
[30] JELSCH M, ROGGO Y, KLEINEBUDDE P, et al. Model predictive control in pharmaceutical continuous manufacturing: a review from a user’s perspective[J]. Eur J Pharm Biopharm, 2021, 159: 137.
[31] PORTIER C, VERVAET C, VANHOORNE V. Continuous twin screw granulation: a review of recent progress and opportunities in formulation and equipment design[J]. Pharmaceutics, 2021, 13(5): 668.
[32] LIN L, XU M, MA L, et al. A rapid analysis method of safflower ( Carthamus tinctorius L.) using combination of computer vision and near -infrared[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2020, 236: 118360.
[33] 李正,于洋,趙靜�,等.一種基于機(jī)器視覺中藥藥材自動篩選裝置[P].CN109499919A,2019-03-22.