近期��,來自美國天普大學的Santiago Orrego研究員在科愛創(chuàng)辦的期刊Bioactive Materials上發(fā)表文章。本綜述文章報道了抗菌應用的生物活性��、刺激響應和自主牙科材料的設計����、評估、優(yōu)勢和局限性����。首先,討論了智能生物材料的重要性和分類����。其次,根據(jù)不同的刺激����,包括pH、酶����、光、磁場等����,列出了生物響應抗菌牙科材料的類別����,討論了它們的抗菌機制����、應用和實例�����。最后�����,研究了開發(fā)這些技術的臨床相關應用所面臨的局限性和障礙����。
1. 引言
與骨骼不同,牙齒的自我再生能力有限�����,牙釉質(zhì)是無細胞的��,不能自我再生��。牙本質(zhì)的自我再生能力也受到牙髓干細胞庫的限制和制約。因此我們依賴牙科材料來治療和改善口腔健康����。
然而,口腔微環(huán)境使牙科材料面臨著挑戰(zhàn)��。細菌可以產(chǎn)生使硬組織脫礦產(chǎn)酸����,從而導致直接和間接修復的失敗。它們通過干擾唾液中的酶來實現(xiàn)這一點����,從而導致牙科樹脂粘合劑的水解降解。理想的牙科材料需要對抗病原體�����,防止水解降解����,促進牙齒再礦化,與組織牢固結合��,并使牙齒組織再生以治療牙科疾病。到今天為止����,我們?nèi)匀粵]有找到用于不同牙科治療的最佳材料。
技術和制造工具的最新進展使“智能”牙科材料的開發(fā)成為可能��。一般來說����,“智能”生物材料會根據(jù)刺激改變一個或多個性能�����。例如��,在疾病的進展期可以觸發(fā)智能生物材料在需要的時刻釋放用于治療的特定藥物��。智能生物材料的定義非常寬泛����,經(jīng)常被誤解,而且不具有包容性��,阻礙了具有不同“智能”功能的生物材料的識別和分類��。
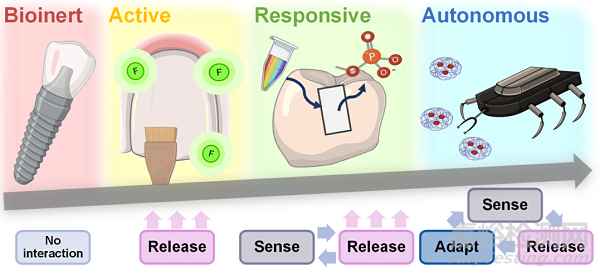
Fig. 1. Levels of smart biomaterials are classified as bioinert, bioactive, bioresponsive, or autonomous. Bioinert biomaterials cause minimal interaction with surrounding tissues and are the least smart. Bioactive materials release an active therapy after implantation to elicit a specific biological response at the material- tissue interface. Bioresponsive materials react to in-ternal or external stimuli releasing specific agents for therapy. Finally, autonomous (or self-sufficient) materials respond holistically to the microenvironment complexity (adapting to changing conditions).
為了解決這一問題,Montoya等人特意根據(jù)智能化程度對智能生物材料進行分類��,智能化程度由生物材料與周圍環(huán)境的相互作用程度以及提供治療的精確度決定����。他們定義了四個級別的智能生物材料,包括生物惰性��、生物活性�����、生物反應性和自主性(圖1)����。
生物惰性生物材料與周圍組織的相互作用最小,植入后對周圍組織的傷害或毒性最小����。例如,聚醚醚酮(PEEK)是一種安全��、化學惰性的生物材料�����,用于口腔植入物、牙冠�����、牙橋�����、內(nèi)支架和義齒框架制作��。其他生物惰性牙科材料包括不銹鋼��、鈦和聚甲基丙烯酸甲酯(PMMA)��。生物活性材料在植入或接觸組織��、細胞或體液后��,在材料-組織界面誘導特定的生物反應��。在這種情況下�����,生物活性指的是提供有益治療的材料(例如抗菌�����、再生����、藥物遞送),而不是僅提供再礦化的生物材料����。這些生物材料安裝在體內(nèi)后“不受控制”地釋放治療。例如��,釋放氟化物的化合物可以穩(wěn)定牙齒的循環(huán)脫礦和再礦化過程�����。當唾液pH值小于5時��,氟離子取代牙齒羥基磷灰石中的OH離子��,導致氟磷灰石(FA)或氟羥基磷灰石(FHA)的形成��,這些化合物更能抵抗pH值的變化��,從而抵抗脫礦��。此外,氟化物通過抑制細菌生長并干擾其嗜酸性����、耐酸性和對牙齒表面的粘附,對細菌細胞具有毒性��。
生物惰性牙科材料可以通過表面涂層或功能化升級為生物活性材料�����。響應性����、生物響應性或刺激響應性生物材料可以“感知”特定刺激(如光、溫度����、pH變化�����、電場和磁場����、酶)��,然后通過釋放預編程來“響應”治療��。它們可以對體內(nèi)或體外信號做出反應����。例如��,牙科復合材料是用對pH敏感的NP制成的��,這些NP在一定的pH水平(酸性)下提供抗菌劑來治療齲齒����。最后,自主生物材料可以感知多種刺激��,并相應地調(diào)整它們的反應��,以在不同的時間點為每種需求提供適當?shù)姆磻?���。這類生物材料是最聰明的。例如�����,負載抗菌療法的磁驅(qū)動納米機器人能夠穿透根性牙本質(zhì)中的牙本質(zhì)小管,以消毒和治療根管感染��。然而�����,牙科尚未充分利用這些智能生物材料改善口腔健康�����。
近年來����,智能生物材料在醫(yī)學不同領域的應用呈指數(shù)級增長。它們具有廣泛的應用�����,如藥物遞送����、生物傳感器�����、組織工程、抗菌藥物�����、組織再生和再礦化等��。牙科開始受益于這些生物材料的智能化功能�����。本文旨在匯編智能生物材料是如何應用于牙科抗菌治療�����。
2. 口腔環(huán)境和對抗菌牙科材料的需求
口腔是人體中第二復雜的微生物群落��。它由細菌����、病毒、真菌和原生動物組成��。700多種微生物在口腔內(nèi)形成生物膜��,口腔生物膜通常以共生(平衡)狀態(tài)共存�����。在這些條件下,致病性口腔微生物的增殖受到抑制�����,從而防止疾病的發(fā)展����。例如,宿主的免疫系統(tǒng)與其微生物共生體(共生物種)之間的積極相互作用可以防止口腔粘膜的急性感染�����。當微生物組內(nèi)的平衡被破壞時�����,就會發(fā)生生物失調(diào)�����。在這種情況下����,與疾病相關的病原體數(shù)量增加,而共生體數(shù)量減少��。導致口腔微生態(tài)失調(diào)的因素包括唾液(流量/成分)的變化�����、口腔衛(wèi)生不良��、抗生素治療和生活方式選擇(飲食��、吸煙)����。例如,修復體和牙齒組織之間的界面含有細菌��,這些細菌無法用傳統(tǒng)的清潔方法去除�����,導致繼發(fā)性齲齒和修復失敗����。除了生物因素外,口腔健康還涉及社會、經(jīng)濟��、政治和文化方面(如社會結構和健康信念)�����。例如�����,社會經(jīng)濟不平等(即收入和教育機會)�����,以及公共政策和服務的可獲得性��,會影響人口的總體健康狀況以及醫(yī)療和牙科服務的使用����。
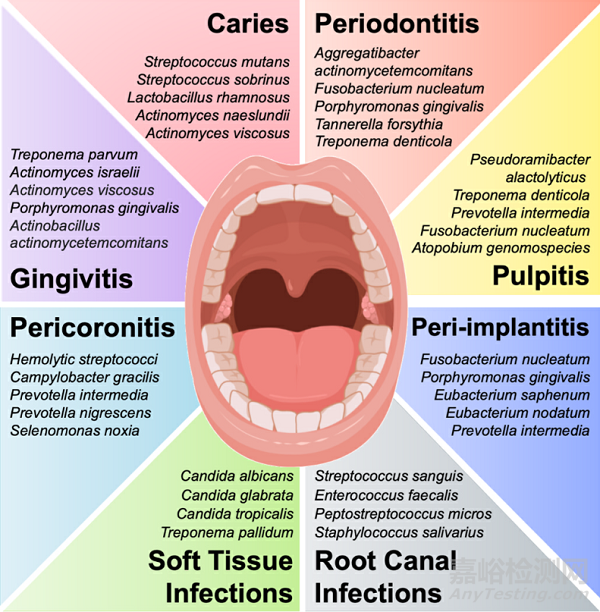
Fig. 2. Pathogen microorganisms associated to oral and systemic diseases.
微生物群自然平衡的有害變化可能導致口腔疾病,如齲齒����、牙周炎、根管感染��、種植體周圍炎、牙髓炎�����、念珠菌感染�����、義齒口腔炎和軟組織感染(圖2)��。例如����,在齲齒中��,糖攝入量的增加和唾液流量的減少會導致產(chǎn)酸和耐酸細菌(如變形鏈球菌)的生長����,這些細菌會使硬組織脫礦并抑制共生物種的生長。如果致病性生物膜得不到控制�����,口腔感染可能會成為慢性感染��,導致牙齒組織損傷,甚至導致牙齒缺失�����。因此��,開發(fā)提供抗菌療法的牙科材料對于預防牙齒感染和早期治療失敗是必要的�����。
盡管口腔感染通常具有多微生物性質(zhì)��,但特定的病原體與特定的牙齒感染有關��。開發(fā)抗微生物生物材料的主要策略是阻止這些病原體的生長�����。例如����,變形鏈球菌是與齲齒相關的主要病原體,而白色念珠菌的過度生長與念珠菌誘導的義齒口炎的發(fā)展有關����。大多數(shù)抗齲齒生物材料僅針對這種病原體進行測試��。然而����,感染通常是多微生物的�����。變異鏈球菌并不是單獨作用于齲齒的發(fā)展��,因為不同微生物之間存在相互作用�����。例如����,白色念珠菌和變形鏈球菌在齲齒發(fā)展過程中具有強烈相互作用����,這種相互作用產(chǎn)生的微生物產(chǎn)物刺激變異鏈球菌在生物膜內(nèi)的積累,導致疾病的嚴重程度和治療難度增加��。開發(fā)抗微生物牙科材料的更復雜策略包括靶向治療與特定感染相關的特定毒力基因��,或通過信號分子的酶降解、阻斷信號生成和阻斷信號接收來中斷細菌通訊機制(即群體猝滅)����。
3.用于抗菌和抗生物膜療法的智能牙科材料
牙科領域已經(jīng)使用了大量的抗菌劑來治療不同的感染。這篇綜述是介紹提供這些抗菌劑的不同策略的新綜述��,這些抗菌劑是根據(jù)生物材料的智能水平分類的��。例如����,銀是一種用于治療/預防齲齒的傳統(tǒng)抗菌劑。該試劑的一種常見遞送方法是在表面上涂覆涂層(例如SDF–氟化二胺銀)����。然而,由于銀現(xiàn)在可以制造成納米尺寸��,它可以封裝或裝載在不同載體中�����,以實現(xiàn)“復雜”或“智能”的交付����。此外��,該領域還開發(fā)了牙科材料����,通過將不同的試劑組合到單一載體中��,提供多種抗菌功能(例如殺死病原體和破壞生物膜基質(zhì))��。本文展示了牙科中用于遞送/釋放抗菌劑的不同方法��,包括生物活性��、生物響應和自發(fā)性�����。
3.1.生物活性抗微生物療法
在生物活性療法中使用不同的抗微生物劑�����,包括化合物(例如抗生素�����,如氯己定(CHX)�����、二甲胺四環(huán)素)�����、陽離子單體例如甲基丙烯酸季銨��,MDPB)����、抗微生物肽(AMP)以及金屬和非金屬填料(例如氧化鋅)。
生物活性技術通常包括將這些抗菌劑摻入載體(生物材料)中��,以在植入后立即提供治療��。例如����,可浸出的抗生素,如CHX����、四環(huán)素和甲硝唑已被摻入粘合劑、密封劑和義齒中,防止生物膜形成并抑制微生物生長�����。已經(jīng)研究了納米空間中抗菌劑的其他載體����,包括樹枝狀聚合物、納米膠囊�����、核殼����、脂質(zhì)體、膠束和納米纖維����。由于其大的接觸表面�����,納米纖維被用作高負載載體����,而膠束由于其易于操縱和封裝試劑而被優(yōu)選��。這些納米載體的優(yōu)點是改善了對藥物釋放的控制��、藥代動力學����,增加了藥物選擇性�����,從而提高了治療效果��。這些具有生物活性的抗微生物制劑中的許多已經(jīng)在臨床實踐中使用����。
生物活性單體通常摻入牙科樹脂(復合材料、底漆和粘合劑)中��,用于抗菌治療�����。它們在未聚合時表現(xiàn)出優(yōu)異的抗菌效果����,但在聚合后也具有接觸抑制效果�����?���?咕鷨误w也可以固定在聚合物鏈內(nèi)��,但也可以自由地作為可浸出的化合物����。最近的工作重點是增加單體濃度(高達5%),以提高抗菌效果�����,同時不影響生物相容性��、溶劑吸附��、機械和固化性能�����。這些制劑已經(jīng)對各種革蘭氏陽性和革蘭氏陰性細菌進行了測試��,包括齲齒和腸道相關病原體��。
生物活性填料作為一種很有前途的策略�����,已引起人們的關注����,以克服微生物對抗生素耐藥性的擔憂通常,這些填料是無機的(如金屬)����,在納米尺度上由幾十納米制成,形狀各異��。最常見的填料是納米結構(銀��、氧化鋅�����、鈦和銅化合物�����、玻璃、納米金剛石)�����、聚合物/有機物(季銨聚乙烯亞胺����、殼聚糖)和AMPs。
為了實現(xiàn)抗菌治療��,填充物或其離子被釋放到微環(huán)境中以阻止病原體����。NP作為填料的使用提供了廣泛的定制可能性。例如����,可以通過改變填料尺寸、表面積與質(zhì)量比�����、顆粒形狀��、表面電荷、劑量和NP涂層來提高NP的抗菌/抗生物膜響應��。此外��,可以對填充物進行修飾��,以針對副作用較少的特定病原體�����。(生物)分子的吸附����、官能團的添加和填料表面電荷的改變會誘導對某些細菌的抗菌選擇性�����。在牙科復合材料中��,填料的量會影響材料的性能(結構��、美觀�����、化學、生物)����。例如,將高達7.5%的ZnO NP添加到標準牙科粘合劑中�����,促進了生物膜的大量細菌減少�����,同時保持了可接受的轉(zhuǎn)化程度�����、彎曲強度和彈性模量�����。
抗菌肽對革蘭氏陽性和革蘭氏陰性細菌�����、真菌����、寄生蟲和病毒具有廣譜抑制活性��。它們的抗菌活性與構象(α-螺旋)�����、凈電荷和疏水性有關。AMPs存在于唾液����、齦溝液(如組胺-1,3和5)��、上皮(如腎上腺髓質(zhì)素����、β-防御素)和中性粒細胞(α-防御素。天然AMPs作為防御各種微生物毒力因子的機制�����。例如�����,組胺蛋白可作為預防繼發(fā)性齲齒(變形鏈球菌)的抗菌劑,而成熟的α-防御素對大腸桿菌����、糞腸球菌和白色念珠菌具有抗菌活性。AMPs可以來源于天然(如微生物��、植物��、昆蟲����、甲殼類動物、哺乳動物)或合成來源����。作為抗微生物劑,AMPs已被納入粘合劑系統(tǒng)和植入物涂層中�����。例如����,ε-聚賴氨酸被添加到樹脂系統(tǒng)中,并成功測試了與牙周炎和齲齒相關的口腔病原體?����?咕鶤MPs的使用也已擴展到體外測試牙本質(zhì)復合物界面����,顯示出對兩種關鍵的產(chǎn)酸初始定植體以及與失敗的復合修復體相關的最豐富的分類群的選擇性抗菌效力。AMPs的研究已經(jīng)進入臨床試驗階段�����,并取得了樂觀的結果�����,可以進行商業(yè)化��。與傳統(tǒng)抗生素相比��,抗菌肽的主要優(yōu)點是細菌耐藥性最小�����,起效快��,對哺乳動物細胞毒性較小��。此外����,抗菌肽具有針對特定細菌群的能力。但AMPs仍然存在許多重大挑戰(zhàn)�����,包括隨著藥物間隔時間的減少��,抗菌活性降低�����,溶血率高�����,提取成本高��,半衰期短(<37小時)����,體內(nèi)穩(wěn)定性低�����。
抗菌涂層也是生物活性療法的一部分����。對于種植體牙科����,涂層可以防止細菌在種植體表面定植和生物膜形成,并成功減少了種植體周圍粘膜炎����、種植體周圍炎和種植體損失。制造抗菌涂層的策略包括接觸和釋放殺傷表面�����。接觸殺傷表面基于表面附著的抗微生物元素�����,如季銨化合物�����、AMP和抗微生物酶(AMEs)��?����?咕繉油ǔ��;谒幬镞f送系統(tǒng)和離子釋放涂層�����,如Ag����、Au、Zn和Cu�����。與抗生素相比����,抗菌涂層具有一些優(yōu)勢,尤其是在其局部活性方面����。然而�����,在某些情況下��,當其達到最大抗菌性能時�����,其生物相容性和骨螯合可能會受到影響�����。
盡管這些生物活性抗微生物劑中的一些已經(jīng)在商業(yè)上使用��,但仍存在一些局限性����。首先����,長期提供抗微生物療法是有問題的��,因為它可能通過細菌之間的水平基因轉(zhuǎn)移引起抗微生物耐藥性。這些技術在植入后立即開始釋放藥劑��,導致與治療持續(xù)時間(壽命)相比����,效果迅速耗盡。通常情況下����,可浸出劑的抗菌效果小于1年。一旦耗盡����,藥劑就無法再補充。其次��,抗菌劑的釋放可能導致載體的性能發(fā)生變化��。例如����,與不含抗菌劑的相同材料相比,含有失效劑的牙科復合材料����、密封劑或粘合劑可能對機械和物理性能有害����。第三����,抗微生物劑的不受控制的釋放對適當劑量的遞送提出了挑戰(zhàn)。這種不受控制的釋放可以加速藥劑消耗或提供不足量的藥劑用于治療����。通過使用納米載體在一定程度上規(guī)避了這一點。第四��,缺乏靶向性會導致附帶損害(殺死共生物種)和口腔微生物群的潛在失衡�����,因為這種療法會“攻擊”它在微環(huán)境中遇到的一切�����。第五����,盡管化合物的使用有一些好處��,如高療效�����、高治愈率和應用的微創(chuàng)程序��,但其使用仍然引起了人們對微生物對抗生素耐藥性的擔憂�����。
最后�����,盡管幾項臨床試驗已經(jīng)成功評估了納米顆粒在不同牙科材料中作為抗菌劑的用途�����,但由于擔心有毒離子的釋放會導致健康細胞的炎癥、免疫毒性����、細胞毒性和遺傳毒性����,納米顆粒在臨床實踐中的廣泛使用受到限制��。
3.2.生物響應性抗微生物療法
生物或刺激響應性生物材料是指能夠感知刺激,然后通過釋放治療劑對其做出反應的生物材料��。通常��,抗菌劑被納入載體/載體(生物材料)中�����,旨在通過改變其性能(例如降解)來響應特定刺激�����。為了釋放抗菌劑�����,一些載體在對刺激做出反應后可能會改變其結構或性能����。生物響應性抗生物材料由于能夠克服生物活性抗微生物療法的一些局限性,包括單個病原體的靶點以及治療的有效性��、劑量�����、位置和持續(xù)時間的提高����,而受到了相當大的關注����。在牙科中��,這些響應性抗菌技術是由不同的內(nèi)部刺激觸發(fā)的,包括微環(huán)境信號(病原體產(chǎn)生的唾液酶和低pH水平)�����、微生物的代謝產(chǎn)物(分泌酶)��,或通過靶向微生物表面的特定肽/蛋白/基因�����。這些反應性生物材料也是由外部(體外)刺激觸發(fā)的��,包括尿酸和產(chǎn)酸,在疾病進展過程中顯著改變微環(huán)境的pH水平����。
在牙科中,樹脂(粘合劑/密封劑)����、水凝膠和納米載體(膠束)已被用作治療感染的pH響應抗菌技術的“智能”載體�����。通常��,在所需的pH水平下�����,具有弱酸(如羧酸)或堿(如伯胺和叔胺)基團的聚合物會導致電離��、表面活性、鏈構象��、溶解度和構型的變化��。例如,甲基丙烯酸十二烷基甲基氨基乙酯(DMAEM)是一種叔胺(TA)樹脂����,在牙科中用作pH響應樹脂。DMAEM具有可逆的質(zhì)子化和去質(zhì)子化反應����,以響應pH水平的變化�����,在酸性條件下通過形成季銨單體表現(xiàn)為陽離子聚合物(抗菌劑)����。Liang等人(2020)將DMAEM摻入牙科粘合劑樹脂中(5%)�����,在酸性介質(zhì)(pH<6)存在的情況下提供抗菌效果。這種可逆的pH響應性和非藥物釋放性牙科粘合劑可以在不干擾口腔微生態(tài)平衡的情況下實現(xiàn)長期防齲效果��。在最近的一項后續(xù)研究中�����,該團隊成功地將DMAEM的使用轉(zhuǎn)化為樹脂基密封劑,以防止長期微滲漏�����。
釋放抗菌劑的pH響應水凝膠也已用于牙科��。最近的一項工作設計了一種N-二甲基氨基乙基甲基丙烯酸酯(DMAEMA)-甲基丙烯酸-2-羥乙酯共聚物(HEMA)(聚(DMAEMA-co-HEMA)水凝膠�����,該水凝膠能夠響應pH水平釋放CHX(抗菌劑),以預防和治療齲齒��。這種生物反應性生物材料抑制了變異鏈球菌生物膜的發(fā)育����,并調(diào)節(jié)了口腔微生態(tài)系統(tǒng)�����。在另一項研究中,將含有CHX的納米多孔二氧化硅NP與聚(4-乙烯基吡啶)水凝膠混合��。在酸性pH值(<4.0)下�����,聚合物發(fā)生質(zhì)子化并釋放出抗菌劑����。在生理pH值(7.0)下��,聚合物防止了藥劑的釋放。該系統(tǒng)已成功地針對致齲病原體(變形鏈球菌)進行了測試����。水凝膠響應于pH水平而膨脹/塌陷,以控制藥物的釋放和容納����。最近的一項工作使用pH響應水凝膠作為防污殺菌涂層����。致齲細菌的生長降低了水凝膠表面的pH水平,從而引發(fā)了表面電荷的轉(zhuǎn)移����。在吸引病原體后�����,負載的八肽被釋放以發(fā)揮抗菌作用����?����?偟膩碚f��,pH敏感水凝膠在牙科應用中表現(xiàn)出了穩(wěn)定性、細胞相容性和適當?shù)臋C械性能��。pH響應性納米載體��,如納米凝膠����、膠束����、聚合物-藥物偶聯(lián)物�����、核殼NP和納米球�����,已被用作這些類型生物材料的載體��。
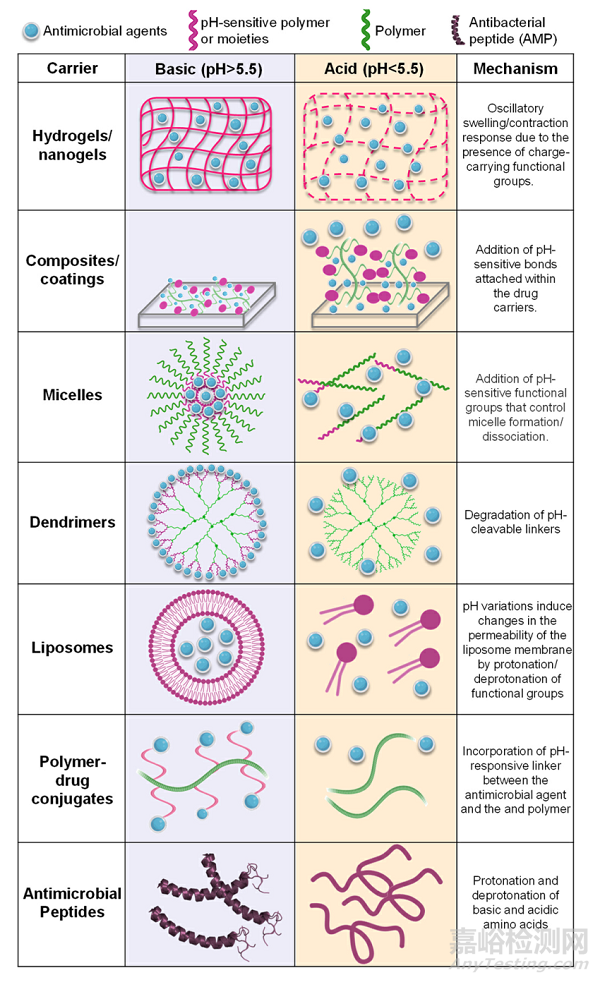
Fig. 3. Configurations used as pH-responsive carriers for the delivery of oral antimicrobial therapies. After degradation/cleavage of the pH-sensitive bonds/ compounds, the carriers release their payloads, which can be in the form of antimicrobial compounds, nano-fillers, or antimicrobial peptides.
通常,這些化合物是用pH可降解的鍵��、pH可裂解的交聯(lián)或包含電荷轉(zhuǎn)移聚合物來制造的����,當被刺激物激活時,電荷轉(zhuǎn)移聚合物將其有效載荷釋放到環(huán)境中(圖3)。pH響應性納米載體保護包封劑不被降解��,并可以以可控的方式釋放其產(chǎn)物�����。此外��,由于生物膜內(nèi)滲透性的增加以及藥劑穩(wěn)定性和溶解度的提高����,藥劑的局部釋放增加了治療效果。此外��,最近的一項研究制造了季銨殼聚糖脂質(zhì)體的pH響應NP,以對抗生物膜和治療牙周炎�����。該制劑顯示出可接受的細胞毒性,并在體內(nèi)抑制牙齦炎癥和牙槽骨損失�����。幾項研究報道了一系列pH響應性NP的開發(fā),用于體外和體內(nèi)治療齲齒����。總體而言��,NP對口腔微生物群多樣性以及粘膜和牙齦組織沒有顯示出不良影響�����。
pH響應型抗菌肽最近為開發(fā)具有更高細菌選擇性的口服抗菌技術開辟了新的機會����。一種創(chuàng)新的方法是通過將AMPs封裝到這些納米載體中,將AMPs的抗菌能力和pH響應納米載體的可調(diào)諧性結合起來��。AMPs的封裝和遞送是保護肽免受酶降解的一種很有前途的策略��。
酶響應:酶是加速生物化學反應的催化劑。細菌和真菌分泌各種酶�����,包括脂肪酶�����、酯酶�����、磷酸酶��、脲酶��、明膠酶等�����。其中一些酶已被確定為指示疾病活動期的標志物����,即需要治療的時候����。例如,慢性牙周炎的細菌副產(chǎn)物是基質(zhì)金屬蛋白酶-8(MMP-8)����,它會觸發(fā)宿主免疫反應。這種酶已被用作治療牙周炎的生物反應遞送系統(tǒng)中的刺激物����。
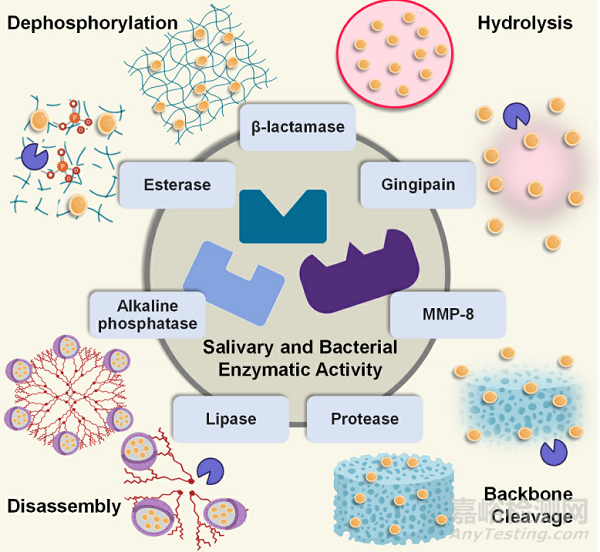
Fig. 4. Schematic representation of the typical drug delivery mechanisms used by enzyme-responsive antimicrobial dental materials. The listed salivary and bacterial enzymes activate enzyme-responsive materials such as membranes, nanocarriers (liposomes, dendrimers), nano-hydrogels, or polymer composites to release antimicrobial therapies such as antimicrobial compounds, nano- fillers, or antimicrobial peptides.
通常,酶響應性生物材料可以被編程為對不同的酶做出反應��,包括細菌(即酯酶��、磷酸酶、磷脂酶�����、β-內(nèi)酰胺酶和明膠酶)、細胞表面酶(即MMPs)和唾液(即脂肪酶����、蛋白酶、酯酶�����、α-淀粉酶��、脫水酶��、溶菌酶)(圖4)�����。在這類生物材料中��,酶響應在催化過程中具有高效性����、高選擇性和特異性,避免了傳統(tǒng)抗菌療法不分青紅皂白地殺死細菌的局限性����。在酶響應系統(tǒng)中,抗微生物劑在可降解載體(例如����,聚(丁二酸乙二醇酯)(PES)、聚己內(nèi)酯(PCL)����、透明質(zhì)酸、PEG)通過暴露于酶活性而降解后釋放����。酶可能導致載體中的水解、溶脹����、主鏈斷裂、降解�����、分解��、磷酸化和去磷酸化�����,從而導致制劑在靶位點釋放。
與其他響應性生物材料相比��,被酶水平激活的生物材料離實現(xiàn)自主又近了一步����。由于酶水平是一種內(nèi)源性刺激,生物材料的激活不需要外部刺激��,因此��,宿主可“調(diào)節(jié)”藥劑的釋放��。
光響應:這些抗微生物生物材料在被光激發(fā)后對抗病原體。已經(jīng)開發(fā)出許多出色的光響應抗菌生物材料��,包括光催化劑�����、光敏劑(PS)和光熱材料��。
具體而言�����,抗微生物光動力療法(aPDT)利用無害的光來激活非毒性或最小毒性的PS�����,以產(chǎn)生用于根除病原體的細胞毒性物質(zhì)(例如活性氧(ROS))����。ROS(O2、H2O2�����、羥基自由基(·OH))的產(chǎn)生會對細菌膜和細胞壁造成損傷,破壞脂質(zhì)��、蛋白質(zhì)和離子通道�����,去除關鍵代謝酶����,細胞凝集,并直接抑制脂多糖����、膠原酶和蛋白酶等外源毒力因子。而aPDT是一種非侵入性技術��,與傳統(tǒng)療法相比具有優(yōu)勢����。這些優(yōu)勢包括降低抗微生物耐藥性�����,在不高PS濃度的情況下加速抗微生物消除��,在不影響潛在結構和組織的情況下產(chǎn)生局部作用,開/關觸發(fā)��,以及對革蘭氏陽性和革蘭氏陰性細菌病原體的廣泛抗微生物譜����。由于該技術對各種口腔微生物病原體具有抗菌作用,因此在牙科中越來越多地用于治療齲齒����、念珠菌感染、牙周炎����、牙髓病和種植體周圍炎��。
作為提高抗菌效果的一種策略�����,NP已被用作PS的載體�����,以避免PS的聚集和抗微生物耐藥性�����,并增強其對生物膜基質(zhì)和細菌細胞壁的滲透����。諸如富勒烯��、石墨烯、氧化石墨烯�����、碳納米管和金屬氧化物NP(即ZnO、TiO2��、Au、Ag)等NP由于其高穩(wěn)定性�����、產(chǎn)生ROS的能力����、熱性能��、光學性能和生物相容性財產(chǎn)而被優(yōu)先用作PS��。
可生物降解水凝膠�����、膠束�����、脂質(zhì)體和聚合物NP作為PS納米載體的制備允許PS在感染部位局部釋放�����,降低副作用的風險�����,并提高治療效果��。這些納米載體是“雙重智能”的����,因為PS的釋放是在載體因水解����、化學或酶促反應而降解后發(fā)生的。此外��,一旦PS在感染部位釋放,輻射就誘導抗微生物治療��。
使用光來殺死口腔病原體已被建議作為一些牙科治療(即齲齒、蛀牙����、種植體周圍炎)的輔助治療和局部消毒治療(即根管消毒)。例如��,為了治療蛀牙�����,將ZnO��、氟改性納米二氧化硅和聚二甲基硅氧烷(PDMS)混合制成的牙科涂層噴涂在牙齒表面時,可有效抵抗細菌和蛋白質(zhì)的粘附�����。與單獨的藥物相比,近紅外輻射在口腔生物膜滲透和破壞方面提供了增強的效力����。缺氧微環(huán)境中的抗菌作用由于持續(xù)的氧氣消耗和光穿透深度的不良激發(fā)而受到阻礙。為了克服這些挑戰(zhàn)�����,已經(jīng)提出了氧氣自生成(O2)、一氧化碳(CO)和一氧化氮(NO)生物材料系統(tǒng)�����。
光響應材料的局限性包括對革蘭氏陰性菌的抗菌活性低����、成本高�����,以及當組織與特定類型的光源(即亞甲基藍)接觸時牙齒染色/變色����。此外��,PS浸漬牙本質(zhì)導致粘結強度降低,在某些情況下��,治療過程中溫度過高會導致組織創(chuàng)傷和損傷����。應用aPDT后細胞活力的降低需要進一步研究。
電刺激:多年來�����,人們一直在研究電荷(即電流)對微生物生物膜的影響�����,將其作為化學療法的替代方案����,而不會導致抗生素耐藥性�����,或作為提高傳統(tǒng)療法有效性的輔助療法。這種方法的優(yōu)點是高度的空間覆蓋和時間可控性�����、快速的行動和最小的入侵�����。電荷摧毀病原體的能力不僅取決于細菌菌株�����,還取決于電荷的大小、密度和極性�����。針對口腔病原體,電荷已顯示出對牙齦卟啉單胞菌�����、變形鏈球菌����、糞便大腸桿菌����、白色念珠菌等的抗菌反應�����。通常情況下,低電流水平<30 mA持續(xù)不到30分鐘。
Montoya等人對生物活性材料進行了評估����。提出了幾種機制來解釋電荷的殺傷能力����。這些機制包括直接接觸理論����,其中電流通過破壞細胞膜的完整性直接導致細菌死亡�����。間接殺傷理論通過活性有毒物質(zhì)(即ROS��、活性氮物種(RNS))的產(chǎn)生����、pH和溫度變化以及電流來解釋��。然而,高濃度的ROS會影響一般的炎癥信號傳導和/或誘導細菌突變����,使其對治療不太敏感�����。他們提出了幾種機制來解釋電荷的殺傷能力��。這些機制包括直接接觸理論,其中電流通過破壞細胞膜的完整性直接導致細菌死亡�����。間接殺傷理論通過活性有毒物質(zhì)(即ROS、活性氮物種(RNS))的產(chǎn)生����、pH和溫度變化以及電流來解釋。然而,高濃度的ROS會影響一般的炎癥信號傳導和/或誘導細菌突變�����,使其對治療不太敏感��。
磁響應:靜態(tài)和脈沖磁場在臨床上用于治療骨折和促進骨形成。在牙科領域��,磁響應NP已被用于治療感染和超敏反應��、提高結合強度��、靶向藥物遞送����、組織工程和齲齒風險評估��。在抗菌應用中�����,磁性NP主要用于將抗菌劑定位或移動到更靠近感染部位的位置。這在牙科中非常有吸引力����,因為感染部位通常位于組織深處��,無法治療��。
最近的工作將用于aPDT的PS和用于定位PS的磁性NP結合起來��,開發(fā)了一種多功能材料�����,該材料對牙周炎相關病原體具有較強的抗生物膜活性��,具有可接受的生物相容性�����、實時監(jiān)測和磁性靶向能力�����。磁反應有助于將PS定位在牙周袋的深處��,以有效去除病原體�����。
使用磁性NP時存在一些局限性,包括凝聚的趨勢��、毒性水平����、對長期穩(wěn)定性的擔憂以及使用單個磁體時定位的方向性有限�����。
咀嚼/振動響應:口腔環(huán)境可以通過咀嚼從日常生物力學運動中提供的力中受益匪淺��,從而實現(xiàn)抗菌治療����。
壓電材料產(chǎn)生電荷以響應力��。最近�����,研究表明,這些電荷能夠?qū)谇徊≡w進行抗菌治療�����。例如,將壓電NP(即鈦酸鋇-BaTiO3)添加到牙科復合材料和義齒中��,僅當材料受到機械刺激(電荷產(chǎn)生)時��,才顯示出對變形鏈球菌和白色念珠菌生物膜的抗菌反應�����。壓電電荷的抗菌機制可以通過細胞產(chǎn)生的細胞內(nèi)ROS水平增加來解釋�����,這表明氧化應激�����。需要對牙科復合材料和義齒周圍的壓電電荷分布進行額外的研究�����,以確保均勻的抗菌效果����。此外����,關于病原體選擇性和極化方向(正方向與負方向)的影響的問題仍需回答��。
其他刺激:其他不同類型的刺激也被提出,但探索和研究較少�����。葡萄糖響應生物材料系統(tǒng)已經(jīng)被開發(fā)用于牙科應用�����。例如��,殼聚糖葡萄糖響應性水凝膠可以使用預先設計的pH響應性水凝膠上的固定化葡萄糖氧化酶(GOx)來檢測葡萄糖水平�����。這是因為固定化GOx可以根據(jù)感測到的葡萄糖水平將環(huán)境葡萄糖氧化為葡萄糖酸����。水凝膠釋放控制劑量的甲硝唑����,作為對抗牙齦卟啉單胞菌的抗菌療法。另一種方法是使用葡萄糖敏感的抗菌抗炎殼聚糖水凝膠膜����,控制單寧酸的釋放��。添加單寧酸增加了薄膜的機械性能�����,并證明了具有足夠的生物相容性,可以抑制亞硝酸鹽��、白細胞介素-6(IL-6)和腫瘤壞死因子-α(TNF-α)的抗炎作用。
聲動力療法(SDT)是一種新興的根除腫瘤和感染的方法����。超聲暴露后,聲敏劑(類似于PS)產(chǎn)生ROS以消滅細菌��。SDT的優(yōu)點包括深入組織�����,產(chǎn)生空化以增強聲敏劑對生物膜的滲透性��,無侵入性,時空選擇性高����,無細菌耐藥性����。
3.3.自主抗微生物療法
自主生物材料可以感知、響應不同的療法����,并適應不同形式的刺激��。它們的自然反饋允許生物材料與生物系統(tǒng)完全集成����。例如����,水凝膠可以被編程為基于其本地環(huán)境專門提供的輸入來執(zhí)行復雜的計算。不同專業(yè)領域(如控制理論�����、計算機科學、材料科學����、醫(yī)學)的融合使得新一代自主材料的開發(fā)成為可能。最近,微/納米機器人的發(fā)展已被用作治療感染的手段��。在醫(yī)學和牙科中使用微型/納米機器人為疾病治療提供了一種新的未來替代方案����。
微型/納米機器人是微型和納米級的機器,可以通過自主或外部動力推進來執(zhí)行多種特定任務����,如傳感、診斷��、輸送和解毒��。微型/納米機器人已成功用于藥物靶向遞送����、診斷��、成像和癌癥檢測��。微型/納米機器人的設計重點是模仿細菌或細胞等生物的行為����。與其他智能系統(tǒng)相比�����,微/納米機器人具有多種優(yōu)勢����,例如實時傳遞信息以進行正確診斷和治療的可能性�����、功能元件(即抗菌劑、生長因子)的封裝����、非侵入性干預和減少副作用。作為抗菌治療�����,微/納米機器人可以在特定位置輸送抗菌劑��,提供靶向治療����,并增強抗菌劑對靶向部位或生物膜的滲透��,因此有望成為傳統(tǒng)抗菌治療的一種有吸引力的替代品��。然而��,微型/納米機器人在牙科領域的應用僅限于一些概念驗證��。
已經(jīng)開發(fā)出了自驅(qū)動和外部供電的微型/納米機器人來根除牙齒生物膜�����。自驅(qū)動微型/納米機器人通過將H2O2分解為O2和HO2來使用化學燃料,這是納米機器人氣泡推進的來源����。其他微/納米機器人由外部物理力提供動力,如磁場和電場或超聲波����。
在最近的一項后續(xù)研究中,該團隊創(chuàng)建了一個名為STARS的磁場導向納米機器人�����,用于去除和殺死細菌生物膜�����,并對致病生物膜進行診斷采樣[335]�����。STARS是用Fe3O4納米粒子(IONP)制造的����,這些納米粒子在磁場下動態(tài)組裝形成磁刷毛。在磁場的引導下,刷毛可以改變其形狀�����、長度和硬度����,以去除生物膜,而IONP的催化反應產(chǎn)生ROS作為抗菌機制��。最后�����,改變刷毛的長度可以去除生物膜進行外部診斷��。利用變形鏈球菌和白色念珠菌生物膜生長在與釉質(zhì)具有類似形態(tài)性能的材料上�����,驗證了這一概念����。采集生物膜樣本后,在刷毛內(nèi)發(fā)現(xiàn)了細菌��、真菌和EPS的痕跡��。
催化NP對pH和溫度等環(huán)境變化的敏感性使該技術難以轉(zhuǎn)化為臨床應用。需要進行更多的研究來開發(fā)涂層��,以提高NP的穩(wěn)定性�����,在生物介質(zhì)中提供長的循環(huán)時間,并控制納米/微珠的運動����。
4.展望未來工作
過去20年見證了抗菌牙科材料的變革性發(fā)展。該領域正在從提供“被動”治療轉(zhuǎn)向由不同的內(nèi)部和外部刺激觸發(fā)的“智能”抗菌生物材料,以提供“按需”治療,改善對劑量�����、位置����、持續(xù)時間和療效的控制�����。大多數(shù)當代抗微生物生物材料系統(tǒng)都是在生物反應或刺激反應方法中發(fā)現(xiàn)的�����,使用一種刺激來觸發(fā)效果�����。即將出現(xiàn)的技術旨在通過提供多種抗菌/抗菌膜效果來提高抗菌效果和持續(xù)時間�����。此外����,這些生物反應性抗菌系統(tǒng)的新方法正在被設計用于執(zhí)行額外的生物功能��,包括組織再生、再礦化和抗炎����。
這些多功能生物材料可以結合多種能力,并對口腔中的多種刺激做出反應����,從而產(chǎn)生協(xié)同效應����。例如�����,在牙科領域�����,具有抗菌和再礦化能力的牙科樹脂粘合劑可用于殺死病原體并在結合界面再生組織��。該系統(tǒng)可以降低繼發(fā)性齲齒的發(fā)生率��,并延長修復體的耐久性����。大多數(shù)多功能牙科材料是通過混合多種試劑制成的�����,每種試劑都有一種特定的功能�����。這種設計方法可能會增加配方的復雜性,并且難以調(diào)節(jié)應用的物理性能�����。多功能生物材料的其他挑戰(zhàn)是在適當?shù)臅r間安排特定治療的遞送(例如,首先是抗菌����,然后是再生),并防止ROS的過度產(chǎn)生�����,ROS會導致組織損傷��、引發(fā)炎癥反應和細胞損傷��。體外測試多種功能具有挑戰(zhàn)性,因為傳統(tǒng)上�����,每種效果都是單獨測試的�����,這可能會阻礙體內(nèi)的潛在效果�����。
微生物和生物材料之間的相互作用具有顯著的復雜性�����。了解微生物與生物材料表面相互作用的機制對于控制粘附和生物膜的形成至關重要�����,尤其是對于智能抗菌生物材料系統(tǒng)��,其中需要額外的相互作用來防止感染��。有許多廣泛接受的標準化方法來評估牙科材料的財產(chǎn)(物理�����、機械�����、生物相容性)�����。然而,對生物膜-牙齒材料的相互作用進行評估尚未達成共識�����。事實上��,國際標準化組織(ISO)目前正在制定一項標準(ISO 3990)����,用于測試牙科修復材料的抗菌性能。本標準規(guī)定了樣品制備����、菌株選擇、體外試驗方法和評估以及報告結果的基本要求�����。這些標準化的方法將使我們能夠有效地比較研究之間的結果�����,防止可疑的結論�����,并為抗菌技術的臨床療效提供可靠的預測因素�����。此外,由于人類病理學的可接受表現(xiàn)(即相似的解剖結構�����、愈合過程和免疫反應)、建立為動物提供相同遺傳背景的譜系的可能性以及對復雜相互作用(即遺傳/環(huán)境因素)的研究��,已經(jīng)使用了模擬口腔生物膜形成和發(fā)育的體內(nèi)模型��。然而��,專門研究生物材料和生物膜之間相互作用的體內(nèi)模型有限��,這阻礙了研究結果的比較�����。指導這一領域的工作可以促進技術向臨床的轉(zhuǎn)化,減少用于體內(nèi)評估的動物數(shù)量��,最大限度地降低體內(nèi)臨床前研究的成本��,并促進器官芯片技術的發(fā)展。
5. 結論
綜上所述����,這篇文章介紹了用于抗菌應用的不同生物活性、生物響應(或刺激響應)和自主牙科材料的最新進展����。第一節(jié)描述了牙科材料中不同水平的智能�����,以澄清對這些生物材料用于提供效果的策略的潛在誤解�����。第二節(jié)簡要介紹了不同的生物活性抗菌技術����,提供了各種實例和抗菌機制��。第三節(jié)描述了這些智能牙科材料用于提供抗菌效果的不同外部和內(nèi)部刺激����。文章描述了對pH水平�����、酶����、磁�����、電和振動做出反應以產(chǎn)生抗菌效果的系統(tǒng)。還介紹了自主微型機器人�����,展示了這種破壞性的方法如何提供抗菌治療。在展望部分描述了多功能牙科材料和治療劑如何為新的研究和概念開辟道路����。
原文信息:Carolina Montoya, Lina Roldan, Michelle Yu, Sara Valliani, Christina Ta, Maobin Yang, Santiago Orrego.
Smart dental materials for antimicrobial applications.
Bioactive Materials, 24 (2023) 1-19.