摘 要 / Abstract
單組目標(biāo)值法是臨床研究設(shè)計的重要類型之一�����,特別是在醫(yī)療器械的臨床試驗領(lǐng)域���。我國和美國等國家和地區(qū)的醫(yī)療器械監(jiān)管機(jī)構(gòu)制定的指南等相關(guān)文件都對單組目標(biāo)值法進(jìn)行了論述�����,但尚未明確提出目標(biāo)值具體該如何設(shè)定�����。本文分析了近年來采用單組目標(biāo)值法設(shè)計的48 篇醫(yī)療器械臨床試驗文獻(xiàn)���,結(jié)果顯示當(dāng)前目標(biāo)值的設(shè)定主要以“參考值+界值”的方法為主,目標(biāo)值相對參考值的比值范圍較大��,從1.10~11.00�����,中位數(shù)為1.50(IQR 1.38~2.06),且隨著參考值的增加而減少�����。因此���,筆者建議在醫(yī)療器械的臨床研究設(shè)計中當(dāng)參考值<1%���,1%~<5%,5%~<10%���,≥10%時,目標(biāo)值分別不宜超過參考值的3倍��、2倍���、1.75倍���、1.5倍,如超過該范圍應(yīng)當(dāng)有充分的理由�����。
Performance Goals (PGs) in single-arm studies are important in clinical study design, especially in medical device clinical trials. Medical device administrations in countries like China and the US have issued documents introducing PGs; however, specific ways to set a PG are unidentified. In this article, we reviewed 48 medical device clinical trials using PGs in single-arm studies in recent years, and found that the majority adopted the method of using a reference value and a critical value to determine a PG, with a varied ratio of the PG to the reference value, ranging from 1.10 to 11.00 (median 1.50, IQR 1.38~2.06), and the ratio decreasing as the reference value increased. Thus, we suggest that when the reference value is <1%, 1%~<5%, 5%~<10%, ≥ 10%, the PG should not exceed 3, 2, 1.75 or 1.5 times the reference in medical device clinical study designs; otherwise, justification should be stated.
單組目標(biāo)值法是臨床研究設(shè)計的重要類型之一,特別是在醫(yī)療器械的臨床試驗領(lǐng)域���。我國和美國等國家和地區(qū)的醫(yī)療器械監(jiān)管機(jī)構(gòu)制定的指南等相關(guān)文件都對單組目標(biāo)值法進(jìn)行了論述�����,但均為原則性闡述���,未明確提出目標(biāo)值該如何設(shè)定,因此在實際應(yīng)用中單組目標(biāo)值的設(shè)定具有不確定性���,給監(jiān)管部門��、申辦方及研究者都帶來了困難和挑戰(zhàn)��。單組目標(biāo)值的設(shè)定直接關(guān)系著研究的樣本量�����,能否充分評價產(chǎn)品的安全性和有效性�����,更關(guān)系到患者的利益���,其重要性不言而喻��。本文對近年來采用單組目標(biāo)值法設(shè)計的醫(yī)療器械臨床試驗進(jìn)行了研究�����,分析其目標(biāo)值設(shè)定的具體方法���,并對其合理性進(jìn)行初步討論,以期為醫(yī)療器械臨床研究設(shè)計中單組目標(biāo)值的設(shè)定提供參考與思路�����。
1���、方 法
本文以PubMed數(shù)據(jù)庫為數(shù)據(jù)源,檢索式為:("performance goal "OR" objective performance criteria") ANDclinicaltrials.gov��,檢索時間:2000年1月1日~2022年4月16日��,共獲得相關(guān)文獻(xiàn)54篇�����,其中包括藥物研究文獻(xiàn)2篇、研究設(shè)計介紹文獻(xiàn)3篇�����、相同研究不同隨訪時間結(jié)果的文獻(xiàn)2篇���。刪除藥物研究及重復(fù)文獻(xiàn)最終得到48篇文獻(xiàn)��,其中包括了3篇研究設(shè)計介紹文獻(xiàn)�����。
2���、結(jié) 果
48篇醫(yī)療器械臨床研究相關(guān)文獻(xiàn)中,最早的文獻(xiàn)發(fā)表于2010年�����,且發(fā)文量有逐年增加的趨勢�����,其中涉及外周血管介入治療15篇、經(jīng)皮冠狀動脈介入治療14篇及心臟瓣膜介入治療7篇�����,位列前三�����。此外�����,心臟植入性電子裝置(cardiac implantable electronic device, CIED)3篇�����、心室輔助裝置3篇�����、左心耳封堵術(shù)2篇��,均為近年來醫(yī)療器械研究的熱門領(lǐng)域���。另有14篇(29.2%)文獻(xiàn)中提到了美國食品藥品監(jiān)督管理局(Food and Drug Administration, FDA)監(jiān)管相關(guān)內(nèi)容�����,見表1���。
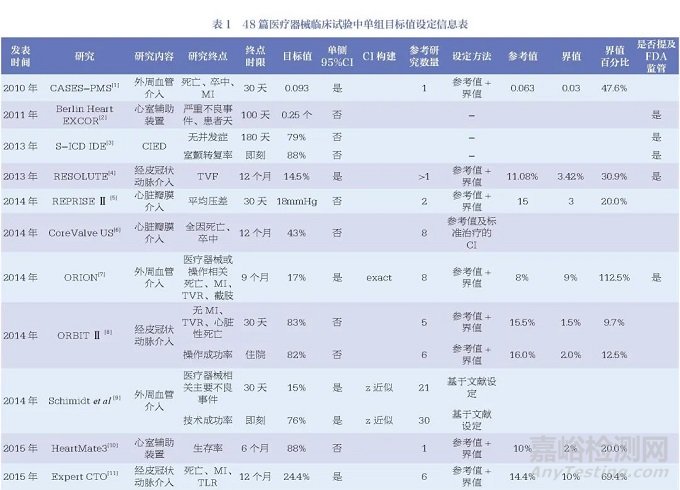
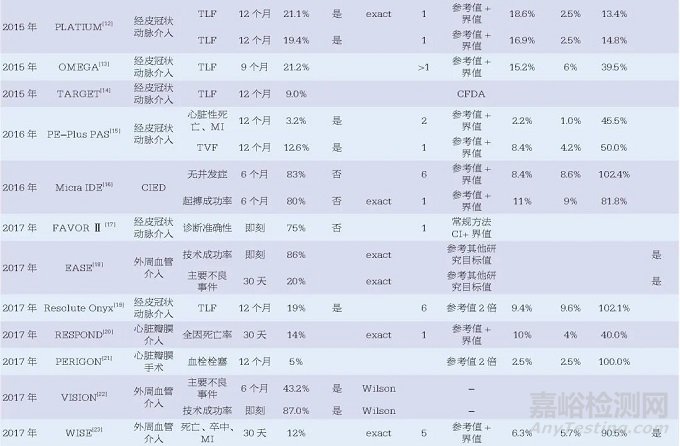
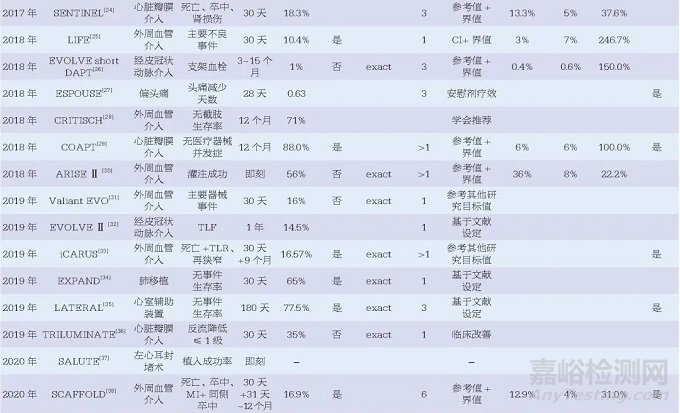
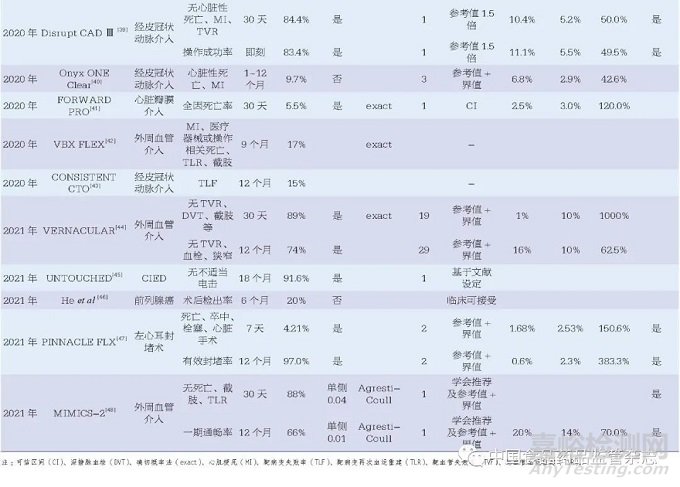
48篇文獻(xiàn)中46篇研究終點為定性數(shù)據(jù)、2篇為定量數(shù)據(jù)�����,另有12項研究中設(shè)置了安全性和有效性2個研究終點�����。因此�����,48篇文獻(xiàn)中共計60個研究終點���,其中58個為定性數(shù)據(jù),2個為定量數(shù)據(jù)���。
本文中目標(biāo)值指醫(yī)療器械應(yīng)達(dá)到的最低標(biāo)準(zhǔn)��,參考值一般為醫(yī)療器械既往研究的結(jié)果��。48篇文獻(xiàn)中��,目標(biāo)值的設(shè)定方法主要為參考值+界值���,共21篇��;其他還包括參考值的倍數(shù)��、安慰劑療效��、參考值可信區(qū)間上下限�����、參考值可信區(qū)間上下限+界值�����、臨床可接受��、學(xué)會推薦���、參考其他研究的目標(biāo)值等。另有5篇文獻(xiàn)的設(shè)定方法描述為“基于文獻(xiàn)”�����,6篇文獻(xiàn)未給出詳細(xì)的設(shè)定說明�����。
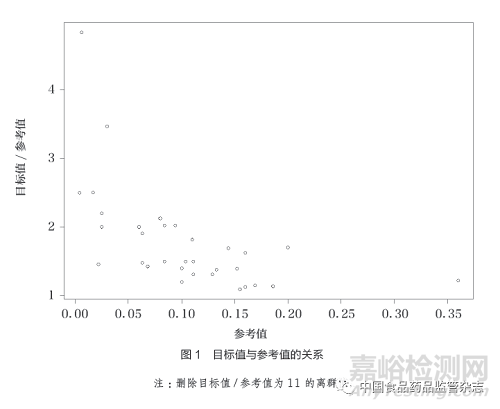
對于目標(biāo)值的具體計算��,為便于比較和分析��,本文將其統(tǒng)一為“參考值+界值”的方法�����,文獻(xiàn)中應(yīng)用可信區(qū)間的方法也統(tǒng)一轉(zhuǎn)換為參考值+界值的方法。對于目標(biāo)值高于50%的��,統(tǒng)一轉(zhuǎn)換為“1-目標(biāo)值”�����,同時計算界值占參考值的百分比以及目標(biāo)值相對于參考值的比值。結(jié)果顯示有26篇文獻(xiàn)的34個研究終點同時給出了目標(biāo)值���、參考值及界值的數(shù)據(jù)���,其中33個為定性數(shù)據(jù)終點,1個為定量數(shù)據(jù)終點��。定性數(shù)據(jù)的界值占比范圍較大�����,從9.7%~1000.0%�����,中位數(shù)為50.0%[四分位距(IQR)37.6%~102.1%]�����;相對應(yīng)的目標(biāo)值比值范圍也較大���,從1.10~11.00���,中位數(shù)為1.50(IQR1.38~2.02),僅有的一個定量數(shù)據(jù)的界值占比為20%��,相對應(yīng)的目標(biāo)值比值為1.2���,如圖1所示�����。此外,將研究的實際結(jié)果與目標(biāo)值比較時�����,有20篇文獻(xiàn)明確表示了使用單側(cè)95%的可信區(qū)間�����,其中有15篇文獻(xiàn)明確表示了使用確切概率法構(gòu)建可信區(qū)間��。
3�����、討 論
通過分析可以看出���,當(dāng)前醫(yī)療器械臨床試驗中單組目標(biāo)值法的目標(biāo)值設(shè)定主要以參考值+界值的方法為主�����,界值與參考值比值的中位數(shù)約為50%���,即目標(biāo)值為參考值的1.5倍��,且其范圍較大���。相關(guān)文獻(xiàn)對于單組目標(biāo)值的描述不夠統(tǒng)一,也不夠詳細(xì)��,本文列舉的48篇文獻(xiàn)中至少有11篇未給出目標(biāo)值設(shè)定的具體的設(shè)定方法�����,僅有26篇具體列出了較為完整的參數(shù)�����?��?紤]到相關(guān)文獻(xiàn)已經(jīng)是質(zhì)量較高的論文��,推測實際中目標(biāo)值設(shè)定的表述可能會更加不盡人意�����。
2013年FDA發(fā)布的《醫(yī)療器械關(guān)鍵性臨床研究的設(shè)計考慮指導(dǎo)原則》(Design Considerations for Pivotal Clinical Investigations for Medical Devices)將單組目標(biāo)值法分為客觀性能標(biāo)準(zhǔn)(objective performance criteria���,OPC)和性能目標(biāo)(performance goal,PG)���,并指出OPC通常來自監(jiān)管機(jī)構(gòu)、專業(yè)學(xué)會或標(biāo)準(zhǔn)組織等�����,其證據(jù)等級高于PG�����。但該分類在臨床試驗實踐中尚無嚴(yán)格的要求���,導(dǎo)致相關(guān)文獻(xiàn)中對兩種提法的使用較為隨意���,從統(tǒng)計學(xué)角度來看這兩種提法無實質(zhì)性的差異�����。但《醫(yī)療器械關(guān)鍵性臨床研究的設(shè)計考慮指導(dǎo)原則》沒有明確目標(biāo)值設(shè)定的具體方法���,僅建議PG可以是有效性或安全性終點的可信區(qū)間上限或下限。2010年FDA發(fā)布的《心臟瓣膜-研究器械豁免和上市前申請草案》[Heart Valves-Investigational Device Exemption (IDE) and Premarket Approval (PMA)Applications DRAFT GUIDANCE]部分支持了《ISO 5840:2005心血管植入物-人工心臟瓣膜》(Cardiovascular implants -Cardiac valve prostheses)的相關(guān)規(guī)定��,包括醫(yī)療器械相關(guān)的并發(fā)癥應(yīng)小于2倍的OPC��,即可以理解為目標(biāo)值不應(yīng)超過參考值的2倍(該文件中OPC相當(dāng)于參考值�����,不是本文所述的目標(biāo)值)���。但是這兩個文件都已經(jīng)廢止了���。
我國《醫(yī)療器械臨床試驗設(shè)計指導(dǎo)原則》參考了FDA相關(guān)指導(dǎo)原則中OPC和PG的概念,但也尚未明確目標(biāo)值設(shè)定的具體方法��,僅規(guī)定:目標(biāo)值是專業(yè)領(lǐng)域內(nèi)公認(rèn)的某類醫(yī)療器械的有效性/安全性評價指標(biāo)所應(yīng)達(dá)到的最低標(biāo)準(zhǔn)�����,目標(biāo)值的構(gòu)建通常需要全面收集具有一定質(zhì)量水平及相當(dāng)數(shù)量病例的臨床研究數(shù)據(jù),并進(jìn)行科學(xué)分析(如Meta分析)���。2017年�����,中國臨床試驗生物統(tǒng)計學(xué)組發(fā)表的《單組目標(biāo)值臨床試驗的統(tǒng)計學(xué)考慮》指出�����,目標(biāo)值的確定主要有3種方式:①臨床試驗監(jiān)管部門指南;②行業(yè)標(biāo)準(zhǔn)或?qū)<夜沧R;③同類產(chǎn)品歷史研究結(jié)果�����,但這個文件并沒有明確目標(biāo)值建立的具體方法。從本文納入的文獻(xiàn)來看��,在臨床試驗的實踐中���,目標(biāo)值設(shè)計最常用的方法是參考值+界值�����,少數(shù)采用參考值的倍數(shù)�����。本文列舉的文獻(xiàn)中參考值一般是指既往研究中類似醫(yī)療器械或治療方法的安全性/有效性終點的點估計值�����,而不是安慰劑療效的點估計值���。
盡管FDA的指導(dǎo)原則提出了利用(既往研究)可信區(qū)間上下限設(shè)定目標(biāo)值的方法�����,也有部分文獻(xiàn)中引用了此方法�����。但筆者認(rèn)為該方法準(zhǔn)確性有待商榷���,由于可信區(qū)間與樣本量相關(guān),如果既往研究的樣本量較小���,可信區(qū)間較寬�����,則目標(biāo)值顯然會過于寬松�����;相反���,如果既往研究的樣本量較大��,可信區(qū)間較窄��,則目標(biāo)值可能會過嚴(yán)而難以達(dá)成��。此外��,還有部分文獻(xiàn)中采用了可信區(qū)間上下限+界值的方法���,筆者認(rèn)為更不值得推薦。因此��,根據(jù)監(jiān)管機(jī)構(gòu)的指導(dǎo)原則以及臨床試驗的現(xiàn)狀�����,建議研究人員可使用參考值+界值的方法設(shè)定目標(biāo)值�����。該方法具備一個較為明確的參考值��,且界值的選取可體現(xiàn)臨床的觀點���,也便于不同研究之間的比較��。參考值可通過既往研究獲得(必要時進(jìn)行Meta分析)���,而界值的設(shè)置成為關(guān)鍵。界值太小則研究難以達(dá)成�����,界值太大則直接放寬了醫(yī)療器械相關(guān)性能的要求���,可能會損害患者的利益�����。一般界值相對于參考值的百分比��,及目標(biāo)值與參考值的比值���,是比界值的絕對數(shù)值更為合理的指標(biāo)��。從本文列舉的文獻(xiàn)數(shù)據(jù)可以看出��,目標(biāo)值與參考值的比值與參考值的大小有關(guān)��,這個比值隨著參考值的增加而迅速減少��。當(dāng)參考值<1%��,1%~<5%�����,5%~<10%��,≥10%時�����,目標(biāo)值不宜超過參考值的3倍��,2倍,1.75倍,1.5倍��。另外���,將文獻(xiàn)中的實際結(jié)果與目標(biāo)值比較時��,可信區(qū)間的構(gòu)建方法及單側(cè)或雙側(cè)的選用也應(yīng)該慎重考慮�����。筆者認(rèn)為相關(guān)問題已經(jīng)不僅是單純的統(tǒng)計學(xué)問題��,一般情況下設(shè)定的界值越大��,越需要強(qiáng)有力的臨床意義來支撐��,例如在顯著減少嚴(yán)重并發(fā)癥時才有理由對有效性終點范圍的設(shè)定進(jìn)行擴(kuò)大�����。
實際中��,采用監(jiān)管機(jī)構(gòu)或?qū)W會推薦的方法設(shè)置目標(biāo)值的例子較少��,主要是由于監(jiān)管機(jī)構(gòu)或?qū)W會推薦的目標(biāo)值相對較少且相對固定��,但是目標(biāo)值的設(shè)置應(yīng)隨著醫(yī)療器械的發(fā)展而變化�����,每一個新的研究都需要重新考察目標(biāo)值的設(shè)定��。盡管如此���,在設(shè)置相關(guān)參數(shù)時還應(yīng)充分考量醫(yī)療器械注冊審評中臨床試驗的具體要求�����,特別是近年來我國醫(yī)療器械監(jiān)管政策創(chuàng)新發(fā)展較快���,部分醫(yī)療器械產(chǎn)品的注冊指導(dǎo)原則也開始推薦目標(biāo)值的設(shè)置范圍,建議應(yīng)當(dāng)優(yōu)先參考��。
由于本文的相關(guān)分析尚存在一定的局限性��。首先在文獻(xiàn)檢索環(huán)節(jié)設(shè)置了在clinicaltrials.gov網(wǎng)站注冊的要求���,即未進(jìn)行注冊的文獻(xiàn)將被剔除�����;其次��,目標(biāo)值的設(shè)定應(yīng)緊密結(jié)合研究終點的臨床意義(該點本文未進(jìn)行展開分析)��。由于單組目標(biāo)值法無法進(jìn)行平行對照�����,因此目標(biāo)值通常應(yīng)選擇客觀的終點指標(biāo)�����,本文列舉的48篇文獻(xiàn)基本滿足終點指標(biāo)���,研究終點包括死亡、心肌梗死�����、血運重建等主要不良事件�����,都具有重大臨床意義�����。本文分析基于低優(yōu)指標(biāo)如死亡等,高優(yōu)指標(biāo)原理相同���。綜上所述��,目標(biāo)值的設(shè)定在單組目標(biāo)值法研究設(shè)計中至關(guān)重要�����,研究人員應(yīng)仔細(xì)權(quán)衡��,特別需要考慮其臨床意義��。因此���,建議當(dāng)參考值為<1%,1%~<5%��,5%~<10%��,≥10%時���,目標(biāo)值不宜超過參考值的3倍��、2倍��、1.75倍�����、1.5倍�����,如超過該范圍應(yīng)當(dāng)具備充分的理由��。





