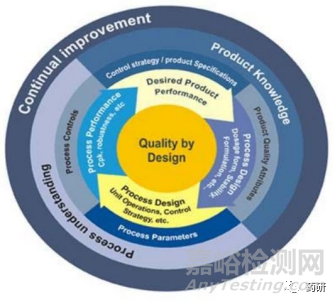
FDA于2004年開(kāi)始在制藥行業(yè)倡導(dǎo)質(zhì)量源于設(shè)計(jì)(QbD)理念��,QbD以預(yù)先設(shè)定的藥品質(zhì)量為目標(biāo),通過(guò)充分的科學(xué)證據(jù)及質(zhì)量風(fēng)險(xiǎn)管理���,并強(qiáng)調(diào)對(duì)產(chǎn)品��、過(guò)程的理解以及過(guò)程控制��,將質(zhì)量融入到產(chǎn)品的設(shè)計(jì)�����、生產(chǎn)�����、質(zhì)量提升乃至全生命周期的各個(gè)環(huán)節(jié)之中�����,從而有效保障藥品質(zhì)量��,提高生產(chǎn)效率[1]�����。
圖1 QbD總覽圖[1]
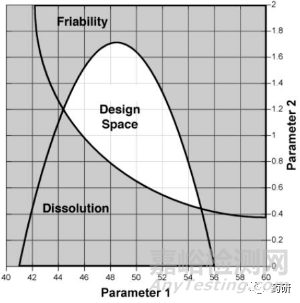
QbD的實(shí)施涉及到目標(biāo)產(chǎn)品概況(TPP)�����、產(chǎn)品關(guān)鍵質(zhì)量屬性(CQAs)�����、關(guān)鍵物料屬性(CMA)和關(guān)鍵工藝參數(shù)(CPP)的分析與確定���、設(shè)計(jì)空間(DSp)的確定��、控制策略的形成等環(huán)節(jié)�����,而DSp是保證QbD理念實(shí)施的一種高效而重要的工具�����。ICH Q8指導(dǎo)原則將設(shè)計(jì)空間(DSp)定義為“經(jīng)過(guò)科學(xué)論證的物料屬性與工藝參數(shù)的多維度組合���、相互作用范圍,在此范圍內(nèi)藥品的質(zhì)量能夠得到保證”[2]���。藥品開(kāi)發(fā)過(guò)程中��,DSp受到藥品監(jiān)管的審核��、批準(zhǔn)與監(jiān)管��,在DSp范圍內(nèi)運(yùn)行��,不認(rèn)為是對(duì)關(guān)鍵工藝參數(shù)或物料屬性的變更�����,因此���,建立藥品生產(chǎn)工藝DSp��,能夠在保證產(chǎn)品質(zhì)量的基礎(chǔ)上���,賦予藥企最佳的操作靈活性,有利于提高生產(chǎn)效率��。
圖2 參數(shù)重疊形成的設(shè)計(jì)空間示意圖[2]
FDA CDER 的Erik Read等人[3]指出���,DSp近年來(lái)已經(jīng)在小分子藥物���、生物大分子藥物生產(chǎn)領(lǐng)域得到逐步應(yīng)用,其建立涉及風(fēng)險(xiǎn)分析��、實(shí)驗(yàn)設(shè)計(jì)(DOE)��、數(shù)據(jù)分析�����、模型建立���、設(shè)定值分析��、優(yōu)化等核心環(huán)節(jié)���,每一環(huán)節(jié)的向下進(jìn)行都要基于合理科學(xué)的數(shù)據(jù)解讀與理解��,逐步推進(jìn)DSp的建立與完善���。然而在制藥行業(yè)缺乏統(tǒng)一的策略與標(biāo)準(zhǔn)�����,加之DOE執(zhí)行過(guò)程中存在多種變異因素�����,例如實(shí)驗(yàn)測(cè)量誤差���、參數(shù)設(shè)定范圍等���,因此導(dǎo)致DSp的建立過(guò)程變得復(fù)雜而受阻。
Erik Read等人[3]在馬里蘭州隸屬于FDA OBP的 White Oak Facility開(kāi)展了實(shí)驗(yàn)���,通過(guò)單克隆抗體mAb生產(chǎn)工藝DSp建立過(guò)程中實(shí)際遇到的4種典型實(shí)例情形���,闡述如何提高DOE數(shù)據(jù)解析的準(zhǔn)確性與邏輯性�����,科學(xué)引導(dǎo)DSp的建立�����。mAb生產(chǎn)工藝DSp建立之前�����,首先確定mAb的CQAs��,并預(yù)先制定標(biāo)準(zhǔn)限度���,接下來(lái)通過(guò)基于經(jīng)驗(yàn)、文獻(xiàn)資料的風(fēng)險(xiǎn)分析�����,確定有可能對(duì)CQAs存在潛在影響的工藝參數(shù)(PP)���,執(zhí)行實(shí)驗(yàn)設(shè)計(jì)(DOE)并進(jìn)行數(shù)據(jù)分析��,根據(jù)PP對(duì)不同CQAs的影響數(shù)據(jù)建立擬合模型���,并通過(guò)擬合模型指標(biāo)���,例如R2、Q2等模型評(píng)價(jià)指標(biāo)判斷模型的顯著性與有效性��。根據(jù)CQAs是否符合標(biāo)準(zhǔn)限度以及模型的顯著性進(jìn)行情形分類(lèi)���,分為以下4類(lèi):
1.CQAs符合標(biāo)準(zhǔn)限度/模型顯著
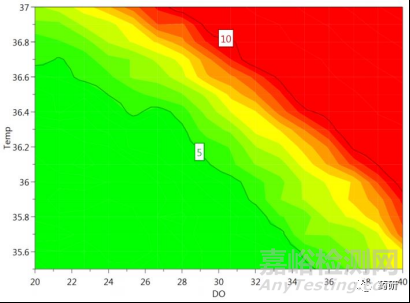
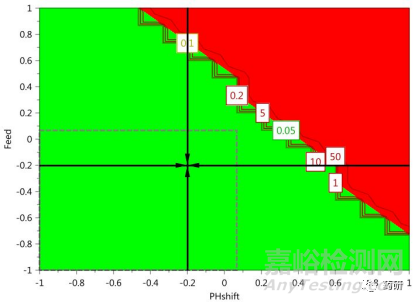
這是DSp建立過(guò)程中最理想的情形。這種情形下���,在所研究的參數(shù)范圍內(nèi)�����,所生產(chǎn)mAb的特定CQAs均能符合標(biāo)準(zhǔn)限度�����,而且擬合模型能夠反映關(guān)鍵工藝參數(shù)與產(chǎn)品關(guān)鍵質(zhì)量屬性之間的聯(lián)系�����,具有較強(qiáng)的預(yù)測(cè)性���。這種情況下��,甚至不用經(jīng)過(guò)進(jìn)一步的設(shè)定值分析與優(yōu)化��,便可以很容易在此基礎(chǔ)上建立DSp���。但是需要進(jìn)一步分析所建立DSp的失敗概率,例如�����,這種情形下�����,實(shí)際建立DSp的失敗概率高達(dá)50%��,原則上���,需要最大可能降低DSp的失敗概率��,確保有效性與可靠性���,因此��,在此基礎(chǔ)上進(jìn)一步進(jìn)行了響應(yīng)曲面(RSM)優(yōu)化�����,最終建立的DSp的失敗概率降低至10%�����。由此可見(jiàn)��,即使在此理想情形下�����,也存在進(jìn)一步優(yōu)化DSp的必要性。
圖3 對(duì)CPP進(jìn)一步優(yōu)化后DSp的失敗概率顯著降低[3]
2.CQAs符合標(biāo)準(zhǔn)限度/模型不顯著
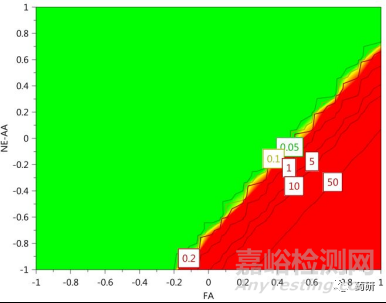
這種情形下�����,在所研究的參數(shù)范圍內(nèi)��,所生產(chǎn)mAb的特定CQAs均能符合標(biāo)準(zhǔn)限度���,但擬合模型不能夠反映關(guān)鍵工藝參數(shù)與產(chǎn)品關(guān)鍵質(zhì)量屬性之間的聯(lián)系���,預(yù)測(cè)性較差��。產(chǎn)生原因往往是由于DOE數(shù)據(jù)不可靠�����,例如實(shí)驗(yàn)變異因素的干擾�����。這一點(diǎn)可通過(guò)DOE進(jìn)行過(guò)程中并列設(shè)計(jì)的對(duì)照實(shí)驗(yàn)結(jié)果進(jìn)行判定��,平行實(shí)驗(yàn)結(jié)果較差的批間一致性���,表明了在DOE執(zhí)行過(guò)程中存在未知的變異因素。由于特定CQAs均能符合標(biāo)準(zhǔn)限度���,因此可在此基礎(chǔ)上進(jìn)一步進(jìn)行響應(yīng)曲面(RSM)優(yōu)化來(lái)完善DSp���,提高可靠性。事實(shí)表明�����,經(jīng)過(guò)進(jìn)一步優(yōu)化,DSp的失敗概率由100% 降至5%��。
圖4 對(duì)CPP進(jìn)一步優(yōu)化后DSp的失敗概率顯著降低[3]
3.CQAs不符合標(biāo)準(zhǔn)限度/模型顯著
這種情形下���,在所研究的參數(shù)范圍內(nèi)���,所生產(chǎn)mAb的特定CQAs不符合標(biāo)準(zhǔn)限度,但是擬合模型是顯著的���,能夠反映關(guān)鍵工藝參數(shù)與產(chǎn)品關(guān)鍵質(zhì)量屬性之間的聯(lián)系���,具有較強(qiáng)的預(yù)測(cè)性。顯然���,出現(xiàn)上述情形的原因是工藝參數(shù)范圍選取不當(dāng),導(dǎo)致mAb的特定CQAs超出了限度���。但是擬合模型是有效的��,能夠?qū)に噮?shù)對(duì)應(yīng)的CQAs進(jìn)行有效預(yù)測(cè)�����,因此�����,這種情形下需要對(duì)工藝參數(shù)的設(shè)定值范圍進(jìn)行適度調(diào)整���,進(jìn)而建立DSp��。經(jīng)過(guò)設(shè)定值驗(yàn)證重新建立的DSp的失敗概率由100% 降至5%��。
圖5 經(jīng)設(shè)定值驗(yàn)證優(yōu)化后DSp的失敗概率顯著降低[3]
4.CQAs不符合標(biāo)準(zhǔn)限度/模型不顯著
這種屬于DSp建立過(guò)程中最不理想的一種情形��。mAb的特定CQAs不符合標(biāo)準(zhǔn)限度���,并且擬合模型不顯著,主要原因是風(fēng)險(xiǎn)分析不到位���,導(dǎo)致潛在關(guān)鍵工藝參數(shù)選取不當(dāng)�����,以至于不能得到顯著的擬合模型�����。其他原因還包括實(shí)驗(yàn)中的其他變異因素���、實(shí)驗(yàn)誤差等�����。這種情形下�����,不建議在此基礎(chǔ)上建立DSp�����,而是需要重新謹(jǐn)慎選擇實(shí)驗(yàn)工藝參數(shù)進(jìn)行實(shí)驗(yàn)以建立DSp�����。
Erik Read等人[3]通過(guò)上述 4種DSp建立過(guò)程的實(shí)例情形�����,闡述了在DSp建立的過(guò)程中如何對(duì)實(shí)驗(yàn)設(shè)計(jì)(DOE)的數(shù)據(jù)進(jìn)行合理解析�����,例如CQAs是否符合預(yù)定的標(biāo)準(zhǔn)限度�����、擬合模型是否顯著��,并在此基礎(chǔ)上關(guān)注實(shí)驗(yàn)過(guò)程中的變異因素�����、潛在工藝參數(shù)的選擇是否合理���、工藝參數(shù)范圍是否得當(dāng),根據(jù)上述方面進(jìn)行決策���、下定結(jié)論��,并分析初步建立的DSp是否需要進(jìn)一步的優(yōu)化���,例如是否有必要進(jìn)一步優(yōu)化以繼續(xù)降低失敗概率,最終成功建立起能夠保證產(chǎn)品質(zhì)量的DSp。
通過(guò)這一舉措��,可以明晰DSp建立過(guò)程中的典型模式�����,并按照這4種模式�����,合理引導(dǎo)DOE數(shù)據(jù)的解析�����,理清DSp的建立策略��,降低過(guò)程的復(fù)雜性��,最終成功建立生產(chǎn)工藝設(shè)計(jì)空間(DSp)�����,促進(jìn)質(zhì)量源于設(shè)計(jì)(QbD)理念在制藥領(lǐng)域的實(shí)施���。