摘 要
合規(guī)審查是近幾年藥品審評審批制度改革產(chǎn)生的新事物,是藥品注冊期間基于風險的科學監(jiān)管手段之一����。本文介紹了從2018年到2022年期間對藥品注冊申請進行合規(guī)審查的進展情況,分為初始階段����、形成階段、發(fā)展階段三個階段����,并分別進行詳細的闡述,探討了合規(guī)審查體系構建中遇到的問題����,并對建設更加完善的合規(guī)審查體系提出前進的方向。
自2015年《國務院關于改革藥品醫(yī)療器械審評審批制度的意見》(國發(fā)[2015]44號)藥品審評審批制度改革正式啟動以來����,隨著新修訂《中華人民共和國藥品管理法》和《藥品注冊管理辦法》的發(fā)布實施�,藥品審評審批工作流程得到全面優(yōu)化����,質(zhì)量和效率得到顯著提升,我國已逐步建立起與國際接軌的科學權威公開的藥品注冊管理體系����,可促進制藥行業(yè)進入高質(zhì)量發(fā)展期。
根據(jù)新修訂《中華人民共和國藥品管理法》第二十五條規(guī)定����,對申請注冊的藥品,國務院藥品監(jiān)督管理部門應當組織藥學����、醫(yī)學和其他技術人員進行審評,對藥品的安全性、有效性和質(zhì)量可控性以及申請人的質(zhì)量管理����、風險防控和責任賠償?shù)饶芰M行審查;符合條件的����,頒發(fā)藥品注冊證書。與之前相比�,除了對藥品的安全性�、有效性和質(zhì)量可控性進行審評外�,還新增了對申請人的質(zhì)量管理����、風險防控和責任賠償能力進行審查的要求。新形勢下的藥品注冊管理體系以審評為主導����,檢驗、核查��、監(jiān)測與評價等為支撐�,藥品注冊申請在審評過程中基于風險啟動藥品注冊核查和注冊檢驗。合規(guī)審查就是基于新形勢下藥品注冊管理體系的需要產(chǎn)生的����,是與藥學專業(yè)、藥理毒理專業(yè)�、臨床專業(yè)、統(tǒng)計與臨床藥理專業(yè)并行的一個分支����,與技術審評同時開展。本文根據(jù)筆者工作實踐�,闡述了從對一致性評價申請進行合規(guī)審查的初步探索����,到合規(guī)審查體系的初步構建等相關工作進展情況��,并對進一步完善和規(guī)范合規(guī)審查體系進行探討��,以期更加科學地用于對藥品注冊申請啟動核查的風險評估�。
1、初始階段(2018年-2019年)
1.1 “合規(guī)”概念用于藥品注冊申請的雛形
2017年8月25日����,原國家食品藥品監(jiān)督管理總局發(fā)布《總局關于仿制藥質(zhì)量和療效一致性評價工作有關事項的公告》(2017年第100號,以下簡稱100號公告)��,其中第十一條明確提出:“國家食品藥品監(jiān)督管理總局藥品審評中心設立合規(guī)辦公室��,協(xié)調(diào)有因檢查��、抽檢以及審評等相關環(huán)節(jié)�,提高檢查、檢驗和審評工作的質(zhì)量和效率��,保證檢查員和審評員按同一標準對申請一致性評價藥物進行檢查和審評”��。
2017年年底,藥品審評中心內(nèi)設機構進行調(diào)整�,增設合規(guī)處,其部門職責:根據(jù)技術審評工作需要提出藥品注冊研制現(xiàn)場����、生產(chǎn)現(xiàn)場的檢查檢驗需求;協(xié)調(diào)相關單位啟動審評過程中的檢查�、檢驗工作,并參與檢查結(jié)果的綜合分析判定����;參與制定藥品注冊合規(guī)性審查指導原則等技術文件����;參與建立藥品注冊合規(guī)性審查管理體系。
1.2 對化學藥品仿制藥口服固體制劑一致性評價申請進行合規(guī)審查的初步探索
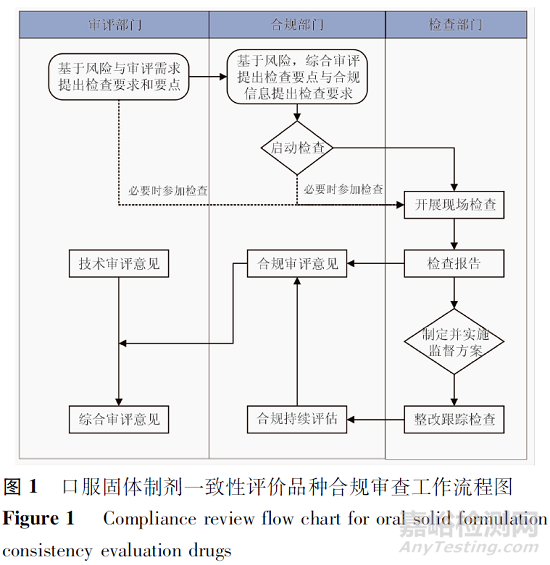
根據(jù)100號公告要求����,一致性評價申請按補充申請進行申報,受理后由藥品審評中心對申報資料進行立卷審查��,45日內(nèi)完成立卷����,并根據(jù)立卷審查情況提出有因檢查和抽檢的需求,由國家食品藥品監(jiān)督管理總局食品藥品審核查驗中心統(tǒng)一組織進行研制現(xiàn)場、生產(chǎn)現(xiàn)場或臨床試驗數(shù)據(jù)的有因檢查或抽樣����。簡言之,一致性評價申請的現(xiàn)場檢查并非以前的“逢審必查”,而是“有因”的檢查����。
根據(jù)原國家食品藥品監(jiān)督管理總局發(fā)布的《關于調(diào)整藥品注冊受理工作的公告》(2017年第134號)要求,自2017-12-01起由國家食品藥品監(jiān)督管理總局審評審批��、備案的注冊申請均由國家食品藥品監(jiān)督管理總局受理����,包括新藥臨床試驗申請、新藥生產(chǎn)(含新藥證書)申請����、仿制藥申請,國家食品藥品監(jiān)督管理總局審批的補充申請等����。集中受理實施后,國家食品藥品監(jiān)督管理總局新受理的藥品注冊申請����,根據(jù)藥品技術審評中的需求,由國家食品藥品監(jiān)督管理總局食品藥品審核查驗中心統(tǒng)一組織全國藥品注冊檢查資源實施現(xiàn)場核查,即集中受理后藥品注冊申請的現(xiàn)場核查調(diào)整為“根據(jù)技術審評的需求開展”����。
藥品審評中心結(jié)合品種科學性和風險管理原則,探索制定了一致性評價品種啟動現(xiàn)場檢查的2方面主要關注點:①藥學/臨床審評考慮的品種因素��,如復雜劑型(如脂質(zhì)體�、微球、緩控釋制劑產(chǎn)品等)����、特殊品種(如治療窗窄、高變異藥物或具有復雜藥代動力學特征等)��、采用非常規(guī)生產(chǎn)工藝的����、立卷審查發(fā)現(xiàn)問題需現(xiàn)場核實等��;②基于申報品種的研制機構和生產(chǎn)企業(yè)合規(guī)性風險的評估�,如:研制單位或生產(chǎn)單位近3年未接受過監(jiān)管機構檢查的,既往檢查發(fā)現(xiàn)真實性問題����、或檢查不通過的,相關資料顯示該單位質(zhì)量管理體系存在較大的影響產(chǎn)品質(zhì)量風險的情形,有證據(jù)齊全的投訴舉報需現(xiàn)場核實等����。
啟動檢查的一致性評價品種,申請人需對檢查發(fā)現(xiàn)問題及時進行整改��,并于檢查結(jié)束后30日內(nèi)將整改報告提交至藥品審評中心����,合規(guī)審查對檢查報告和整改報告情況進行評價,如發(fā)現(xiàn)重大不合規(guī)問題��,后續(xù)將提高相關研制單位/生產(chǎn)單位的合規(guī)風險�,增加現(xiàn)場檢查頻率。
2017年至2019年期間��,藥品審評中心受理仿制藥一致性評價申請1 716件����,其中307個品種啟動臨床試驗現(xiàn)場核查任務,376個品種啟動藥學研制/生產(chǎn)現(xiàn)場核查任務��。藥品審評中心在仿制藥一致性評價申請中探索開展合規(guī)審查工作��,嚴格執(zhí)行100號公告關于受理后45日內(nèi)完成立卷并提出檢查需求����,初步實現(xiàn)了審評與核查并聯(lián)開展����,初步建立了合規(guī)審查工作程序和機制��。
初步建立的合規(guī)審查工作流程如圖1所示��。
2�、形成階段(2020年-2021年)
2.1 法規(guī)依據(jù)和要求
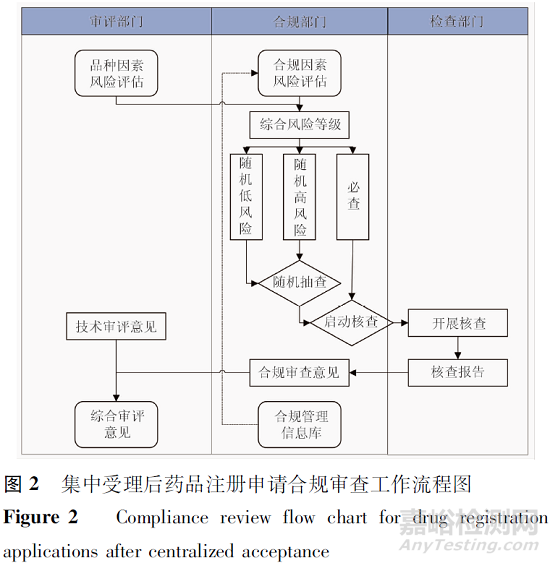
2020-3-30國家市場監(jiān)督管理總局令第27號公布,自2020-7-1起施行新修訂的《藥品注冊管理辦法》����,其中第四十六條規(guī)定:藥品審評中心根據(jù)藥物創(chuàng)新程度、藥物研究機構既往接受核查情況等����,基于風險決定是否開展藥品注冊研制現(xiàn)場核查�;第四十七條規(guī)定:藥品審評中心根據(jù)申報注冊的品種、工藝����、設施、既往接受核查情況等因素����,基于風險決定是否啟動藥品注冊生產(chǎn)現(xiàn)場核查��。這時“基于風險”啟動藥品注冊核查的模式正式確立��,經(jīng)過前期“基于技術審評需求”啟動現(xiàn)場核查的過渡期��,藥品審評中心在一致性評價品種啟動有因檢查工作經(jīng)驗的基礎上�,起草了《藥品審評中啟動核查檢驗工作的標準與程序(暫行)》��,該程序規(guī)定了基于品種風險因素和研發(fā)生產(chǎn)主體合規(guī)風險因素雙向并行式的風險管控模式�,通過對品種因素和合規(guī)因素進行風險評估和綜合判定,將藥品注冊申請分為必查和隨機核查(區(qū)分隨機高風險和隨機低風險)2種情形��。
2.2 藥品注冊申請受理后第一輪合規(guī)審查關注點
對于藥品上市許可申請和涉及重大變更的補充申請�,藥品審評中心技術審評部門對其品種因素進行風險評估,合規(guī)部門對其合規(guī)因素進行風險評估�,以就高不就低的原則確定最終風險等級。必查情形的品種直接啟動核查����,隨機核查情形的品種通過隨機抽選確定是否啟動核查。
品種因素必查情形包括境內(nèi)外均未上市的創(chuàng)新藥和改良型新藥�、生物制品、中藥注射劑����、接到核查通知后撤回注冊申請又重新申報的同品種等�;品種因素隨機高風險情形包括復雜劑型(如脂質(zhì)體����、微球、微乳����、長效或緩控釋產(chǎn)品、吸入制劑等)����、特殊品種(如合成肽、多組分生化藥品����、處方中含有大毒藥材的中藥民族藥)等。除品種因素必查情形和隨機高風險情形之外的��,屬于隨機低風險情形��。
合規(guī)因素必查情形有:近5年未接受過國內(nèi)外藥品監(jiān)管機構核查(檢查)的研制機構/生產(chǎn)單位(生產(chǎn)線)����;近5年國內(nèi)外藥品監(jiān)管機構核查(檢查)不通過的研制機構/生產(chǎn)單位(生產(chǎn)線);申請人接到核查通知后撤回注冊申請等�。合規(guī)因素隨機高風險情形有:近5年國內(nèi)外藥品監(jiān)管機構核查(檢查)發(fā)現(xiàn)重大不合規(guī)問題的研制機構/生產(chǎn)單位(生產(chǎn)線)、臨床試驗相關單位存在利益沖突的等����。除合規(guī)因素必查情形和隨機高風險情形之外的,屬于隨機低風險情形����。
2.3 已啟動核查的藥品注冊申請核查報告返回后的合規(guī)審查關注點
已啟動核查的藥品注冊申請,將結(jié)合核查報告發(fā)現(xiàn)問題相關情況進行第2輪合規(guī)審查�,評估該研發(fā)生產(chǎn)主體的合規(guī)風險級別是否需要調(diào)整。藥學核查方面主要關注藥學研究數(shù)據(jù)可靠性�、商業(yè)化規(guī)模生產(chǎn)能力、產(chǎn)品質(zhì)量可控性��、藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)法規(guī)依從性等��;臨床核查方面主要關注受試者安全和權益保護��、臨床試驗數(shù)據(jù)可靠性��、藥物臨床試驗質(zhì)量管理規(guī)范(GCP)法規(guī)依從性等,合規(guī)審查結(jié)果將納入合規(guī)管理信息庫�,用于該研發(fā)生產(chǎn)主體后續(xù)申報藥品注冊申請時再次進行合規(guī)因素風險評估。
集中受理后藥品注冊申請合規(guī)審查工作流程圖如圖2所示����。
2020年至2021年期間����,共有13 253件藥品注冊申請進行了合規(guī)審查��,經(jīng)過風險評估和隨機抽選后啟動臨床試驗現(xiàn)場核查822個品種��,啟動藥學研制/生產(chǎn)現(xiàn)場核查1 476個品種��。藥品審評中心積極落實基于風險啟動注冊核查的理念��,扎實推進審評與核查檢驗并聯(lián)工作��,自2020-07-11起受理的品種����,所有核查任務均嚴格執(zhí)行新《藥品注冊管理辦法》關于受理后40日內(nèi)啟動注冊核查的規(guī)定��。結(jié)合現(xiàn)階段工作實際����,大力推進合規(guī)審查制度文件的制修訂和合規(guī)管理信息庫的初步建設工作,通過梳理匯總近幾年已啟動核查的研發(fā)生產(chǎn)主體核查結(jié)果等相關信息,及時跟進更新國內(nèi)外監(jiān)管檢查機構最新合規(guī)信息����,為合規(guī)管理信息庫的建設奠定了堅實基礎�。
3、發(fā)展階段(2022年至今)
3.1合規(guī)審查制度文件體系的形成
根據(jù)新修訂《藥品注冊管理辦法》配套文件相關要求和合規(guī)部門職責內(nèi)容�,藥品審評中心逐步搭建起“一啟動程序二銜接程序三工作規(guī)范”的合規(guī)管理制度。結(jié)合近2年在《藥品審評中啟動核查檢驗工作的標準與程序(暫行)》實施過程中的問題��,進一步修訂完善形成了新版本的《藥品注冊核查檢驗啟動工作程序(試行)》�,已于2021-12-20正式對外發(fā)布,自2022-01-01起實施����。同時為更加細化《藥品注冊核查檢驗啟動工作程序(試行)》的落地實施,配套制定了《藥品技術審評與注冊核查工作銜接程序》 《藥品技術審評與注冊檢驗工作銜接程序》 《藥品審評過程中有因檢查啟動工作程序》 《藥品注冊核查任務啟動工作規(guī)范》 《藥品注冊檢驗工作規(guī)范》等相關工作程序和規(guī)范性文件����。
為加強合規(guī)風險識別分析與評價管理,進一步規(guī)范基于風險的合規(guī)審查工作����,合規(guī)部門還起草了研發(fā)生產(chǎn)主體合規(guī)因素風險情形細化標準、藥品注冊申請啟動核查風險綜合評估�、核查報告返回后合規(guī)審查標準等內(nèi)部工作文件,以使合規(guī)審查尺度和標準一致。
3.2 基于風險的合規(guī)審查主要原則和關注點
基于風險的合規(guī)審查主要有3個原則��。一是風險就高原則����。根據(jù)《藥品注冊核查檢驗啟動工作程序(試行)》相關規(guī)定,藥品注冊申請啟動核查的風險等級分為高風險����、中風險、低風險三個等級�。技術審評基于品種因素進行風險評估,合規(guī)審查基于研發(fā)生產(chǎn)主體合規(guī)因素進行風險評估����,原則上以品種因素和研發(fā)生產(chǎn)主體合規(guī)因素風險情形較高的確定最終風險等級。二是動態(tài)調(diào)整原則��。合規(guī)因素風險評估時�,將結(jié)合研發(fā)生產(chǎn)主體最近2次接受注冊核查的情況,以及不合規(guī)問題發(fā)生時間和整改情況等進行綜合研判��。例如�,對于因合規(guī)因素中風險情形納入啟動注冊核查中風險等級的,相應研發(fā)生產(chǎn)主體后續(xù)經(jīng)過連續(xù)2次注冊核查�,如核查結(jié)論均為通過并且未發(fā)現(xiàn)重大不合規(guī)問題的����,其合規(guī)因素風險降為低風險��;如后續(xù)注冊核查仍存在重大不合規(guī)問題的��,其合規(guī)風險升至高風險����。三是形成監(jiān)管閉環(huán)����。研發(fā)生產(chǎn)主體合規(guī)管理信息庫的建立是形成監(jiān)管閉環(huán)的有力保障,信息庫將整合近幾年來已啟動注冊核查的研發(fā)生產(chǎn)主體核查結(jié)論等相關信息��,并及時跟進和持續(xù)更新國內(nèi)外監(jiān)管信息��,以提高合規(guī)審查的準確性和合理性��?�;陲L險的合規(guī)審查關注點及對應風險情形見下�。
3.2.1 品種因素
高風險情形 上市許可申請:①化學藥品創(chuàng)新藥和改良型新藥��;②中藥創(chuàng)新藥����、改良型新藥����、古代經(jīng)典名方中藥復方制劑和中藥注射劑;③生物制品��;④采用創(chuàng)新生產(chǎn)工藝或常規(guī)生產(chǎn)工藝中引入新技術����,經(jīng)評估可能增加風險的品種。補充申請:①涉及生產(chǎn)工藝或生產(chǎn)場地重大變更的疫苗和血液制品以及細胞治療產(chǎn)品等��;②涉及生產(chǎn)工藝重大變更的中藥注射劑����;③變更生產(chǎn)工藝后采用創(chuàng)新生產(chǎn)工藝或常規(guī)生產(chǎn)工藝中引入新技術,經(jīng)評估可能增加風險的品種��。
中風險情形 上市許可申請:①脂質(zhì)體��、微球�、微乳、長效或緩控釋制劑�、吸入制劑等復雜劑型����;②特殊化學藥品(包括合成多肽����、小分子核酸、多糖��、生物來源化學藥品����、發(fā)酵工藝生產(chǎn)的化學藥品等)以及處方中含有大毒藥材的中藥民族藥等特殊品種����;③采用非常規(guī)生產(chǎn)工藝的品種。補充申請:①除疫苗��、血液制品以及細胞治療產(chǎn)品等外��,涉及生產(chǎn)工藝或生產(chǎn)場地重大變更的其他生物制品��;②除生產(chǎn)工藝重大變更外����,涉及其他重大變更的中藥注射劑;③經(jīng)評估����,變更后采用非常規(guī)生產(chǎn)工藝的品種。
低風險情形 除上述品種因素高��、中風險情形外����,其他情形為品種因素低風險情形。
3.2.2 合規(guī)因素
高風險情形 ①近3年在技術審評��、注冊核查����、監(jiān)督檢查等過程中發(fā)現(xiàn)真實性問題的;②近3年在注冊工作中發(fā)現(xiàn)存在《中華人民共和國藥品管理法》第一百四十一條相關情形的����;③僅用于中國注冊的生物等效性研究數(shù)據(jù)由境外臨床研究機構完成的��;④藥品生產(chǎn)企業(yè)尚無同劑型品種上市的或近3年未接受過國內(nèi)外監(jiān)管機構注冊核查的�;⑤支持藥品上市的關鍵臨床試驗數(shù)據(jù)研究機構近3年未接受過國內(nèi)外藥品監(jiān)管機構注冊核查����、監(jiān)督檢查的����。
中風險情形 申辦方與臨床試驗項目研究機構之間(包括臨床試驗機構、中心實驗室�、生物樣本分析檢測機構�、承擔部分研究者職責的合同研究組織),或臨床試驗項目研究機構之間存在相關利益關系的�。
綜合研判情形 ①近3年有注冊核查�、監(jiān)督檢查等未通過的�;②近3年有注冊核查、監(jiān)督檢查等被發(fā)現(xiàn)重大缺陷或重大不合規(guī)問題的����;③近3年有樣品檢驗不合格的;④近3年有接到注冊核查通知后撤回藥品注冊申請����,且未完成注冊核查的;⑤其他應考慮的研發(fā)生產(chǎn)主體合規(guī)因素�。
4��、未來藥品注冊合規(guī)審查工作面臨的形勢與挑戰(zhàn)
合規(guī)是一個組織可持續(xù)發(fā)展的基石��。合規(guī)意味著組織遵守了適用的法律法規(guī)和監(jiān)管規(guī)定����,也遵守了相關標準或道德準則等��。組織通過建立有效的合規(guī)管理體系來防范合規(guī)風險��。組織在對其所面臨的合規(guī)風險進行識別�、分析和評價的基礎上建立并改進合規(guī)管理流程�,從而達到對風險進行有效的應對和管控。合規(guī)風險評估構成了合規(guī)管理體系實施的基礎�,是有計劃地分配適當和充足的資源對已識別合規(guī)風險進行管理的基礎。對藥品注冊申請進行合規(guī)性審查�,能夠加強技術審評與注冊核查等環(huán)節(jié)的有效銜接�,提升藥品審評審批質(zhì)量和效率��,推動藥品注冊申請申報資料真實性�、準確性��、完整性����、可溯源性和規(guī)范性管理,為做好藥品技術審評和注冊監(jiān)管提供有力支撐。通過幾年來不斷地努力探索��,藥品注冊合規(guī)審查工作已取得一定成效,合規(guī)審查體系已完成初期建設�,但仍存在較大的挑戰(zhàn)����。
第一�,對藥品注冊申請相關研發(fā)生產(chǎn)主體的合規(guī)風險評估模式還需進一步細化,合規(guī)審查制度文件還需進一步完善。風險評估是比較和確定風險優(yōu)先級的風險管理工具,其通用流程為定義風險問題����、列舉所有風險因素、定量風險的變量、通過變量計算出整體的風險分數(shù)以進行風險評級[9]。風險評估的結(jié)果可以是對風險的定量評估��,也可以是對風險范圍的定性描述。目前藥品注冊申請啟動核查的風險等級劃分為高��、中、低三個風險等級,未來還需細化對研發(fā)生產(chǎn)主體風險的認知��,提高對風險要素的識別、分析和評價能力,并參考ICHQ9質(zhì)量風險管理指導原則和美國食品藥品監(jiān)督管理局基于風險的場地選擇模型,制定研發(fā)生產(chǎn)主體不合規(guī)行為風險要素量化指標和嚴重程度分布表�,探索構建基于風險評估的合規(guī)審查模型。
第二,研發(fā)生產(chǎn)主體合規(guī)管理信息庫建設還需加快推進����。合規(guī)管理信息庫是合規(guī)審查工作的重要工具��,有助于實現(xiàn)閉環(huán)管理和信息可追溯。但由于藥品監(jiān)管各部門職責分工的不同�,研發(fā)生產(chǎn)企業(yè)接受注冊核查情況和GMP符合性檢查情況等相關信息分散在國家或省級藥品監(jiān)管檢查部門�,目前合規(guī)管理信息庫收集了近幾年由藥品審評中心啟動注冊核查的相關研發(fā)生產(chǎn)主體核查結(jié)果情況����,并未能獲取所有核查檢查信息��,不能充分掌握研發(fā)生產(chǎn)主體的合規(guī)風險分布情況,亟需從國家層面系統(tǒng)整合各地區(qū)各單位的碎片化檢查信息�,進一步充實完善合規(guī)管理信息庫�。
藥品注冊合規(guī)審查是一項嶄新的�、開創(chuàng)性的工作,目前仍處于起步階段��,相關工作經(jīng)驗的積累還遠遠不夠。合規(guī)審查體系框架下的相關工作程序和制度在試運行過程中,出現(xiàn)這樣那樣的問題是在所難免的��,下一步相關部門應及時梳理問題、積累經(jīng)驗����,持續(xù)完善和規(guī)范藥品注冊合規(guī)審查體系,為建立更加科學的藥品注冊管理體系助力�。