本文帶大家通過查詢藥典�、法規(guī)及參比制劑資料等信息,確定原輔料���、包材及制劑標(biāo)準(zhǔn)�,形成目標(biāo)產(chǎn)品質(zhì)量概況(QTPP)�����。
1�����、原料藥標(biāo)準(zhǔn)
1.1查詢方式一
根據(jù)《注射劑項(xiàng)目研發(fā)生產(chǎn)策略全解析》中(第一篇處方前研究)查詢的原料藥相關(guān)信息�����,購買他們的物料小樣(多廠家購買�����,數(shù)量夠原輔料相容即可)���,如可能�,索要原料供應(yīng)商資料���,作為參考�。
1.2查詢方式二
查詢參比制劑上市國�、主流國家(美、歐、日)及中國藥典���,藥物在線標(biāo)準(zhǔn)數(shù)據(jù)庫(功能強(qiáng)大�����,強(qiáng)烈推薦)。
1.3資料分析
查詢到的資料需要參考ICH�、國內(nèi)等各類法規(guī),最終確定不低于中國藥典且制備的制劑不次于參比制劑的標(biāo)準(zhǔn)���。
1.4資料匯總
1.4.1常規(guī)檢查項(xiàng)
對比中國藥典標(biāo)準(zhǔn)(若收錄)���、國內(nèi)各廠家標(biāo)準(zhǔn)、主流國家藥典標(biāo)準(zhǔn)(美�、歐、日)及參比制劑研發(fā)上市國藥典標(biāo)準(zhǔn)(該標(biāo)準(zhǔn)與參比制劑所用標(biāo)準(zhǔn)可能一致)�,同時依據(jù)ICH、國內(nèi)等各類最新法規(guī)�,確定原料藥重點(diǎn)關(guān)注內(nèi)容,和選用的原料藥廠家提前交流進(jìn)行限度控制�,減少后續(xù)不確定性。
常規(guī)檢查項(xiàng)目:
(1)性狀
外觀�、溶解度及比旋度
重點(diǎn)關(guān)注:
顏色,若制劑的制備工藝無改變成品顏色的功能(使用活性炭吸附已不被認(rèn)可),則選用不低于參比制劑顏色的原料藥�;
外觀形態(tài),與不同晶型可能有關(guān)���,直接影響溶解度���,盡可能選擇與參比制劑研發(fā)上市國藥典標(biāo)準(zhǔn)一致的原料藥,若不一致�,則需要檢測其晶型和溶解度;
溶解性能���,與原料藥構(gòu)型有關(guān)�,盡可能選擇與參比制劑研發(fā)上市國藥典標(biāo)準(zhǔn)一致的原料藥�����;
比旋度�����,對同一物質(zhì)是一個常數(shù)�����,盡可選擇與參比制劑研發(fā)上市國藥典標(biāo)準(zhǔn)一致的原料藥;
(2)鑒別
紫外及紅外
重點(diǎn)關(guān)注:
鑒別�,目的是依據(jù)藥物的組成、結(jié)構(gòu)與性質(zhì)通過化學(xué)反應(yīng)���、儀器分析或測定物理常數(shù)(結(jié)合性狀項(xiàng)下的外觀和物理常數(shù))來判斷藥物的真?zhèn)?��,確定為同一物質(zhì)即可,不用過分關(guān)注�。
(3)檢查
酸堿度、有關(guān)物質(zhì)�、干燥失重及重金屬
重點(diǎn)關(guān)注:
酸堿度�,需要特別關(guān)注,特別是正常生產(chǎn)多批投料時�,原料藥酸堿度不同時需要不同量pH調(diào)節(jié)劑進(jìn)行調(diào)節(jié);
有關(guān)物質(zhì)���,有關(guān)物質(zhì)主要是在生產(chǎn)過程中帶入的起始原料�����、中間體���、聚合體、副反應(yīng)產(chǎn)物,以及貯藏過程中的降解產(chǎn)物等���,結(jié)合Q3A(R2):新原料藥中的雜質(zhì)及Q3B(R2):新藥制劑中的雜質(zhì)等標(biāo)準(zhǔn)�����,需要特別關(guān)注原料藥的雜質(zhì)譜及限度指標(biāo)�����,不次于參比制劑�����;
干燥失重�,指待測物品在規(guī)定的條件下���,經(jīng)干燥至恒重后所減少的重量�,注意多批次干燥失重的數(shù)據(jù)�,干燥失重數(shù)據(jù)偏差過大會影響原料藥的穩(wěn)定性;
重金屬�����,指在規(guī)定實(shí)驗(yàn)條件下能與硫代乙酰胺或硫化鈉作用顯色的金屬雜質(zhì),特別關(guān)注制劑成分中是否與金屬雜質(zhì)進(jìn)行螯合或其他反應(yīng)���,若有���,重點(diǎn)控制其限度;
(4)含量
重點(diǎn)關(guān)注:
含量�,物質(zhì)中所包含的某種成分的量,特別關(guān)注原料藥中帶有結(jié)合水�、鹽基等成分,注意投料準(zhǔn)確性及多批次含量數(shù)據(jù)�����;
(5)類別
重點(diǎn)關(guān)注:
類別�����,原料藥分類涉及制劑藥品分類���,結(jié)合ATC分類用于共線生產(chǎn)評估及確定生產(chǎn)線適用性;
(6)貯藏
重點(diǎn)關(guān)注:
貯藏�����,藥品的穩(wěn)定性不僅與其自身的性質(zhì)有關(guān),還與外界溫���、濕�、氣體及包裝材料有關(guān)�����,特別關(guān)注自研制劑的貯藏方式不應(yīng)嚴(yán)于參比制劑���;
附加檢查項(xiàng)目:
(1)殘留溶劑
重點(diǎn)關(guān)注:
殘留溶劑���,指在原料藥生產(chǎn)中使用的,但在工藝過程中未能完全去除的有機(jī)溶劑�����,在常規(guī)劑型制備工藝中很少有去除殘留溶劑措施�����,結(jié)合Q3C(R8):雜質(zhì):殘留溶劑的指導(dǎo)原則���,控制原輔料殘留溶劑不高于制劑標(biāo)準(zhǔn)���;
(2)元素雜質(zhì)
重點(diǎn)關(guān)注:
元素雜質(zhì)���,藥品中的元素雜質(zhì)有多種來源;它們可能是在合成中有意添加的催化劑的殘留�,也可能是實(shí)際存在的雜質(zhì)(如:與生產(chǎn)設(shè)備或包裝系統(tǒng)相互作用產(chǎn)生的雜質(zhì)或藥品各個組分中存在的雜質(zhì)),結(jié)合元素雜質(zhì)指導(dǎo)原則Q3D(R2)���,控制原輔包�、生產(chǎn)設(shè)備及注射用水等多途徑的元素雜質(zhì)不高于制劑標(biāo)準(zhǔn)�����;
(3)細(xì)菌內(nèi)毒素
重點(diǎn)關(guān)注:
細(xì)菌內(nèi)毒素���,是G-菌細(xì)胞壁的脂多糖成分�,于細(xì)菌死亡解體后釋放�����,適量時可激活免疫系統(tǒng)���,對機(jī)體產(chǎn)生有益作用���,過量則可引起機(jī)體嚴(yán)重的病理生理反應(yīng),表現(xiàn)為發(fā)熱�����、低血壓�、心動過速、休克�、多器官功能衰竭甚至死亡,控制原輔包���、生產(chǎn)設(shè)備及注射用水等多途徑的細(xì)菌內(nèi)毒素不高于制劑標(biāo)準(zhǔn)�����;
(4)微生物限度
重點(diǎn)關(guān)注:
微生物限度�����,微生物包括:細(xì)菌���、病毒、真菌以及一些小型的原生生物�����、顯微藻類等在內(nèi)的一大類生物群體,它個體微小�����,與人類關(guān)系密切���。微生物限度檢查法系檢查非規(guī)定滅菌制劑及其原料���、輔料受微生物污染程度的方法。檢查項(xiàng)目包括細(xì)菌數(shù)�、霉菌數(shù)、酵母菌數(shù)及控制菌檢查�����;關(guān)注非最終滅菌產(chǎn)品及最終滅菌產(chǎn)品的法規(guī)控制限度�;
2、輔料標(biāo)準(zhǔn)
控制標(biāo)準(zhǔn)不低于藥典相應(yīng)標(biāo)準(zhǔn)�。
3、附帶溶劑和配件標(biāo)準(zhǔn)
附帶溶劑和配件(若有)���,不低于參比制劑標(biāo)準(zhǔn)�����,注意其相容性及使用性���。
4、包材標(biāo)準(zhǔn)
控制標(biāo)準(zhǔn)不低于國家藥包字YBB標(biāo)準(zhǔn)�����,關(guān)注玻璃包材和塑料制品包材的相互替換�����,注意透水透氧率等不一致的指標(biāo)�����。
5�、制劑標(biāo)準(zhǔn)
查詢藥智數(shù)據(jù)庫、各國藥典�����,參考ICHQ3a、國內(nèi)相關(guān)法規(guī)���,對比分析�,目的是查尋原研藥�、國內(nèi)廠家(近期獲批的)的制劑標(biāo)準(zhǔn)。
6���、確定QTPP
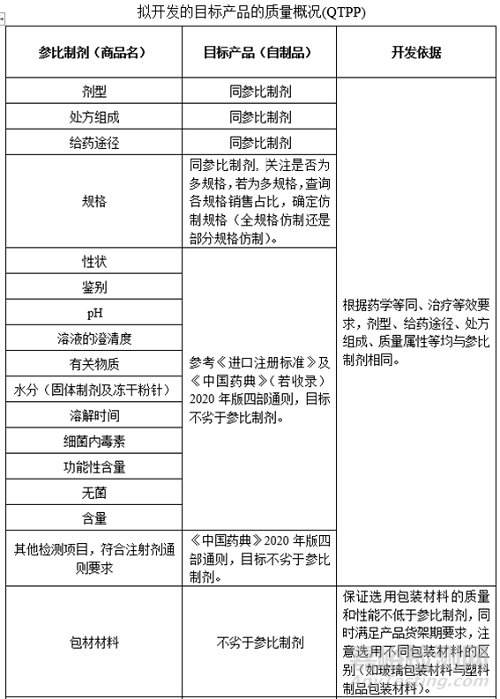
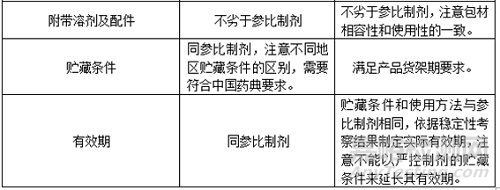
7�����、資料收集途徑
1�、https://db.yaozh.com/(藥智數(shù)據(jù)庫�����,很全面�,90%以上的資料都有)
2、https://xueshu.baidu.com/(百度學(xué)術(shù)�����,查制劑的文獻(xiàn)資料等)
3�、https://www.baidu.com/(百度�,查上市歷史�����、銷售數(shù)據(jù)等)
4���、https://www.drugfuture.com/pmda/(日本上市藥品數(shù)據(jù)庫,查處方�����、說明書等)
5���、https://db.ouryao.com/(中國藥典���、法規(guī)及標(biāo)準(zhǔn),查藥品及檢測標(biāo)準(zhǔn)等)
6�����、https://www.cde.org.cn/(國家藥品監(jiān)督管理局藥品審評中心�,查原輔料上市信息及指導(dǎo)原則等)
7、https://www.canbigou.com/directory.html(參比購���,查參比制劑目錄)
8���、https://www.drugfuture.com/fda/(美國FDA藥品數(shù)據(jù)庫(U.S. FDA Drugs Database)�,查處方���、說明書等)
9�、https://www.drugfuture.com/ema/(歐盟EMA藥品數(shù)據(jù)庫���,查處方���、說明書等)
10、https://drugx.cn/(藥研導(dǎo)航���,查各國藥監(jiān)局及藥典等)


