今日頭條
箕星引進(jìn)兩款老花眼創(chuàng)新藥報IND��。LENZ公司與箕星藥業(yè)聯(lián)合開發(fā)的鹽酸醋克利定滴眼液(LNZ100)和醋克利定溴莫尼定滴眼液(LNZ101)的臨床試驗(yàn)申請分別獲得CDE受理��。去年10月��,這兩款滴眼液已在治療老花眼的Ⅱ期臨床達(dá)到主要終點(diǎn)����。使用眼藥水1小時后�����,兩組患者的緩解率分別達(dá)到71%(p<0.0001)和56%(p<0.0001)�����,而對照組這一數(shù)值僅為6%��;視力改善持續(xù)達(dá)10小時的患者比例分別為37%和48%��,而對照組僅有4%����。
國內(nèi)藥訊
1.第四批鼓勵研發(fā)兒童藥品建議清單公示����。國家衛(wèi)健委公示《第四批鼓勵研發(fā)申報兒童藥品建議清單》�����。此次第四批鼓勵研發(fā)建議清單共計納入29種藥品�����,均為尚未在國內(nèi)注冊上市且臨床急需兒童用藥�����。具體包括噴他脒����、硝唑尼特、吉妥珠單抗/吉妥單抗�����、博舒替尼等��,主要為急性髓細(xì)胞白血病、兒童軟骨發(fā)育不全等多種疾病用藥�����。
2.貝達(dá)EGFR-TKI肺癌Ⅲ期臨床見刊��。貝達(dá)藥業(yè)從益方生物引進(jìn)的針對T790M突變的第三代EGFR-TKI貝福替尼(D-0316)在《柳葉刀·呼吸醫(yī)學(xué)》上在線發(fā)表用于一線治療EGFR敏感突變局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者的Ⅲ期臨床研究成果�����。經(jīng)獨(dú)立審查委員會評估��,貝福替尼組和?���?颂婺釋φ战M患者的中位無進(jìn)展生存期(PFS)分別為22.1個月和13.8個月����;貝福替尼的安全性與已知研究一致,沒有發(fā)現(xiàn)非預(yù)期的不良事件����。
3.天境CD73單抗肺癌早期臨床積極。天境生物公布CD73抗體尤萊利單抗聯(lián)合PD-1單抗特瑞普利單抗(拓益®)一線治療晚期非小細(xì)胞肺癌(NSCLC)的Ⅰb/Ⅱ期臨床積極結(jié)果��。在67例可評估患者中,聯(lián)合治療達(dá)到31.3%的客觀緩解率(ORR)��。在PD-L1陽性患者(TPS≥1%)中��,16例CD73高表達(dá)患者的ORR為63%��,而25例CD73低表達(dá)患者的ORR為20%��。中位隨訪為10.4個月時��,中位緩解持續(xù)時間(DOR)尚未達(dá)到�����。
4.迪哲EGFR-TKI肺癌臨床最新數(shù)據(jù)積極����。迪哲醫(yī)藥EGFR-TKI創(chuàng)新藥舒沃替尼片在ASCO2023年會上公布用于治療EGFR 20號外顯子插入突變型晚期非小細(xì)胞肺癌(NSCLC)的WU-KONG6(悟空6)研究最新結(jié)果。數(shù)據(jù)顯示��,經(jīng)獨(dú)立影像評估委員會(IRC)確認(rèn)的客觀緩解率(cORR)達(dá)到60.8%����;舒沃替尼整體安全性與傳統(tǒng)EGFR-TKI相似。今年1月����,CDE已受理舒沃替尼上述適應(yīng)癥的上市申請并將其納入優(yōu)先審評��。
5.和鉑CTLA-4抗體肝癌早期臨床積極��。和鉑醫(yī)藥CTLA-4抗體porustobart(HBM4003)在ASCO2023年會上公布與PD-1單抗特瑞普利單抗聯(lián)合治療肝細(xì)胞癌患者的Ib期研究數(shù)據(jù)����。中位隨訪為3.6個月時��,隊(duì)列1中15例可評估患者的客觀緩解率(ORR)和疾病控制率(DCR)分別為46.7%和73.3%����;在隊(duì)列2中11例可評估患者的ORR和DCR分別為9.1%(根據(jù)mRECIST為18.2%)及54.5%��。89.3%患者報告治療相關(guān)不良事件(TRAEs)����,未報告4級或5級TRAEs。
6.碩迪小分子GLP-1R激動劑啟動Ⅱa期臨床�����。碩迪生物宣布其口服小分子GLP-1R激動劑GSBR-1290治療肥胖/超重健康成人患者或肥胖/超重并患有2型糖尿病 (T2DM) 患者的Ⅱa期臨床研究已完成首例受試者給藥�����。目前,該公司已啟動一項(xiàng)Ⅰ期跨種族橋接試驗(yàn)��,以評估GSBR-1290單次和多次給藥在日本患者中的安全性�����、耐受性和藥代動力學(xué)�����。碩迪生物計劃于2024年開展GSBR-1290的國際Ⅱb期臨床研究����。
國際藥訊
1.諾和諾德長效生長激素獲歐盟推薦批準(zhǔn)。諾和諾德長效生長激素Sogroya(somapacitan)獲歐洲藥品管理局(EMA)人用藥品委員會(CHMP)推薦批準(zhǔn)�����,用于治療3歲及以上兒童生長激素缺乏癥患者����。在III期REAL4研究中,與每日皮下注射Norditropin對照組相比��,每周一次Sogroya治療組患者的年化生長速率達(dá)到非劣效標(biāo)準(zhǔn)(11.2cmvs11.7cm)。此前�����,歐盟已批準(zhǔn)該藥用于治療成人生長激素缺乏癥�����。
2.BMS創(chuàng)新貧血療法III期臨床積極��。百時美施貴寶在ASCO2023年會上首次公布血紅細(xì)胞成熟劑注射用羅特西普(利布洛澤)一線治療較低危骨髓增生異常腫瘤(MDS)成人貧血患者的III期COMMANDS研究積極結(jié)果��。與重組人促紅素組相比����,利布洛澤治療組24周時患者實(shí)現(xiàn)擺脫紅細(xì)胞輸注12周(RBC-TI)且平均血紅蛋白(Hb)水平增加≥1.5g/dL的比例更高(58.5%vs31.2%,p<0.0001)��;臨床中沒有出現(xiàn)新的安全性信號�����。
3.BMS口服抗凝藥獲FDA快速通道資格��。百時美施貴寶與楊森合作開發(fā)的口服XIa因子抑制劑milvexian獲FDA授予快速通道資格����,用于缺血性中風(fēng)、急性冠狀動脈綜合征以及房顫這3項(xiàng)適應(yīng)癥��。目前����,該新藥正處在Ⅲ期臨床開發(fā)階段。兩家公司正在Librexia項(xiàng)目中的3項(xiàng)III期研究中評估m(xù)ilvexian通過減少血栓形成�����、降低出血風(fēng)險來改善急性冠狀動脈綜合征(NCT05754957)��、房顫(NCT05757869)和缺血性中風(fēng)(NCT05702034)預(yù)后的潛力�����。
4.同種異體CAR-T治療BCP-ALL研究成果見刊����。同種異體、供體來源����、第二代 CD19靶向CAR-T細(xì)胞治療B細(xì)胞前體急性淋巴細(xì)胞白血病 (BCP-ALL) 患者的臨床研究成果日前發(fā)表在期刊Blood上��。數(shù)據(jù)顯示�����,所有13例患者接受ALLO-CAR-T細(xì)胞治療后均獲得完全緩解(CR)����,BM中微小殘留病陰性��;中位隨訪為12個月時��,8例患者維持CR�����。該產(chǎn)品的安全性與自體CAR-T細(xì)胞相當(dāng)����。
5.CD16/30免疫細(xì)胞銜接蛋白獲批Ⅱ期臨床。FDA批準(zhǔn)Affimed公司靶向CD16/CD30免疫細(xì)胞銜接蛋白(ICE)AFM13開展一項(xiàng)聯(lián)合用藥Ⅱ期臨床(AFM13-203)��,與通用型NK細(xì)胞療法AB-101聯(lián)用�����,治療復(fù)發(fā)性或難治性經(jīng)典霍奇金淋巴瘤(cHL)和CD30陽性外周T細(xì)胞淋巴瘤 (PTCL)患者�����。公布于AACR2022年會上的Ⅰ/Ⅱ期臨床數(shù)據(jù)顯示��,接受Ⅱ期推薦劑量的13例患者在接受兩輪治療后����,達(dá)到100%的客觀緩解率和62%的完全緩解率。
6.口服RTK肺癌III期臨床失敗����。Mirati公司口服酪氨酸激酶(RTK)抑制劑西曲替尼(sitravatinib)聯(lián)合PD-1抗體納武利尤單抗治療非小細(xì)胞肺癌的III期SAPPHIRE研究未達(dá)到主要終點(diǎn)。與多西他賽相比����,西曲替尼聯(lián)合治療未能顯著改善患者總生存期。目前Mirati并未公布具體數(shù)據(jù)����。百濟(jì)神州擁有該產(chǎn)品在亞洲(除了日本)、澳大利亞�����、新西蘭的開發(fā)、生產(chǎn)和商業(yè)化權(quán)益����。
醫(yī)藥熱點(diǎn)
1.楊蓓出任輝瑞中國疫苗事業(yè)部總經(jīng)理。輝瑞5月24日宣布�����,任命楊蓓為中國區(qū)疫苗事業(yè)部總經(jīng)理�����,她將向輝瑞中國區(qū)總裁彭振科匯報����。該任命自2023年6月1日正式生效。楊蓓于1998年加入輝瑞中國����。在輝瑞工作的25年中,她曾先后負(fù)責(zé)過心血管�����、抗感染、中樞神經(jīng)��、泌尿��、鎮(zhèn)痛��、腫瘤等相關(guān)領(lǐng)域的銷售和管理工作�����。
2.同濟(jì)大學(xué)附屬普陀人民醫(yī)院正式掛牌��。近日����,上海市普陀區(qū)人民醫(yī)院正式掛牌“同濟(jì)大學(xué)附屬普陀人民醫(yī)院”����,成為同濟(jì)大學(xué)第十五家附屬醫(yī)院(包括其中有3家正在籌建中的附屬醫(yī)院)。同濟(jì)大學(xué)黨委常務(wù)副書記馮身洪表示��,同濟(jì)大學(xué)將繼續(xù)全力支持附屬醫(yī)院的建設(shè)和發(fā)展����,依托大學(xué)的學(xué)科��、人才等資源優(yōu)勢����,不斷提升醫(yī)院醫(yī)����、教、研��、管綜合能力��,推動普陀人民醫(yī)院高質(zhì)量發(fā)展再上新臺階��。
3.“數(shù)字橋梁”助癱瘓者自然站立行走����。《自然》雜志24日發(fā)表的一項(xiàng)神經(jīng)科學(xué)研究指出,一種能恢復(fù)大腦和脊髓間通信的植入裝置��,被證明能幫助手臂和腿部癱瘓患者自然站立和行走����。該裝置還被發(fā)現(xiàn)能促進(jìn)神經(jīng)恢復(fù),患者在植入裝置關(guān)閉后仍能使用拐杖行走��。研究結(jié)果為恢復(fù)癱瘓后的自然運(yùn)動控制力搭建了一個框架。
評審動態(tài)
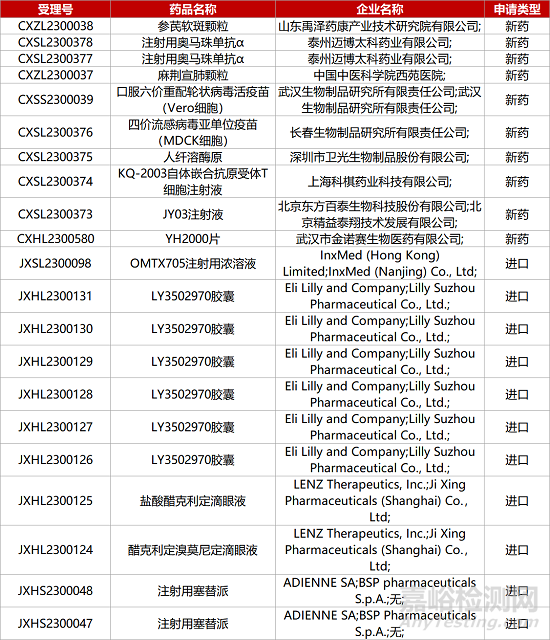
1. CDE新藥受理情況(05月27日)
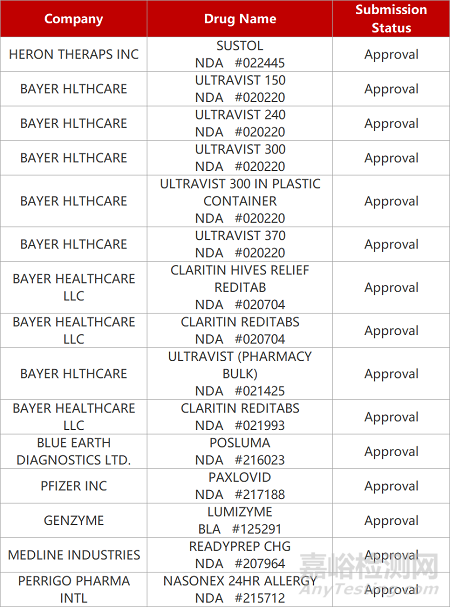
2. FDA新藥獲批情況(北美05月26日)