今日頭條
維坦P2X3R抑制劑獲批止咳臨床��。 杭州維坦醫(yī)藥中美雙報(bào)項(xiàng)目1類化藥WT-1108片獲國(guó)家藥監(jiān)局批準(zhǔn)開展I期臨床����,擬開發(fā)用于難治性或不明原因的慢性咳嗽(RCC/UCC)的治療。WT-1108是一款高亞型選擇性P2X3受體抑制劑�,后續(xù)適應(yīng)癥開發(fā)還包括其他相關(guān)慢性咳嗽��、慢阻肺/肺纖維化�、瘙癢、疼痛等��。P2X3R介導(dǎo)的迷走神經(jīng)C和A纖維活化是誘發(fā)咳嗽和致敏的核心因素之一,調(diào)節(jié)抑制P2X3活性將可降低傳入神經(jīng)興奮性以抑制咳嗽��。
國(guó)內(nèi)藥訊
1.貝達(dá)EGFR-TKI獲批上市��。貝達(dá)藥業(yè)靶向T790M突變的第三代EGFR-TKI甲磺酸貝福替尼膠囊獲國(guó)家藥監(jiān)局批準(zhǔn)上市����,適應(yīng)癥為既往使用EGFR-TKI耐藥后產(chǎn)生T790M突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌��。在II期臨床(IBIO-102)中��,貝福替尼組經(jīng)IRC評(píng)估的ORR為67.6%��,DCR為94.8%����,中位PFS為16.6個(gè)月�,中位DOR為18.0個(gè)月。今年1月��,該新藥已向CDE提交一線治療EGFR敏感突變NSCLC的新適應(yīng)癥上市申請(qǐng)��。
2.IL-4/13單抗中國(guó)獲批用于嬰幼兒濕疹����。賽諾菲與再生元聯(lián)合開發(fā)的IL-4/IL-13抑制劑度普利尤單抗(dupilumab�,Dupixent)獲國(guó)家藥監(jiān)局?jǐn)U大適用范圍����,可用于6個(gè)月至5歲患有中重度特應(yīng)性皮炎(AD)的嬰幼兒。在Ⅲ期臨床中��,與外用糖皮質(zhì)類固醇(TCS)相比��,度普利尤單抗聯(lián)合弱效TCS可提高重獲干凈的皮膚的患兒比例(28%vs4%)����;提高達(dá)到總體疾病嚴(yán)重程度改善75%或以上的患兒比例(53%vs11%)。
3.恩格列凈片新適應(yīng)癥在華獲批上市��。勃林格殷格翰與禮來共同開發(fā)的SGLT2抑制劑歐唐靜(通用名:恩格列凈片)獲國(guó)家藥監(jiān)局批準(zhǔn)新適應(yīng)癥����,推測(cè)適應(yīng)癥為降低2型糖尿病患者和心血管疾病患者的心血管死亡風(fēng)險(xiǎn)����。此前�,恩格列凈已獲國(guó)家藥監(jiān)局批準(zhǔn)三項(xiàng)適應(yīng)癥,用于治療2型糖尿??�;用于治療伴或不伴糖尿病����、射血分?jǐn)?shù)降低的心力衰竭�;用于治療射血分?jǐn)?shù)保留的心力衰竭。
4.康諾亞IL-4Rα單抗皮炎III期臨床積極�。康諾亞宣布其自主研發(fā)的1類新藥CM310重組人源化單克隆抗體注射液治療中重度特應(yīng)性皮炎(AD)的III期臨床(CM310AD005)達(dá)到主要研究終點(diǎn),詳細(xì)數(shù)據(jù)將公布于學(xué)術(shù)會(huì)議上��。CM310是首個(gè)獲批臨床的國(guó)產(chǎn)IL-4Rα抗體�,通過靶向IL-4Rα來雙重阻斷白介素4(IL-4)及白介素13(IL-13)的信號(hào)傳導(dǎo)��?���?抵Z亞目前正就該新藥NDA申請(qǐng)與國(guó)家藥監(jiān)局進(jìn)行溝通,預(yù)期將于2023年提交新藥申請(qǐng)����。
5.優(yōu)卡迪CAR-T療法早期臨床見刊。優(yōu)卡迪串聯(lián)CD19/CD22CAR-T細(xì)胞治療急性淋巴細(xì)胞白血病的Ⅰ/Ⅱ期臨床研究數(shù)據(jù)日前發(fā)表在Nature子刊Blood Cancer J.上����。數(shù)據(jù)顯示�,單純CD19 CAR-T組、串聯(lián)CD19/CD22 CAR-T組和序貫CD19/CD22 CAR-T組的完全緩解率分別為83.0%��、98.0%和95.2%��;三組的2年總生存期(OS)值分別為59.2%����、76.3%和77.6%;99例獲得緩解的患者接受了同種異體HSCT移植(allo-HSCT)����,接受allo-HSCT的患者中位無白血病生存(LFS)優(yōu)于未接受allo-HSCT的患者(未達(dá)到 vs10.9個(gè)月)�。
6.石藥Claudin18.2 ADC胃癌早期臨床積極�。Elevation Oncology公司公布靶向Claudin 18.2的ADC療法EO-3021(SYSA1801)治療胃癌和胰腺癌的早期臨床最新數(shù)據(jù)�。數(shù)據(jù)顯示,EO-3021的客觀緩解率ORR為38.1%����,疾病控制率DCR為57.1%����,對(duì)于17例胃癌患者�,ORR為47.1%�,DCR為64.7%。受此影響����,Elevation Oncology股價(jià)當(dāng)天大漲67%,市值達(dá)1.22億美元��。SYSA1801是石藥集團(tuán)巨石生物自主開發(fā)的一款潛在“first-in-class”Claudin 18.2-ADC療法�,Elevation Oncology公司擁有該新藥大中華區(qū)外獨(dú)家開發(fā)及商業(yè)化的權(quán)益��。
7.維亞臻罕見病siRNA新藥上Ⅰ期臨床。維亞臻生物小干擾RNA(siRNA)藥物VSA001注射液評(píng)估用于中國(guó)健康受試者的安全性和初步療效的Ⅰ期臨床在北京大學(xué)第三醫(yī)院完成首例受試者給藥��。VSA001可通過有效且持久地沉默載脂蛋白C3的信使RNA(APOC3 mRNA)來降低APOC3蛋白水平表達(dá)��。該新藥擬開發(fā)用于降低家族性乳糜微粒血癥綜合征(FCS)成人患者的甘油三酯水平����。
國(guó)際藥訊
1.PSMA靶向PET影像劑獲批上市����。Blue Earth Diagnostics公司靶向radiohybrid前列腺特異性膜抗原(PSMA)的PET影像劑Posluma(flotufolastat F 18)注射液(原名18F-rhPSMA-7.3)獲FDA批準(zhǔn)上市�,用于放射性正電子發(fā)射斷層掃描(PET)檢測(cè)PSMA陽性病變��,提高醫(yī)生發(fā)現(xiàn)前列腺癌轉(zhuǎn)移或復(fù)發(fā)的準(zhǔn)確性����。在Ⅲ期LIGHTHOUSE試驗(yàn)中����,與男性患者進(jìn)行根治性前列腺切除手術(shù)術(shù)前PSMA陽性病變的組織病理學(xué)標(biāo)準(zhǔn)相比����,Posluma對(duì)盆腔淋巴結(jié)的檢測(cè)具有高特異性。
2.輝瑞長(zhǎng)效血友病療法Ⅲ期臨床積極��。輝瑞每周一次皮下注射TFPI單抗Marstacimab(PF-06741086)在治療血友病的Ⅲ期研究BASIS達(dá)到主要終點(diǎn)����。與在導(dǎo)入期內(nèi)接受按需治療因子替代靜脈治療的患者隊(duì)列相比��,marstacimab治療組患者12個(gè)月時(shí)年化出血率降低92%(P<0.0001)��;與接受預(yù)防性治療隊(duì)列相比��,marstacimab亦具有優(yōu)越性(p=0.0376)����,年化出血率降低了35%。藥物的安全性與已知研究一致����。
3.肺癌突破性療法獲FDA優(yōu)先審評(píng)資格����。百時(shí)美施貴寶下一代酪氨酸激酶抑制劑(TKI)瑞普替尼(repotrectinib)的新藥申請(qǐng)(NDA)獲FDA受理�,用于治療ROS1陽性局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)��。FDA同時(shí)授予其優(yōu)先審評(píng)資格,PDUFA日期為今年11月27日�。全球Ⅰ/Ⅱ期TRIDENT-1研究結(jié)果顯示����,在ROS1 TKI初治隊(duì)列中�,全球cORR為79%����,中國(guó)亞組cORR為91%;在既往接受過1個(gè)前線ROS1 TKI+1個(gè)前線化療的經(jīng)治隊(duì)列中��,全球cORR為42%,中國(guó)亞組cORR為67%����。在中國(guó)����,CDE已將repotrectinib上市申請(qǐng)納入優(yōu)先審評(píng)����。
4.RAF/MEK抑制劑卵巢癌最新臨床數(shù)據(jù)積極��。Verastem Oncology小分子RAF/MEK抑制劑avutometinib(VS-6766)單藥以及與defactinib聯(lián)用治療復(fù)發(fā)性低級(jí)別漿液性卵巢癌(LGSOC)的臨床(RAMP 201)試驗(yàn)A部分結(jié)果積極��。數(shù)據(jù)顯示�,VS-6766與defactinib聯(lián)合治療在中位數(shù)為4種全身性療法的患者中達(dá)到45%(13/29��;95% CI:26%-64%)的客觀緩解率,有86%患者中觀察到腫瘤縮小�。安全性數(shù)據(jù)與先前報(bào)告一致�。
5.納米顆粒HIV疫苗早期臨床積極����。Fred Hutchinson癌癥中心、Scripps研究所����、NIH疫苗研究中心的聯(lián)合團(tuán)隊(duì)開發(fā)的自組裝納米顆粒HIV疫苗在未感染HIV的健康受試者中開展的Ⅰ期臨床獲積極結(jié)果����。數(shù)據(jù)顯示����,疫苗接種者被誘導(dǎo)產(chǎn)生了疫苗特異性CD4 T細(xì)胞�;同時(shí)淋巴結(jié)生發(fā)中心T濾泡輔助細(xì)胞增加�;Lumazine合酶蛋白是納米顆粒自組裝所必需的����,它也能誘導(dǎo)T細(xì)胞反應(yīng)��;Lumsyn特異性CD8 T細(xì)胞具有高度的多功能性����,并具有主要的效應(yīng)記憶表型��。詳細(xì)結(jié)果日前已發(fā)布于 Science 子刊 Science Translational Medicine 上。
6.全球首款TCR療法2023年Q1大賣3.7億����。Immunocore公司日前公布其2023年第一季度業(yè)績(jī)報(bào)告����。2023Q1報(bào)告顯示����,該公司全球首款TCR療法Kimmtrak(tebentafusp)銷售凈收入總額為4210萬英鎊(約5200萬美元����,3.7億元)����,占總營(yíng)收95%�;其中美國(guó)銷售額為2950萬英鎊銷售額(3650萬美元),歐洲銷售額為230萬英鎊(1520萬美元)����。2022年1月��,Kimmtrak獲得FDA的全球首批��,用于治療HLA-A*02:01陽性����、不可切除性或轉(zhuǎn)移性葡萄膜黑色素瘤����。
醫(yī)藥熱點(diǎn)
1.新疆計(jì)劃培養(yǎng)300名醫(yī)衛(wèi)“天山英才”�。新疆維吾爾自治區(qū)衛(wèi)健委啟動(dòng)2023年“天山英才”醫(yī)藥衛(wèi)生高層次人才培養(yǎng)項(xiàng)目,面向全疆范圍遴選培養(yǎng)300名醫(yī)藥衛(wèi)生領(lǐng)域“天山英才”����。該項(xiàng)目下設(shè)醫(yī)藥衛(wèi)生領(lǐng)軍人才��、醫(yī)藥衛(wèi)生中青年骨干2個(gè)專項(xiàng);項(xiàng)目實(shí)行公開申報(bào)��,醫(yī)藥衛(wèi)生領(lǐng)軍人才申報(bào)當(dāng)年原則上不超過57周歲��,醫(yī)藥衛(wèi)生中青年骨干申報(bào)當(dāng)年原則上不超過50周歲。入選“天山英才”醫(yī)藥衛(wèi)生高層次人才培養(yǎng)項(xiàng)目后�,新疆人才發(fā)展基金將給予每人每年最高30萬元的經(jīng)費(fèi)資助��,連續(xù)支持3年�。
2.今年國(guó)家免費(fèi)醫(yī)學(xué)生招收6150。教育部辦公廳日前發(fā)布《關(guān)于做好2023年中央財(cái)政支持中西部農(nóng)村訂單定向免費(fèi)本科醫(yī)學(xué)生招生培養(yǎng)工作的通知》指出�,2023年中央財(cái)政支持高等醫(yī)學(xué)院校為中西部鄉(xiāng)鎮(zhèn)衛(wèi)生院培養(yǎng)訂單定向免費(fèi)五年制本科醫(yī)學(xué)生共計(jì)6150人��,專業(yè)包括臨床醫(yī)學(xué)�、中醫(yī)學(xué)、蒙醫(yī)學(xué)和維醫(yī)學(xué)��。免費(fèi)定向本科醫(yī)學(xué)生錄取后、獲得入學(xué)通知書前��,須與培養(yǎng)高校和定向就業(yè)所在地的縣級(jí)衛(wèi)生健康����、人力資源社會(huì)保障行政部門簽署定向培養(yǎng)和就業(yè)協(xié)議。
3.鼓勵(lì)全日制高校學(xué)生參加基本醫(yī)保��。近日����,國(guó)家醫(yī)保局聯(lián)合教育部發(fā)布通知,鼓勵(lì)各類全日制普通高等學(xué)校(包括民辦高校)中全日制本?�?粕?���、全日制研究生參加高校所在地基本醫(yī)療保險(xiǎn)��,提高基本醫(yī)療保險(xiǎn)覆蓋面�。國(guó)家醫(yī)保局同時(shí)要求,各地要采取措施����,對(duì)家庭經(jīng)濟(jì)困難大學(xué)生個(gè)人應(yīng)繳納的基本醫(yī)療保險(xiǎn)費(fèi)及經(jīng)基本醫(yī)保支付后應(yīng)由其個(gè)人負(fù)擔(dān)的符合規(guī)定的醫(yī)療費(fèi)用,通過醫(yī)療救助制度�、家庭經(jīng)濟(jì)困難學(xué)生資助體系和社會(huì)慈善捐助等多種途徑給予資助�,切實(shí)減輕家庭經(jīng)濟(jì)困難學(xué)生的醫(yī)療費(fèi)用負(fù)擔(dān)。
評(píng)審動(dòng)態(tài)
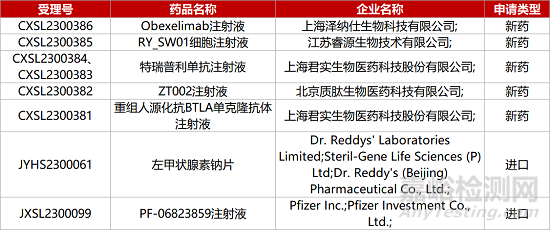
1. CDE新藥受理情況(05月31日)
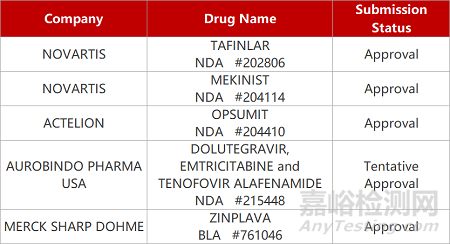
2. FDA新藥獲批情況(北美05月30日)