摘 要 / Abstract
本文梳理了美國(guó)FDA“萬絡(luò)撤市事件”的時(shí)間線�����,通過回顧萬絡(luò)不良反應(yīng)證據(jù)在不同階段的累積過程�����,并利用Meta 數(shù)據(jù)挖掘手段在相應(yīng)階段進(jìn)行動(dòng)態(tài)分析����,評(píng)估如何及發(fā)現(xiàn)萬絡(luò)存在嚴(yán)重心肌梗死風(fēng)險(xiǎn), 進(jìn)一步剖析美國(guó)FDA 在“萬絡(luò)撤市事件”中監(jiān)管滯后的原因(包括信息采集來源單一�����、信號(hào)挖掘與分析能力不足��、風(fēng)險(xiǎn)評(píng)估與決策過程中溝通不暢等)��。本文通過總結(jié)“萬絡(luò)撤市事件”發(fā)生后美國(guó)FDA 藥品安全監(jiān)管體系的變革和具體應(yīng)對(duì)舉措(包括頒布新的法案�����、重組機(jī)構(gòu)��、開展監(jiān)管科學(xué)研究等)����,以期從法律體系、組織體系��、技術(shù)體系等方面進(jìn)一步為我國(guó)藥品上市后安全性監(jiān)測(cè)模式的完善提供參考和建議����。
This paper first reviewed the timeline of the “Vioxx Withdrawal Event” of the FDA. By reviewing the accumulation of adverse reaction evidence for Vioxx at different stages and using meta-data mining to conduct dynamic analysis at corresponding stages to find out when Vioxx can be found to have a serious risk of myocardial infarction, this paper then analyzed the reasons for the FDA's lag in the regulation of Vioxx, including: single source of information collection, lack ofsignal mining and analysis ability, poor communication mechanism in risk assessment and decision-making. Finally, this paper summarized the changes in the FDA's drug safety regulatory system and specific countermeasures after the “Vioxx withdrawal event”, including the promulgation of new legislation, reorganization of institutions, reconduction of regulatory scientific research, etc., to provide references and suggestions for the improvement of post-market drug safety supervision in China from the legal system, organizational system and technical system perspectives.
關(guān) 鍵 詞 / Key words:萬絡(luò);美國(guó)FDA �����;藥品安全性監(jiān)測(cè)����;啟示
Vioxx; the United States Food and Drug Administration (FDA); drug safetymonitoring; enlightenment
20世紀(jì)90年代�����,傳統(tǒng)的非甾體抗炎藥(nonsteroidal anti-inflammatory drugs��,NSAIDs)��,如阿司匹林����、雙氯芬酸��、布洛芬等是當(dāng)時(shí)一線的解熱鎮(zhèn)痛藥物��。這些藥物在發(fā)揮良好消炎����、鎮(zhèn)痛、退熱作用的同時(shí)�����,也可能會(huì)造成較大的胃腸道不良反應(yīng)����。機(jī)制研究表明,這類藥物對(duì)環(huán)氧合酶(COX)抑制的選擇性不佳����,在抑制COX-2(發(fā)揮解熱鎮(zhèn)痛作用)的同時(shí)也抑制了COX-1(引發(fā)消化道出血等不良反應(yīng))。
此后��,默克公司研發(fā)了具有選擇性的COX-2抑制劑類非甾體抗炎藥羅非昔布片[商品名為萬絡(luò)(Vioxx)]����,于1999年5月獲得美國(guó)食品藥品監(jiān)督管理局(Food and Drug Administration,F(xiàn)DA)批準(zhǔn)上市��,用于治療骨關(guān)節(jié)炎����、類風(fēng)濕關(guān)節(jié)炎,亦用于治療急性疼痛、原發(fā)性痛經(jīng)�����。萬絡(luò)自上市后逐漸成為應(yīng)用最廣泛的處方藥之一����,截至2004年�����,全球服用過該藥品的患者多達(dá)8400萬人�����,僅2003年一年的銷售額就達(dá)到25億美元[1]����。然而�����,在萬絡(luò)上市后��,陸續(xù)有文獻(xiàn)報(bào)道其可能導(dǎo)致嚴(yán)重的心血管不良反應(yīng)����。2004年9月,默克公司自愿召回萬絡(luò)����。在萬絡(luò)撤市的過程中,大量相關(guān)訴訟案件暴發(fā),引起了輿論的廣泛關(guān)注����。美國(guó)FDA及其他藥品審批機(jī)構(gòu)受到了諸多知名醫(yī)學(xué)雜志及媒體的指責(zé),稱其忽略了萬絡(luò)在安全性方面的早期風(fēng)險(xiǎn)信號(hào)�����,未能主動(dòng)盡到保護(hù)公眾安全的職責(zé)�����,導(dǎo)致大量患者陷于本可避免的風(fēng)險(xiǎn)之中����。美國(guó)FDA在此次大規(guī)模藥害事件之后進(jìn)行了深刻反思并持續(xù)改革[2]�����。本文將梳理“萬絡(luò)撤市事件”的發(fā)生始末��,匯總該事件發(fā)生后美國(guó)FDA在藥品安全監(jiān)管體系方面進(jìn)行的改革措施��,以期為我國(guó)正處于發(fā)展期的藥物警戒體系建設(shè)提供經(jīng)驗(yàn)借鑒����。
1����、“萬絡(luò)撤市事件”概述
1.1 “萬絡(luò)撤市事件”始末
萬絡(luò)在上市前總共進(jìn)行了60個(gè)臨床試驗(yàn)�����,共有近5000名受試者參加����。基于已有證據(jù)����,美國(guó)FDA認(rèn)為默克公司已經(jīng)提供了足夠的信息來證明萬絡(luò)的安全有效性[3],于1999年5月批準(zhǔn)萬絡(luò)上市�����,用于治療急性疼痛��、骨關(guān)節(jié)炎��、原發(fā)性痛經(jīng)等�����。萬絡(luò)上市前安全信息匯總表明,服用該藥品的患者很少發(fā)生嚴(yán)重的心血管不良事件(發(fā)生率小于0.1%)�����。
為了促進(jìn)市場(chǎng)推廣�����,默克公司于1999年啟動(dòng)了5個(gè)針對(duì)萬絡(luò)的大型上市后安全性驗(yàn)證研究�����,其中萬絡(luò)胃腸道安全性研究(Vioxx Gastrointestinal Outcomes Research�����,VIGOR)率先完成��。VIGOR試驗(yàn)招募了8076名至少50歲(或至少40歲并接受長(zhǎng)期糖皮質(zhì)激素治療)的類風(fēng)濕關(guān)節(jié)炎患者[4]����,其中4047人被分配接受每天50mg的羅非昔布��,4029人被分配接受每天1000mg的萘普生(非甾體抗炎藥),主要終點(diǎn)是確認(rèn)臨床上的上消化道事件(包括胃十二指腸蠕動(dòng)或梗阻�����、上消化道出血和有癥狀的胃十二指腸潰瘍)����。
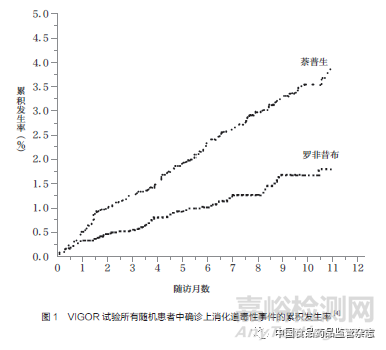
2000年5月,VIGOR試驗(yàn)結(jié)果在《新英格蘭醫(yī)學(xué)雜志》(The New England Journal of Medicine�����,NEJM)上發(fā)表��。數(shù)據(jù)顯示�����,與萘普生相比��,萬絡(luò)的上消化道毒性發(fā)生率明顯降低[4](圖1)�����;在9個(gè)月的中位隨訪期間����,使用羅非昔布的每100個(gè)患者發(fā)生確診胃腸道事件2.1起/年����,而使用萘普生的每100個(gè)患者發(fā)生4.5起/年����。此外,兩組的總死亡率和心血管原因死亡率相似��。但之后發(fā)現(xiàn)此試驗(yàn)結(jié)果漏報(bào)了3例心臟病發(fā)作的嚴(yán)重不良事件(serious adverse events�����,SAEs)和許多其他類型的心血管不良事件的數(shù)據(jù)[5]��。同年10月�����,根據(jù)VIGOR試驗(yàn)全部SAEs被納入后的統(tǒng)計(jì)數(shù)據(jù)顯示�����,與萘普生組相比�����,羅非昔布組心肌梗死等嚴(yán)重心血管事件的發(fā)病率較高�����,為0.5%�����,而萘普生組僅為0.1%����。另外,羅非昔布組卒中�����、靜脈血栓形成和高血壓發(fā)病風(fēng)險(xiǎn)也顯著增多��,因此羅非昔布的安全性受到了質(zhì)疑�����。默克公司最終將羅非昔布與萘普生引發(fā)心血管事件的風(fēng)險(xiǎn)差異解釋為:萘普生可抑制血栓素的產(chǎn)生和血小板聚集��,具有額外的心臟保護(hù)作用,而不是因?yàn)榱_非昔布的心臟毒性作用�����。
2001年2月��,美國(guó)FDA就VIGOR試驗(yàn)結(jié)果召開顧問委員會(huì)��,公布了萬絡(luò)全部的SAEs����。委員會(huì)認(rèn)為,羅非昔布的利大于弊��,建議修改說明書:不推薦大劑量(50mg/天)長(zhǎng)期應(yīng)用����,同時(shí)批準(zhǔn)羅非昔布新的適應(yīng)癥——類風(fēng)濕關(guān)節(jié)炎(25mg/天)。2002年4月����,美國(guó)FDA責(zé)令默克公司修改說明書��,增加“可能引發(fā)高血壓”和“其他心臟疾病”的黑框警告�����。2002~2004年,許多流行病學(xué)研究表明��,萬絡(luò)導(dǎo)致患心血管問題的風(fēng)險(xiǎn)增加[6]����。此后,默克公司在一項(xiàng)名為“萬絡(luò)預(yù)防腺性息肉瘤(Adenomatous Polyp Prevention on Vioxx�����,APPROVe)研究”的項(xiàng)目中發(fā)現(xiàn)����,服用萬絡(luò)18個(gè)月以上可能會(huì)導(dǎo)致患心臟病和中風(fēng)幾率升高。2004年8月��,美國(guó)FDA在第20屆藥物流行病學(xué)和治療風(fēng)險(xiǎn)處理國(guó)際會(huì)議上發(fā)布�����,對(duì)于服用大劑量萬絡(luò)(>25mg)的患者����,心肌梗死和心性猝死的發(fā)病風(fēng)險(xiǎn)比未使用該藥的患者高出3倍[7]����。2004年9月��,默克公司決定自愿召回萬絡(luò)��。
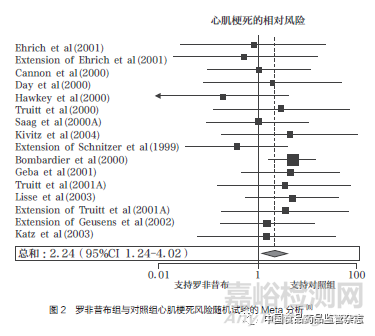
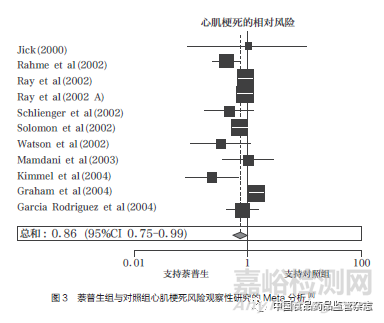
2004年12月�����,《柳葉刀》雜志(The Lancet)發(fā)表了萬絡(luò)導(dǎo)致的心血管事件累積分析��,將18項(xiàng)隨機(jī)對(duì)照試驗(yàn)和11項(xiàng)觀察性研究的數(shù)據(jù)結(jié)果進(jìn)行綜合分析�����,證實(shí)了羅非昔布會(huì)引發(fā)心血管不良反應(yīng)��,且使用羅非昔布患心肌梗死的風(fēng)險(xiǎn)是對(duì)照組的2.24倍(圖2)��;同時(shí)����,萘普生的8項(xiàng)病例對(duì)照研究和3項(xiàng)回顧性隊(duì)列研究的數(shù)據(jù)匯總分析結(jié)果顯示��,使用萘普生患心肌梗死的風(fēng)險(xiǎn)是對(duì)照組的0.86倍,僅有微弱的心臟保護(hù)作用(圖3)�����,且當(dāng)分析基于與非萘普生的NSAIDs的比較時(shí)��,也得到了幾乎相同的結(jié)果�����,這無法解釋默克公司此前所宣稱的VIGOR試驗(yàn)中羅非昔布與萘普生相比心血管風(fēng)險(xiǎn)數(shù)據(jù)異常的原因[8]��。
1.2 “萬絡(luò)撤市事件”暴露出的問題
默克公司原本宣稱��,萬絡(luò)上市后報(bào)道的不良反應(yīng)屬于回顧性數(shù)據(jù)��,而非隨機(jī)雙盲試驗(yàn)產(chǎn)生的確認(rèn)性數(shù)據(jù)��,無法證明萬絡(luò)對(duì)心血管系統(tǒng)造成風(fēng)險(xiǎn)��。直至其迫于壓力��,補(bǔ)做了納入2600名受試者的隨機(jī)雙盲臨床試驗(yàn)�����,才“證實(shí)”萬絡(luò)會(huì)引發(fā)心肌梗死等不良反應(yīng)。默克公司從未公開披露過能證明萬絡(luò)存在心血管系統(tǒng)風(fēng)險(xiǎn)的臨床試驗(yàn)結(jié)果��,其在2004年9月宣布停售萬絡(luò)后發(fā)表的有關(guān)該藥品安全記錄的聲明中也承認(rèn)了臨床試驗(yàn)數(shù)據(jù)披露不完整的行為[6]��。
1999年�����,美國(guó)FDA基于默克公司提交的數(shù)據(jù)批準(zhǔn)了萬絡(luò)的上市��,但是這些數(shù)據(jù)直至該藥品上市1年半以后才在同行評(píng)審刊物上公開發(fā)表��。在萬絡(luò)的安全隱患暴露后�����,美國(guó)FDA未能及早關(guān)注��,行使權(quán)力強(qiáng)制要求默克公司修改藥品標(biāo)簽并督促默克公司對(duì)萬絡(luò)的安全性開展重新試驗(yàn)��。直到2001年2月�����,美國(guó)FDA關(guān)節(jié)炎咨詢委員會(huì)才組織探討有關(guān)萬絡(luò)潛在的引發(fā)心血管事件的問題。2004年12月�����,《柳葉刀》雜志發(fā)布的萬絡(luò)心血管不良反應(yīng)數(shù)據(jù)的累積分析表明����,無論是在長(zhǎng)時(shí)間還是短時(shí)間用藥的患者群體中����,萬絡(luò)引起的心血管風(fēng)險(xiǎn)都是較大的,且從2000年起��,萬絡(luò)引發(fā)心肌梗死的風(fēng)險(xiǎn)明顯增加[8-9]����。如果美國(guó)FDA能盡早關(guān)注并注意在任何累積綜合分析中都能迅速增加與潛在危害有關(guān)的新數(shù)據(jù),萬絡(luò)就能被更早地采取控制舉措�����,如在萬絡(luò)說明書上添加黑框警告或者將其撤市�����。在“萬絡(luò)撤市事件”中,美國(guó)FDA不僅沒有適時(shí)將重要的安全數(shù)據(jù)提供給有關(guān)研究人員和廣大公眾進(jìn)行獨(dú)立評(píng)估[9]�����,也沒有在獲得受試者層面的數(shù)據(jù)后立即對(duì)其進(jìn)行累積分析����,導(dǎo)致錯(cuò)失了進(jìn)行及時(shí)且適當(dāng)決策的機(jī)會(huì)。
2����、“萬絡(luò)撤市事件”的反思及根源分析
2.1 信息采集來源單一且存在遺漏
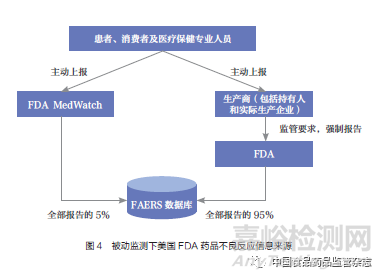
“萬絡(luò)撤市事件”發(fā)生時(shí),美國(guó)藥品不良事件報(bào)告系統(tǒng)(FDA Adverse Events Reporting System�����,F(xiàn)AERS)分別是強(qiáng)制企業(yè)報(bào)告體系和MedWatch自愿報(bào)告體系[又稱FDA安全信息與不良事件報(bào)告項(xiàng)目(The FDA Safety Information and Adverse Event Reporting Program)]��,這兩大體系是美國(guó)FDA獲得藥品不良反應(yīng)相關(guān)信息的主要來源�����,其中從生產(chǎn)企業(yè)處獲得藥品不良反應(yīng)數(shù)據(jù)的占比約為95%�����。美國(guó)FDA通過外部資源(如來自制藥企業(yè)、消費(fèi)者��、患者��、醫(yī)療保健專業(yè)人員等多個(gè)渠道的報(bào)告)收集藥品風(fēng)險(xiǎn)信息��,這種傳統(tǒng)的安全性監(jiān)測(cè)方式被稱為“被動(dòng)監(jiān)測(cè)”[10](圖4)��。而僅依靠該監(jiān)測(cè)方式的弊端在“萬絡(luò)撤市事件”中暴露無遺:企業(yè)出于自身利益考慮,未及時(shí)上報(bào)失敗的臨床試驗(yàn)數(shù)據(jù)��;同時(shí)��,美國(guó)FDA由于自身藥物警戒能力不足��,缺乏主動(dòng)監(jiān)測(cè)和風(fēng)險(xiǎn)實(shí)時(shí)預(yù)警能力�����,導(dǎo)致其過于依賴企業(yè)遞交的風(fēng)險(xiǎn)數(shù)據(jù)�����,從而無法及時(shí)掌握完整的藥物安全性信息來開展流行病學(xué)研究����。美國(guó)FDA既缺乏充分的財(cái)力和物力自行開展研究��,也缺乏對(duì)違規(guī)企業(yè)進(jìn)行處罰的法律授權(quán)�����,面對(duì)問題束手無策��。
2.2 信號(hào)挖掘與分析能力不足
由于缺乏安全性信號(hào)自動(dòng)挖掘工具和基于動(dòng)態(tài)數(shù)據(jù)的風(fēng)險(xiǎn)實(shí)時(shí)分析技術(shù)����,美國(guó)FDA忽略了萬絡(luò)在安全性方面存在的早期風(fēng)險(xiǎn)信號(hào)����。其在2000年萬絡(luò)新的中期分析數(shù)據(jù)公布之后,仍未開展深入的數(shù)據(jù)研究與風(fēng)險(xiǎn)評(píng)估�����,直到萬絡(luò)上市5年后�����,才通過第三方機(jī)構(gòu)分析確認(rèn)了該藥品會(huì)引發(fā)嚴(yán)重心血管不良反應(yīng)�����,將其撤出市場(chǎng)。藥品上市后安全性研究?jī)?nèi)容包括評(píng)估已知的嚴(yán)重風(fēng)險(xiǎn)信號(hào)����,發(fā)現(xiàn)潛在的非預(yù)期嚴(yán)重風(fēng)險(xiǎn)[11]。而檢測(cè)藥品安全信號(hào)離不開數(shù)據(jù)挖掘技術(shù)����,因此探索建立智能挖掘系統(tǒng)以輔助信號(hào)提取工作的開展十分必要。被檢測(cè)出的信號(hào)只是一種潛在的風(fēng)險(xiǎn)提示��,還需要對(duì)其進(jìn)一步分析與評(píng)價(jià)�����。“萬絡(luò)撤市事件”發(fā)生時(shí)��,美國(guó)FDA在數(shù)據(jù)處理��、信號(hào)檢測(cè)��、風(fēng)險(xiǎn)評(píng)估方面都存在不足��。其不僅缺乏相應(yīng)指南說明如何在觀察性數(shù)據(jù)的基礎(chǔ)上科學(xué)開展藥物流行病學(xué)研究��,也未建立良好的藥物警戒����、藥物流行病學(xué)數(shù)據(jù)平臺(tái),使安全性評(píng)價(jià)人員能夠從提交的不良反應(yīng)報(bào)告中更有效地發(fā)現(xiàn)和追蹤藥品安全信號(hào)[12]��。
2.3 風(fēng)險(xiǎn)評(píng)估與決策過程中溝通不暢
在對(duì)萬絡(luò)開展風(fēng)險(xiǎn)評(píng)估的過程中��,美國(guó)FDA新藥辦公室(office of new drugs��,OND)和藥品安全辦公室(office of drug safety�����,ODS)存在地位不平等�����、溝通不到位等問題����。ODS作為藥品不良反應(yīng)決策第一責(zé)任人,其職權(quán)僅限于對(duì)藥品上市后的審查����,而就藥品上市前安全問題(包括風(fēng)險(xiǎn)管理問題)僅向OND提供咨詢����,卻沒有獨(dú)立的決策權(quán)力����。“萬絡(luò)撤市事件”發(fā)生時(shí),美國(guó)FDA在藥品安全方面的決策過程中缺乏清晰的ODS定位����,ODS在FDA專家咨詢委員會(huì)會(huì)議中發(fā)揮的作用不明確,其安全信息展示和監(jiān)督權(quán)也被有所限制[13]����。此外,ODS與OND的審查部門之間缺乏溝通����,ODS給出的部分建議未得到重視和遵循�����。
3��、“萬絡(luò)撤市事件”后美國(guó)FDA的改革措施
“萬絡(luò)撤市事件”后,美國(guó)頒布了新的法規(guī)指南����,在藥品上市后風(fēng)險(xiǎn)管理方面給予了FDA更大的權(quán)力和更多的資源,也對(duì)相關(guān)企業(yè)如何做好藥品安全性監(jiān)測(cè)工作進(jìn)行了指導(dǎo)�����。經(jīng)過“萬絡(luò)撤市事件”的教訓(xùn)�����,美國(guó)FDA再次審視其工作流程和組織機(jī)構(gòu)�����,重新界定了藥品不良反應(yīng)及安全性相關(guān)監(jiān)管工作的職能�����,并根據(jù)2007年《食品和藥品管理修正法案》(the Food and Drug Administration Amendments Act of 2007����,F(xiàn)DAAA)相關(guān)規(guī)定對(duì)藥品評(píng)價(jià)與研究中心(center for drug evaluation and research,CDER)進(jìn)行改組�����。
3.1 頒布《食品和藥品管理修正法案》
2007年9月,美國(guó)頒布FDAAA��,通過立法對(duì)以下幾個(gè)方面授予FDA新的權(quán)限和資源��,從而加強(qiáng)對(duì)藥品上市后的安全監(jiān)管[14-15]��。
3.1.1 增加藥品安全領(lǐng)域經(jīng)費(fèi)支持
在財(cái)政資源方面����,根據(jù)《處方藥用戶收費(fèi)法》第四版(Prescription Drug User Fee Act Ⅳ,PDUFAⅣ)藥品安全五年計(jì)劃�����,美國(guó)國(guó)會(huì)批準(zhǔn)向FDA撥款2.25億美元��,專門用于FDA中專職負(fù)責(zé)藥品上市后風(fēng)險(xiǎn)管理的監(jiān)測(cè)與流行病學(xué)辦公室(office of surveillance and epidemiology, OSE)�����,以加強(qiáng)藥品安全跟蹤監(jiān)測(cè)[11]����。PDUFAⅣ作為FDAAA的第一個(gè)系列,其財(cái)政授權(quán)極大幫助了FDA為美國(guó)公眾開發(fā)安全有效的新藥�����,減少了FDA對(duì)企業(yè)的經(jīng)濟(jì)依賴�����,進(jìn)一步完善了藥品上市后IT系統(tǒng)��,開發(fā)并驗(yàn)證了風(fēng)險(xiǎn)管理和交流工具�����。
3.1.2 強(qiáng)制申辦方公開臨床研究數(shù)據(jù)
FDAAA明確規(guī)定�����,若申辦方要在美國(guó)開展藥物Ⅱ期及之后的臨床試驗(yàn)�����,必須在美國(guó)國(guó)立衛(wèi)生研究院(National Institutes of Health�����,NIH)下屬網(wǎng)站“ClinicalTrials.gov”上注冊(cè),并應(yīng)在試驗(yàn)結(jié)束后1年內(nèi)填報(bào)臨床試驗(yàn)結(jié)果摘要信息����,將臨床試驗(yàn)結(jié)果、嚴(yán)重或頻繁的藥品不良反應(yīng)�����、公共健康建議��、藥品審批進(jìn)程�����、受試者人口統(tǒng)計(jì)學(xué)及基線特征��、統(tǒng)計(jì)分析等數(shù)據(jù)向公眾公開[16-17]��,否則將面臨罰款��、禁制令和刑事訴訟等懲罰措施�����。例如����,美國(guó)馬薩諸塞州的制藥商Acceleron Pharma Inc.就因未能向“ClinicalTrials.gov”報(bào)告臨床試驗(yàn)結(jié)果而面臨了美國(guó)FDA發(fā)出的首次民事罰款威脅,后又通過發(fā)布摘要結(jié)果履行了其法定義務(wù)��。
3.1.3 創(chuàng)新提出REMS概念�����,更好控制已知風(fēng)險(xiǎn)
FDAAA授予美國(guó)FDA權(quán)力�����,可要求申辦方制定風(fēng)險(xiǎn)評(píng)估和緩解策略(risk evaluation and mitigation strategies, REMS)����。通過將REMS寫入立法,美國(guó)FDA被賦予了對(duì)未履行責(zé)任企業(yè)進(jìn)行經(jīng)濟(jì)處罰的權(quán)力����,這大大增強(qiáng)了REMS執(zhí)行效力。為了提升風(fēng)險(xiǎn)評(píng)估水平��,F(xiàn)DAAA“上市后研究與監(jiān)測(cè)”(Post-marketing Research and Surveillance)章節(jié)增加了“505-1REMS”條款�����。一方面,F(xiàn)DA有權(quán)在認(rèn)為必要的情況下��,要求申辦方在新藥注冊(cè)時(shí)遞交REMS評(píng)估報(bào)告����,以確保藥品的獲益大于風(fēng)險(xiǎn);另一方面�����,對(duì)已獲批的藥品而言�����,如果有新的藥品安全信息(如未識(shí)別����、標(biāo)注的風(fēng)險(xiǎn),已知嚴(yán)重不良反應(yīng)相關(guān)新發(fā)現(xiàn))��,F(xiàn)DA也有權(quán)要求申辦方提供REMS[11]�����。
3.1.4 開展主動(dòng)監(jiān)測(cè)
美國(guó)國(guó)會(huì)在FDAAA中授權(quán)了哨點(diǎn)行動(dòng)項(xiàng)目(Sentinel Initiative)����,這是一個(gè)用以建設(shè)和實(shí)施國(guó)家藥品安全電子監(jiān)測(cè)系統(tǒng)的長(zhǎng)期項(xiàng)目[18]����。2008年5月����,美國(guó)衛(wèi)生與人類服務(wù)部(Department of Health and Human Services�����,DHHS)及FDA宣布發(fā)起哨點(diǎn)行動(dòng)��。該哨點(diǎn)行動(dòng)利用各種醫(yī)療數(shù)據(jù)庫(如醫(yī)保數(shù)據(jù)庫��、電子病歷及藥品監(jiān)管數(shù)據(jù)庫等)����,將多個(gè)數(shù)據(jù)源整合起來用于藥物警戒研究,從而主動(dòng)監(jiān)測(cè)藥品安全[19]����。其中,F(xiàn)DA每年購(gòu)買的商業(yè)醫(yī)保數(shù)據(jù)庫涵蓋的數(shù)據(jù)量大��,較完整地收集了參保人員信息,在服藥人群安全性信息采集工作的完整性和標(biāo)準(zhǔn)化方面作出巨大貢獻(xiàn)����。2016年,F(xiàn)DA啟動(dòng)全規(guī)模哨點(diǎn)系統(tǒng)��,作為藥品上市后安全性監(jiān)測(cè)工具庫核心資源[20]�����。哨點(diǎn)系統(tǒng)具有全面實(shí)現(xiàn)主動(dòng)上市后風(fēng)險(xiǎn)識(shí)別和分析(active post-market risk identification and analysis��,ARIA)能力�����。FDA通過ARIA系統(tǒng)可實(shí)時(shí)收集藥品全生命周期安全信息�����,自動(dòng)開展信號(hào)挖掘����、驗(yàn)證和確認(rèn),能夠?qū)μ囟ㄋ幤?mdash;事件組合進(jìn)行有針對(duì)性的監(jiān)測(cè),并根據(jù)優(yōu)先等級(jí)進(jìn)行分類��,識(shí)別和確認(rèn)新的安全問題����。
3.2 發(fā)布3個(gè)風(fēng)險(xiǎn)管理技術(shù)指南
美國(guó)FDA為改正自身在藥品風(fēng)險(xiǎn)管理中存在的問題,于2005年3月發(fā)布了關(guān)于藥品風(fēng)險(xiǎn)管理的3個(gè)最終指南�����,分別是:《上市前風(fēng)險(xiǎn)評(píng)估指南》(Guidelines for Pre-Marketing Risk Assessment)����,《風(fēng)險(xiǎn)最小化行動(dòng)計(jì)劃的開發(fā)和使用指南》(Development and Use of Risk Minimization Action Plans)��,《藥物警戒管理規(guī)范與藥物流行病學(xué)評(píng)估指南》(Good Pharmacovigilance Practices and Pharmacoepidemiologic Assessment)�����。這3個(gè)指南分別從藥品上市前����、上市后和企業(yè)自身控制3個(gè)角度對(duì)藥品風(fēng)險(xiǎn)管理提出規(guī)范性建議[21]。在上市前后的試驗(yàn)和藥物警戒方面��,F(xiàn)DA吸取了“萬絡(luò)撤市事件”中對(duì)于藥物流行病學(xué)研究不夠重視的教訓(xùn),收錄了一系列用于評(píng)價(jià)藥品安全性風(fēng)險(xiǎn)因素的藥物流行病學(xué)常用方法�����,并利用登記記錄系統(tǒng)和問卷調(diào)查等方式多渠道收集信息��,并從文獻(xiàn)報(bào)道��、醫(yī)師記錄等來源多方面識(shí)別安全信號(hào)����,評(píng)價(jià)影響藥品不良反應(yīng)的各個(gè)因素。FDA以發(fā)布風(fēng)險(xiǎn)管理指南的方式明確企業(yè)的風(fēng)險(xiǎn)干預(yù)義務(wù)�����,對(duì)企業(yè)藥物警戒義務(wù)履行情況的監(jiān)督以協(xié)商溝通為主��,輔以強(qiáng)制性干預(yù)措施����。
3.3調(diào)整優(yōu)化組織機(jī)構(gòu)
3.3.1 成立藥品安全監(jiān)督委員會(huì)
美國(guó)FDA于2005年2月設(shè)立藥品安全監(jiān)督委員會(huì)(Drug Safety Oversight Board,DSB)��。DSB 由FDA的3個(gè)中心以及聯(lián)邦政府其他8家衛(wèi)生健康相關(guān)部門機(jī)構(gòu)[包括醫(yī)療保健研究和質(zhì)量管理署(Agency for Healthcare Research and Quality�����,AHRQ)、疾病控制和預(yù)防中心(Centers for Disease Control and Prevention����,CDC)、醫(yī)療保險(xiǎn)和醫(yī)療補(bǔ)助服務(wù)中心(Centers for Medicare and Medicaid Services����,CMS)、國(guó)防部(Department of Defense��,DOD)�����、衛(wèi)生資源和服務(wù)管理局(Health Resources and Services Administration�����,HRSA)�����、印第安人衛(wèi)生服務(wù)署(Indian Health Service����,IHS)、國(guó)立衛(wèi)生研究院(National Institutes of Health�����,NIH)����、退伍軍人事務(wù)部(Department of Veterans Affairs,VA)]的代表組成[22]��。DSB 的重要職責(zé)之一是幫助FDA評(píng)估本部門做出的藥品安全決策對(duì)其他聯(lián)邦機(jī)構(gòu)健康衛(wèi)生體系的影響�����。根據(jù)FDAAA的法律授權(quán)��,DSB負(fù)責(zé)在必要時(shí)就重要且經(jīng)常出現(xiàn)的藥品安全問題向FDA提出處理和溝通建議�����,但無權(quán)撤銷藥品或者更改藥品標(biāo)識(shí)��。此外����,DSB還負(fù)責(zé)為FDA應(yīng)當(dāng)何時(shí)就藥品隱患向消費(fèi)者發(fā)出警告提出建議����。
3.3.2 組建新的監(jiān)測(cè)與流行病學(xué)一級(jí)辦公室
根據(jù)FDAAA新授權(quán)的職責(zé)��,美國(guó)FDA進(jìn)行了相應(yīng)的組織架構(gòu)調(diào)整�����。組織機(jī)構(gòu)改革前�����,ODS是FDA負(fù)責(zé)藥品不良反應(yīng)監(jiān)測(cè)的最主要部門��,級(jí)別屬于二級(jí)辦公室�����,隸屬于藥物流行病學(xué)和統(tǒng)計(jì)學(xué)辦公室(office of pharmacoepidemiology and statistical science��,OPaSS)(圖5a)����。組織機(jī)構(gòu)改革后,ODS更名為OSE,并將級(jí)別從二級(jí)辦公室提升至一級(jí)辦公室�����,直屬CDER的中心主任辦公室(圖5b)�����。OSE辦公室地位的提升�����,不僅增強(qiáng)了與其他部門的溝通交流和話語權(quán)��,還擴(kuò)大了流行病學(xué)����、風(fēng)險(xiǎn)評(píng)估、項(xiàng)目管理等藥品安全相關(guān)領(lǐng)域的崗位編制�����,擁有了更強(qiáng)大的監(jiān)管力量��。機(jī)構(gòu)重組后����,OSE主要負(fù)責(zé)安全信息采集��、風(fēng)險(xiǎn)識(shí)別和初篩[23](表1)��,OND主要負(fù)責(zé)獲益及風(fēng)險(xiǎn)整合評(píng)估和監(jiān)管決策��,二者協(xié)同開展獲益及風(fēng)險(xiǎn)監(jiān)測(cè)�����。
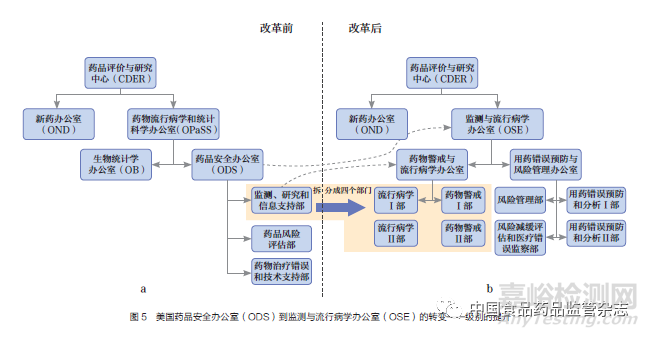

3.3.3 增設(shè)藥品安全政策和通信人員
2006年4月��,美國(guó)FDA宣布撤銷OPaSS��,在CDER中心層面增設(shè)藥品安全政策和通信人員(safety policy and communication staff����,SPCS)崗位����,并且任命原OPaSS主任為CDER中心副主任,負(fù)責(zé)管理SPCS的具體工作��。SPCS主要管理DSB和MedWatch�����,負(fù)責(zé)藥品安全問題和政策勘查�����,通過FDA網(wǎng)站向醫(yī)藥專家和患者提供藥品安全信息[17]�����。
4��、思考與啟示
自2015年我國(guó)藥品審評(píng)審批制度改革以來�����,國(guó)產(chǎn)創(chuàng)新藥的批準(zhǔn)數(shù)量大幅度提升�����。需要注意的是��,由于通過大樣本量才能有效觀測(cè)到罕見的��、嚴(yán)重的藥品不良反應(yīng)����,我國(guó)的藥物警戒系統(tǒng)應(yīng)盡早做好準(zhǔn)備�����。美國(guó)FDA施行的改革措施使其逐步建立起覆蓋全面����、職權(quán)清晰��、協(xié)調(diào)順暢的藥物警戒體系�����,這對(duì)我國(guó)全生命周期藥物警戒體系建設(shè)和發(fā)展有啟示意義��。
4.1 進(jìn)一步完善藥物警戒法規(guī)指南體系
目前��,我國(guó)藥物警戒相關(guān)法律法規(guī)正處于快速更新時(shí)期�����。自2017年加入國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use��,ICH)以來,我國(guó)相繼發(fā)布了《國(guó)家藥品監(jiān)督管理局關(guān)于藥品上市許可持有人直接報(bào)告不良反應(yīng)事宜的公告》《藥品管理法》《藥物警戒質(zhì)量管理規(guī)范》等一系列法律法規(guī)和指導(dǎo)文件����。建議監(jiān)管部門進(jìn)一步完善藥物警戒法規(guī)指南體系�����,制定專門的指南性文件�����,加強(qiáng)對(duì)相關(guān)企業(yè)開展風(fēng)險(xiǎn)管理實(shí)踐工作的指導(dǎo)��。
4.2 進(jìn)一步完善藥物警戒組織體系
在我國(guó)目前的藥品安全監(jiān)管體系中��,藥物警戒涉及的藥品上市前審批��、上市后監(jiān)測(cè)評(píng)價(jià)��、審核查驗(yàn)等職能分設(shè)在不同部門��。其中�����,藥品不良反應(yīng)監(jiān)測(cè)部門的職責(zé)側(cè)重于藥品上市后的安全性監(jiān)測(cè)評(píng)價(jià),藥品審評(píng)審批部門則側(cè)重于藥品上市前的安全性和有效性評(píng)價(jià)����。建議我國(guó)結(jié)合國(guó)情,借鑒美國(guó)FDA優(yōu)化組織機(jī)構(gòu)的做法�����,調(diào)整我國(guó)監(jiān)測(cè)機(jī)構(gòu)設(shè)置策略�����,進(jìn)一步明晰各部門職責(zé)和工作程序����,建立藥品上市前和上市后管理部門之間的信息交流、溝通協(xié)作機(jī)制��,實(shí)現(xiàn)上市前和上市后藥品風(fēng)險(xiǎn)管理的有效銜接和密切溝通��,形成藥物警戒不同環(huán)節(jié)的有機(jī)融合[24]����。
4.3 進(jìn)一步健全、強(qiáng)化藥品安全信息披露機(jī)制
目前�����,我國(guó)《藥品管理法》中雖然包含了部分關(guān)于藥品安全信息披露的內(nèi)容,但仍存在定義不明確�����、披露內(nèi)容較分散�����、缺乏相應(yīng)罰則等局限性����。此外�����,部分企業(yè)基于自身商業(yè)利益的考慮�����,存在隱瞞其失敗試驗(yàn)結(jié)果的情形����,將患者置于治療延誤或失敗的風(fēng)險(xiǎn)之下�����。因此����,建議進(jìn)一步完善我國(guó)藥品安全信息強(qiáng)制披露的法律制度�����,明確規(guī)定披露主體的權(quán)責(zé)����,細(xì)化針對(duì)企業(yè)未履行信息披露義務(wù)的罰則,進(jìn)一步完善企業(yè)信息披露的獎(jiǎng)懲機(jī)制����,避免在臨床試驗(yàn)失敗后仍有其他企業(yè)重蹈覆轍。
4.4 進(jìn)一步完善安全性數(shù)據(jù)集的收集和標(biāo)準(zhǔn)化
現(xiàn)階段�����,我國(guó)藥品不良反應(yīng)監(jiān)測(cè)工作主要依賴于國(guó)家與地方藥品評(píng)價(jià)中心的不良反應(yīng)監(jiān)測(cè)系統(tǒng)�����。盡管2016年國(guó)家藥品不良反應(yīng)監(jiān)測(cè)哨點(diǎn)聯(lián)盟(CASSA)的成立,極大改善了我國(guó)在藥品安全數(shù)據(jù)收集方面較為被動(dòng)的局面�����,但是在數(shù)據(jù)收集的完整性��、標(biāo)準(zhǔn)化��、智能化方面仍有較大的提升空間����,不同醫(yī)療機(jī)構(gòu)和藥品生產(chǎn)企業(yè)在安全信息收集方面缺乏統(tǒng)一的標(biāo)準(zhǔn)��,不良反應(yīng)報(bào)告存在專業(yè)術(shù)語不規(guī)范��、信息缺失以及數(shù)據(jù)可溯源性差等不足[25]����。建議拓寬安全信息收集的渠道,加強(qiáng)相關(guān)企業(yè)對(duì)信息收集的主動(dòng)性和積極性�����。除了打通醫(yī)療機(jī)構(gòu)信息系統(tǒng)的藥品安全信息收集渠道外��,建議將醫(yī)保數(shù)據(jù)庫也納入安全數(shù)據(jù)集中,構(gòu)建統(tǒng)一的數(shù)據(jù)收集模式��,并采用標(biāo)準(zhǔn)化的數(shù)據(jù)模型從中提取數(shù)據(jù)��。
4.5 進(jìn)一步提升智能化信號(hào)挖掘和分析能力
目前��,我國(guó)藥物警戒工作的主要著力點(diǎn)不僅集中在不良反應(yīng)數(shù)據(jù)收集��,還包括數(shù)據(jù)的挖掘與分析����。隨著藥物警戒體系的發(fā)展,我國(guó)逐步建立起以人工和計(jì)算機(jī)數(shù)據(jù)挖掘技術(shù)相結(jié)合的模式��,用于開展更準(zhǔn)確有效的監(jiān)測(cè)工作�����。但需要注意的是����,近年來國(guó)家藥品監(jiān)管部門積累了海量的藥品不良反應(yīng)數(shù)據(jù),如何對(duì)其高效開展數(shù)據(jù)挖掘并及時(shí)采取風(fēng)險(xiǎn)預(yù)測(cè)措施����,還需要進(jìn)一步的發(fā)展和提升�����。建議推進(jìn)數(shù)據(jù)挖掘和自動(dòng)預(yù)警系統(tǒng)�����、藥物安全性智能評(píng)估工具的開發(fā)����,實(shí)現(xiàn)安全性信號(hào)的智能化識(shí)別�����,從而實(shí)現(xiàn)構(gòu)建智慧化的全生命周期藥物警戒與風(fēng)險(xiǎn)管理體系�����。
引用本文:周天愛,馬倩,楊勁*.“萬絡(luò)撤市事件”后美國(guó)FDA藥品安全監(jiān)管體系的變革和具體應(yīng)對(duì)舉措分析[J].中國(guó)食品藥品監(jiān)管,2023(04):52-73.