摘要:2019 年《藥品管理法》明確規(guī)定境外持有人應(yīng)當(dāng)設(shè)置境內(nèi)代理人,履行相關(guān)義務(wù)并承擔(dān)連帶責(zé)任��。本文采用文獻(xiàn)研究法�����、比較研究法����、訪談?wù){(diào)研法��,在梳理我國過去進(jìn)口藥品代理人管理歷程��、境內(nèi)代理人設(shè)立的背景和目的�����、歐美日國家代理人管理現(xiàn)狀的基礎(chǔ)上��,對新法背景下境內(nèi)代理人的性質(zhì)��、責(zé)權(quán)利展開分析��。我國境外持有人的境內(nèi)代理人并非民法制度意義上的代理人��,而是《藥品管理法》語境下的代理人��。設(shè)立境內(nèi)代理人本質(zhì)上是為了契合以持有人為主線的全生命周期管理�����,境內(nèi)代理人與境外持有人在民事責(zé)任上連帶����,其行政和刑事責(zé)任則受到藥事法律規(guī)章的約束。因此����,境內(nèi)代理人的制度設(shè)計中需要考慮代理人的責(zé)權(quán)匹配,以促進(jìn)制度更好地實(shí)施����。
2019 年《中華人民共和國藥品管理法》(以下簡稱《藥品管理法》)全面實(shí)施藥品上市許可持有人(Marketing Authorization Holder,MAH)�����,并將其作為基本制度����、核心制度����,貫穿于整部《藥品管理法》。2020 年國家藥品監(jiān)督管理局(以下簡稱國家藥監(jiān)局)綜合司發(fā)布《境外藥品上市許可持有人境內(nèi)代理人管理暫行規(guī)定(征求意見稿)》����,征求意見稿中就境內(nèi)代理人的定義、條件��、責(zé)任義務(wù)、監(jiān)管等事項(xiàng)進(jìn)行了規(guī)定����。境內(nèi)代理人制度是《藥品管理法》下新增的規(guī)定,本文擬對進(jìn)口藥品代理人管理歷程��、境內(nèi)代理人設(shè)立的背景和目的��、歐美日國家代理人管理現(xiàn)狀及我國境內(nèi)代理人的性質(zhì)����、責(zé)權(quán)利等展開分析,以期完善我國境內(nèi)代理人的管理��。
一��、新舊《藥品管理法》下關(guān)于進(jìn)口藥品境內(nèi)代理人的管理情況
1.1 2001 年《藥品管理法》下進(jìn)口藥品代理人的管理情況
1.1.1相關(guān)法律規(guī)定
2001 年《藥品管理法》實(shí)施時��,我國尚未實(shí)施 MAH 制度����。但針對進(jìn)口藥品,由于生產(chǎn)場地在境外�����,其實(shí)質(zhì)上實(shí)施的是 MAH 制度。在進(jìn)口藥品管理方面����,2002年、2007 年《藥品注冊管理辦法》對進(jìn)口藥品提交藥物臨床試驗(yàn)申請��、藥品上市申請進(jìn)行了明確規(guī)定��。同時�����,2003 年《藥品進(jìn)口管理辦法》明確了藥品進(jìn)口備案�����、報關(guān)����、口岸檢驗(yàn)等事項(xiàng)。
此時《藥品管理法》中對于進(jìn)口藥品沒有明確的代理人的要求��。其中�����,1999年《藥品流通監(jiān)督管理辦法》(暫行)【失效】中規(guī)定����,已獲《進(jìn)口藥品注冊證》的進(jìn)口藥品在國內(nèi)市場銷售,國外制藥廠商必須選定中國合法的進(jìn)口藥品國內(nèi)銷售代理商����,國內(nèi)銷售代理商必須向國家藥監(jiān)局備案。銷售代理商指取得《藥品經(jīng)營企業(yè)許可證》的企業(yè)法人��,依據(jù)其與國外制藥廠商之間所簽訂的協(xié)議����,從事進(jìn)口藥品國內(nèi)銷售代理等業(yè)務(wù)的藥品經(jīng)營企業(yè)。國內(nèi)銷售代理商又被稱為國內(nèi)總代�����。此后又相繼出現(xiàn)過注冊代理人�����、質(zhì)量管理代理人等多種代理人角色��,依據(jù)雙方之間的合同約定����,負(fù)責(zé)代為辦理注冊��、質(zhì)量管理等事項(xiàng)[1]����。
1.1.2 實(shí)踐中的管理情況
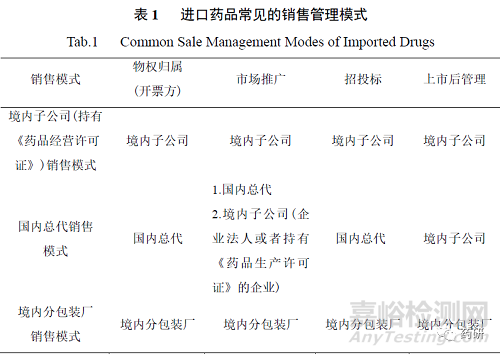
根據(jù)前文規(guī)定可知����,過去進(jìn)口藥品沒有嚴(yán)格法律意義上的代理人,但是境外持有人會根據(jù)自身品種特點(diǎn)�����,國內(nèi)銷售代理商的銷售實(shí)力�����、渠道資源��、學(xué)術(shù)推廣能力��、市場信譽(yù)等選擇合適的銷售代理商�����。國內(nèi)銷售代理商可能由境外持有人在中國境內(nèi)設(shè)立的����、持有《藥品經(jīng)營許可證》的子公司擔(dān)任,也可以是國藥控股����、上海醫(yī)藥、華潤醫(yī)藥����、九州通等流通企業(yè)擔(dān)任。境外持有人與國內(nèi)銷售代理商簽訂銷售協(xié)議����,由其負(fù)責(zé)產(chǎn)品的進(jìn)口備案、報關(guān)�����、銷售代理等工作��。需要注意的是��,國內(nèi)銷售代理商以自身名義開票,故國內(nèi)銷售代理商本質(zhì)上是經(jīng)銷的概念����,而非代理概念。
此時進(jìn)口產(chǎn)品在中國市場的學(xué)術(shù)推廣工作可能由國內(nèi)銷售代理商承擔(dān)��,也可能由境外持有人在境內(nèi)設(shè)立的子公司承擔(dān)�����。在藥品上市后管理方面��,主要包括不良反應(yīng)監(jiān)測��、質(zhì)量投訴及召回等��,往往由境外持有人在境內(nèi)設(shè)立的子公司承擔(dān)��,國內(nèi)銷售代理商予以配合協(xié)助��,比如國內(nèi)銷售代理商負(fù)責(zé)通知子公司流通環(huán)節(jié)的投訴����、進(jìn)行必要的調(diào)查、配合召回等�����,同時境外持有人也會協(xié)調(diào)相關(guān)工作。
針對進(jìn)口分包裝產(chǎn)品��,根據(jù) 2007 年《藥品注冊管理辦法》的規(guī)定��,接受分包裝的藥品生產(chǎn)企業(yè)應(yīng)當(dāng)提交補(bǔ)充申請����,取得《藥品補(bǔ)充申請批件》和藥品批準(zhǔn)文號����。實(shí)踐中由于進(jìn)口分包裝企業(yè)持有藥品批準(zhǔn)文號,故通常由其負(fù)責(zé)品種的進(jìn)口和銷售����、學(xué)術(shù)推廣、招投標(biāo)及品種上市后管理工作[2]����。進(jìn)口藥品常見的銷售管理模式如表 1 所示。
1.2 2019 年《藥品管理法》下境外持有人的境內(nèi)代理人管理情況
1.2.1 相關(guān)法律規(guī)定
2019 年《藥品管理法》全面實(shí)施 MAH 制度�����。隨著 2020 年《藥品注冊管理辦法》的實(shí)施,我國不再區(qū)分國產(chǎn)藥品和進(jìn)口藥品�����,統(tǒng)一劃分為境內(nèi)生產(chǎn)的藥品��,境外生產(chǎn)的藥品?�,F(xiàn)階段有兩種情況�����,境內(nèi)生產(chǎn)的藥品�����,持有人在境內(nèi)��;境外生產(chǎn)的藥品����,持有人在境外,后者即對應(yīng)此前的進(jìn)口藥品[3]��。
根據(jù) 2019 年《藥品管理法》第三十八條規(guī)定�����,藥品上市許可持有人為境外企業(yè)的,應(yīng)當(dāng)由其指定的在中國境內(nèi)的企業(yè)法人履行義務(wù)����,與藥品上市許可持有人承擔(dān)連帶責(zé)任;第一百三十六條規(guī)定�����,藥品上市許可持有人為境外企業(yè)的�����,其指定的在中國境內(nèi)的企業(yè)法人未依照本法規(guī)定履行相關(guān)義務(wù)的�����,適用本法有關(guān)藥品上市許可持有人法律責(zé)任的規(guī)定��。即《藥品管理法》首次從法律層面明確要求境外持有人應(yīng)當(dāng)設(shè)立中國境內(nèi)的企業(yè)法人����,履行《藥品管理法》規(guī)定的義務(wù)�����,承擔(dān)連帶責(zé)任。
2020 年 8 月國家藥監(jiān)局綜合司就《境外藥品上市許可持有人境內(nèi)代理人管理暫行規(guī)定》征求意見����,將境外持有人設(shè)立的中國境內(nèi)企業(yè)法人定位為境內(nèi)代理人,并規(guī)定了境內(nèi)代理人的定義�����、條件��、義務(wù)�����、監(jiān)管等事項(xiàng)����。
境外持有人的境內(nèi)代理人條件:①中國境內(nèi)設(shè)立的企業(yè)法人;②具有與從事代理工作相適應(yīng)的質(zhì)量管理制度�����,以及與其承擔(dān)責(zé)任相適應(yīng)的質(zhì)量管理體系�����;③具有與從事代理工作相適應(yīng)的辦公場所、通信方式�����、聯(lián)系電話����;④具有能夠確保產(chǎn)品可追溯的管理系統(tǒng)。
境外持有人的境內(nèi)代理人義務(wù):①負(fù)責(zé)建立藥品質(zhì)量保證體系����;②負(fù)責(zé)建立并實(shí)施藥品追溯制度�����;③負(fù)責(zé)建立并實(shí)施藥品年度報告制度��;④負(fù)責(zé)建立藥品上市后的變更管理制度��;⑤承擔(dān)藥品上市后召回����、質(zhì)量投訴�����、質(zhì)量賠償?shù)仁乱?�;⑥?fù)責(zé)建立藥物警戒體系��;⑦負(fù)責(zé)提交藥品標(biāo)準(zhǔn)物質(zhì)����;⑧負(fù)責(zé)與境外持有人聯(lián)絡(luò)����。
2022 年 5 月國家藥監(jiān)局綜合司就《中華人民共和國藥品管理法實(shí)施條例》征求意見,規(guī)定了境內(nèi)代理人的指定與變更事項(xiàng)�����,包括指定時間�����、是否載入藥品注冊證書��、境內(nèi)代理人的條件、境內(nèi)代理人的登記及變更管理等內(nèi)容����。
1.2.2管理的目的
我國 MAH 制度實(shí)施前,進(jìn)口藥品實(shí)行的也是持有人制度����。如前文分析所述,進(jìn)口藥品過去管理中存在國內(nèi)銷售代理商或者注冊代理人等����,但法律層面對于代理人并無明文規(guī)定。在 MAH 制度實(shí)施后�����,《藥品管理法》強(qiáng)調(diào)以持有人為主線��,落實(shí)藥品全生命周期管理����,由持有人對藥品的安全性�����、有效性�����、質(zhì)量可控性負(fù)責(zé)。此時境內(nèi)代理人的提出也是契合了境外持有產(chǎn)品的全生命周期管理����。通過以境內(nèi)代理人為主線,加強(qiáng)上市后管理及責(zé)任落實(shí)����,解決由于持有人在境外,監(jiān)管措施非常有限�����,特別是遇到召回��、不良反應(yīng)監(jiān)測��、監(jiān)督抽驗(yàn)等與境外企業(yè)溝通聯(lián)系獲取資料難�����、查處難和追責(zé)難等問題����?�!端幤饭芾矸ā分幸蟠砣伺c境外持有人承擔(dān)連帶責(zé)任�����,并在法律責(zé)任章節(jié)規(guī)定當(dāng)代理人沒有依法履行相關(guān)義務(wù)����,適用持有人的法律責(zé)任����,即代理人直接受到《藥品管理法》的約束,需要承擔(dān)相應(yīng)的行政責(zé)任和刑事責(zé)任��。此舉一方面能夠更好地保障患者的合法權(quán)益��,另一方面通過將代理人納入藥監(jiān)部門的監(jiān)管對象中����,更好地保障藥品上市后管理責(zé)任的落實(shí)。但是����,目前法律層面僅提出了境外持有人設(shè)立境內(nèi)企業(yè)法人(境內(nèi)代理人)的要求,關(guān)于目前境內(nèi)代理人的資質(zhì)��、責(zé)任義務(wù)及其享有的權(quán)利仍然有待進(jìn)一步明晰�����。
二��、歐美日國家有關(guān)代理人的管理情況
歐盟����、美國、日本均實(shí)行 MAH 制度��,同時也具有各國的特色��。歐盟����、日本要求持有人必須相對應(yīng)地在歐盟、日本境內(nèi)����,生產(chǎn)場地可以在境內(nèi)或者境外。美國規(guī)定持有人可以在美國境內(nèi)或者境外����,生產(chǎn)場地也可以在境內(nèi)或者境外[4]��。
2.1日本管理情況
日本采取的是資格準(zhǔn)入型的 MAH 制度��,企業(yè)必須首先取得相應(yīng)類別的銷售企業(yè)許可證(分為處方藥�����、除處方藥之外的藥品�����、藥妝����、化妝品四類)����,方可申請藥品上市許可,并在獲批后成為持有人����。日本持有人必須在日本境內(nèi),符合藥物質(zhì)量管理規(guī)范和藥物警戒質(zhì)量管理規(guī)范的要求�����,必須根據(jù)醫(yī)藥產(chǎn)品的風(fēng)險級別雇傭三名有資質(zhì)的全職管理者�����,即總銷售合規(guī)官����、質(zhì)量保證主管、上市后安全控制主管��,全面負(fù)責(zé)藥品生產(chǎn)銷售管理�����。因此日本并沒有設(shè)置代理人制度��。
2.2歐盟管理情況
根據(jù)《歐共體人用藥品注冊指令》(2001/83/EC 指令)����,歐盟持有人可以指定當(dāng)?shù)卮恚⒃谒幤窐?biāo)簽中標(biāo)注��,但不能免除持有人的任何法律責(zé)任�����。當(dāng)?shù)卮響?yīng)當(dāng)隸屬于歐盟成員國或歐盟經(jīng)濟(jì)區(qū)國家,能夠用當(dāng)?shù)卣Z言與醫(yī)療保健專業(yè)人員或者患者聯(lián)系��,負(fù)責(zé)處理產(chǎn)品質(zhì)量問題及投訴等[5]��。
2.3美國管理情況
當(dāng)持有人在美國境外��、且在美國境內(nèi)沒有居住點(diǎn)或者營業(yè)地點(diǎn)時�����,需要指定一個美國代理人��,該代理人擁有營業(yè)場所及合法地址�����,負(fù)責(zé)境外持有人與 FDA的溝通����,包括:①審查、分發(fā)��、發(fā)送和回應(yīng)所有來自 FDA 的通信�����,包括緊急通信;②回答有關(guān)進(jìn)口或準(zhǔn)備進(jìn)口到美國的藥品問題����;③協(xié)助 FDA 安排檢查����;④如果 FDA 不能直接或迅速聯(lián)系到境外持有人,F(xiàn)DA 可以向美國代理提供信息或文件��。FDA 向美國代理提供的信息或者文件等同于向境外持有人提供的信息或文件��。
因此�����,歐美日國家均是結(jié)合自身國情實(shí)施相應(yīng)的持有人制度��。歐盟雖設(shè)有代表�����、美國設(shè)有代理人�����,但是代表、代理人僅負(fù)責(zé)聯(lián)絡(luò)��、處理部分管理事項(xiàng)����,不承擔(dān)連帶責(zé)任,代表��、代理的設(shè)置也不能因此免除持有人的任何法律責(zé)任�����。
三����、關(guān)于我國 MAH 制度下境外持有人的境內(nèi)代理人的理論分析
3.1《民法典》中代理制度
根據(jù)《民法典》,所謂代理制度�����,是指代理人在代理權(quán)限范圍內(nèi)��,以被代理人的名義與第三人實(shí)施民事法律行為,對被代理人發(fā)生效力的民法制度�����。代理制度屬于私法自治的擴(kuò)張�����,使民事主體不僅可以利用自己的能力和知識參加民事活動�����,而且可以利用他人能力和知識進(jìn)行民事活動��,從而擴(kuò)張民事主體從事民事活動的范圍����,降低交易成本����,為民事主體更好地實(shí)現(xiàn)自己的權(quán)利、參與社會經(jīng)濟(jì)活動提供極大的便利[6]��。
依據(jù)代理權(quán)的取得方式��,代理分為委托代理和法定代理,委托代理又稱意定代理����、授權(quán)代理。委托代理是基于被代理人的授權(quán)行為����,授權(quán)行為本身是一個單方意思表示行為,其產(chǎn)生的基礎(chǔ)法律關(guān)系通常來源于委托合同����,也可能來源于勞動合同、合伙協(xié)議等�����。即委托代理關(guān)系和委托合同關(guān)系并不能直接畫等號��。
委托代理和委托合同關(guān)系的主要區(qū)別如下�����。①是否以被代理人或者委托人名義�����。委托代理中,代理人從事民事法律活動一般只能以被代理人的名義進(jìn)行�����,不得以自己的名義進(jìn)行����。代理行為的法律后果直接由被代理人承受。委托合同中��,受托人可以以自己的名義從事民事活動��,也可以以委托人的名義從事民事活動����,以誰的名義并不是問題的關(guān)鍵��。②從事行為范圍及涉及第三人����。委托代理中,經(jīng)授權(quán)的代理人僅能代理本人從事民事法律行為和準(zhǔn)法律行為�����。并且,代理人實(shí)施的行為通常涉及第三人��。委托合同中��,受托人既可以從事民事法律行為�����,也可以從事民事事實(shí)行為��。為處理委托事項(xiàng)����,受托人可能與第三人為某種法律行為,也可以僅處理某項(xiàng)事實(shí)行為[7]��。
3.2 我國 MAH 制度下境內(nèi)代理人的性質(zhì)��、資質(zhì)��、責(zé)任與權(quán)利分析
3.2.1 境內(nèi)代理人的性質(zhì)
從《藥品管理法》及《境外藥品上市許可持有人境內(nèi)代理人管理暫行規(guī)定》(征求意見稿)看�����,藥品境外持有人的境內(nèi)代理人主要協(xié)助境外持有人履行上市后管理義務(wù)����,包括年度報告�����、變更�����、上市后召回�����、投訴等�����,并不必然涉及注冊代理事項(xiàng)��,也不必然涉及銷售代理事項(xiàng)。這也說明境內(nèi)代理人本質(zhì)上是受到境外持有人的委托�����,履行上市后管理義務(wù)����,雙方之間屬于委托合同關(guān)系����。當(dāng)然����,境內(nèi)代理人在處理上市后管理事項(xiàng)時,可能需要以境外持有人的身份與藥品監(jiān)管部門聯(lián)絡(luò)����,此時可能需要得到境外持有人的單方授權(quán),繼而產(chǎn)生委托代理關(guān)系��。需要注意的是��,《民法典》中的代理制度不存在連帶責(zé)任之說�����,代理人以被代理人的名義與第三人實(shí)施民事法律行為����,法律后果直接歸屬于被代理人。所以����,藥品境外持有人與境內(nèi)代理人之間不是民法制度意義上的代理行為��,而是《藥品管理法》語境下的代理��,其名為境內(nèi)代理人�����,實(shí)則屬于境內(nèi)責(zé)任人��,需要履行藥事法律規(guī)章下規(guī)定的責(zé)任和義務(wù)����。
3.2.2 境內(nèi)代理人的資質(zhì)
根據(jù)藥事法律規(guī)章的規(guī)定��,境內(nèi)代理人需要履行藥品上市后管理義務(wù)����,與境外持有人承擔(dān)連帶責(zé)任。故理論上境內(nèi)代理人也應(yīng)當(dāng)需要具備質(zhì)量管理�����、風(fēng)險防控�����、責(zé)任承擔(dān)三大能力�����,建立與其代理工作相適應(yīng)的質(zhì)量保證體系����,如此方能更好地履行上市后管理義務(wù)?����!端幤饭芾矸▽?shí)施條例(征求意見稿)》規(guī)定境內(nèi)代理人應(yīng)當(dāng)向省級藥品監(jiān)督管理部門登記����,并未對境內(nèi)代理人增設(shè)行政許可。此舉符合“簡政放權(quán)�����、深化放管服”改革的總體趨勢�����,同時也要求境外持有人應(yīng)當(dāng)謹(jǐn)慎遴選、審計境內(nèi)代理人的資質(zhì)����,確保其具備履責(zé)的能力。相比于將境內(nèi)代理人在藥品注冊證書中載明�����,在藥品包裝����、標(biāo)簽、說明書中載明更有利于對外公告境內(nèi)代理人����、落實(shí)境內(nèi)代理人上市后管理職責(zé)。至于是在藥品批準(zhǔn)前或者藥品批準(zhǔn)后確定境內(nèi)代理人�����,理論上應(yīng)當(dāng)根據(jù)境外持有人開拓市場的能力和進(jìn)程選擇確定�����,當(dāng)然統(tǒng)一規(guī)定在藥品批準(zhǔn)前或者批準(zhǔn)后確定更便于國家藥品監(jiān)管部門對境內(nèi)代理人的統(tǒng)一管理。
3.2.3 境內(nèi)代理人的責(zé)任
關(guān)于境內(nèi)代理人承擔(dān)的責(zé)任��,包括積極責(zé)任和消極責(zé)任��。積極責(zé)任方面�����,前文已有描述��,主要涉及上市后管理義務(wù)����。消極責(zé)任方面�����,包括民事責(zé)任��、行政責(zé)任����、刑事責(zé)任。首先�����,在民事責(zé)任方面,主要涉及藥品缺陷致人損害的賠償責(zé)任����,境內(nèi)代理人應(yīng)當(dāng)與境外持有人對外承擔(dān)連帶責(zé)任,對內(nèi)可給予過錯責(zé)任追償�����。由于藥品責(zé)任風(fēng)險屬于典型的“長尾風(fēng)險”����,即從事故發(fā)生到發(fā)現(xiàn)損害后再提出索賠,可能經(jīng)歷幾年甚至幾十年的時間�����。這客觀上要求監(jiān)管者在制度設(shè)計上����,以及境內(nèi)代理人和境外持有人在內(nèi)部約定上,都需要考慮產(chǎn)品售后索賠����、追償?shù)仁马?xiàng)����。
其次��,在行政責(zé)任和刑事責(zé)任方面��,均不存在連帶之說法����。在行政責(zé)任方面����,境內(nèi)代理人應(yīng)當(dāng)履行藥事法律規(guī)章規(guī)定的責(zé)任和義務(wù),并承擔(dān)未履行義務(wù)可能造成的行政責(zé)任��。在刑事責(zé)任方面��,典型罪名為生產(chǎn)�����、銷售�����、提供假藥/劣藥罪,妨害藥品管理罪�����。其一��,生產(chǎn)��、銷售��、提供假藥/劣藥罪客觀方面表現(xiàn)為生產(chǎn)��、銷售��、提供假藥行為�����,若代理人未持有《藥品經(jīng)營許可證》則不可銷售所代理品種時����,談不上生產(chǎn)、銷售��、提供假藥/劣藥罪��;若代理人持有《藥品經(jīng)營許可證》可銷售所代理的品種,則可適用《中華人民共和國刑法》《藥品管理法》中銷售者相關(guān)規(guī)定��。其二��,針對妨害藥品管理罪����,若代理人未代辦理注冊事項(xiàng)��,則不會涉及提供虛假證明等騙取許可的妨害藥品管理罪情形����;若代理人代理注冊事項(xiàng),明知是提供虛假證明等騙取許可����,可能構(gòu)成妨害藥品管理罪的共犯,需要承擔(dān)相應(yīng)的刑事責(zé)任��。
再者�����,需要注意的是��,因境內(nèi)代理人設(shè)置的本質(zhì)是為了落實(shí)藥品上市后管理責(zé)任,同時避免由于持有人在境外追責(zé)難的問題�����,所以當(dāng)行政責(zé)任����、刑事責(zé)任涉及罰款、罰金時�����,可將境內(nèi)代理人設(shè)為處罰對象�����,由境內(nèi)代理人繳納罰款或者罰金��,此后境內(nèi)代理人可基于與境外持有人的委托合同約定進(jìn)行內(nèi)部追償��。
3.2.4 境內(nèi)代理人的權(quán)利
藥品是特殊的商品��?���!吨腥A人民共和國產(chǎn)品質(zhì)量法》第四十一條�����、四十二條規(guī)定產(chǎn)品存在缺陷造成人身����、缺陷產(chǎn)品以外的其他財產(chǎn)的損害��,生產(chǎn)者承擔(dān)無過錯賠償責(zé)任�����;銷售者承擔(dān)過錯賠償責(zé)任����。2009 年通過的《侵權(quán)責(zé)任法》【廢止】中增加了因藥品缺陷致人損害��,患者可以向醫(yī)療機(jī)構(gòu)請求賠償��,醫(yī)療機(jī)構(gòu)賠償后再向有責(zé)任的生產(chǎn)者追償�����。2019 年《藥品管理法》在賠償主體中增加了 MAH�����,同時規(guī)定境外持有人的境內(nèi)企業(yè)法人(境內(nèi)代理人)也應(yīng)當(dāng)承擔(dān)連帶責(zé)任。此時需要思考的是�����,若境內(nèi)代理人并非產(chǎn)品的銷售者��,也非持有人�����、生產(chǎn)者����、使用者(提供者),其不直接經(jīng)手產(chǎn)品����,不享有產(chǎn)品的銷售收益,讓其承擔(dān)民事連帶責(zé)任是否合理�����?當(dāng)然����,《藥品管理法》要求代理人承擔(dān)民事連帶責(zé)任更有利于保障患者的權(quán)益��。關(guān)于責(zé)權(quán)是否匹配的問題需要在后續(xù)制度設(shè)計或者境外持有人與代理人的約定中予以考量�����。
當(dāng)境內(nèi)代理人未持有《藥品經(jīng)營許可證》����,不得銷售代理的產(chǎn)品時�����,此種情形對現(xiàn)有藥品經(jīng)營制度的影響最小��。此時實(shí)際上沒有改變進(jìn)口產(chǎn)品銷售管理模式����,仍然由境外持有人在中國境內(nèi)設(shè)立的��、持有《藥品經(jīng)營許可證》的企業(yè)或者藥品流通企業(yè)擔(dān)任國內(nèi)銷售代理商��,負(fù)責(zé)產(chǎn)品進(jìn)口�����、銷售,同時增加了境外持有人的境內(nèi)代理人的這一角色��,需要境內(nèi)代理人建立質(zhì)量保證體系����,與國內(nèi)銷售代理商密切溝通,掌握產(chǎn)品上市后銷售流向�����,做好藥品上市后追溯��、藥物警戒�����、召回等事項(xiàng)��。此外�����,若允許未持有《藥品經(jīng)營許可證》的境內(nèi)代理人銷售代理產(chǎn)品,此時代理人類似于境內(nèi)持有人�����,若自行銷售代理的產(chǎn)品��,需要符合《藥品管理法》規(guī)定的經(jīng)營條件�����,若自行零售產(chǎn)品��,需要取得《藥品經(jīng)營許可證》����。此時需要考慮是否需要類似于對境內(nèi)持有人的管理,給境內(nèi)代理人發(fā)證的問題�����。
再者��,當(dāng)境內(nèi)代理人持有《藥品經(jīng)營許可證》可以銷售產(chǎn)品時����,還需要考慮境內(nèi)代理人與國內(nèi)分包裝廠的關(guān)系��。根據(jù) 2020 年 8 月國家藥監(jiān)局藥品審評中心發(fā)布的《境外生產(chǎn)藥品分包裝備案程序和要求》,進(jìn)口分包裝產(chǎn)品由注冊改為備案管理��,由境內(nèi)代理人向國家藥監(jiān)局備案�����,并不再核發(fā)藥品批準(zhǔn)文號����。此時,境外持有人能否自由選擇由境內(nèi)代理人或者國內(nèi)分包裝廠銷售產(chǎn)品也需要進(jìn)一步明確��。
四����、結(jié)語
境外持有人的境內(nèi)代理人管理是我國 MAH 制度下新增的一項(xiàng)規(guī)定,本質(zhì)上是為了契合以持有人為主線的藥品全生命周期管理����。通過落實(shí)境內(nèi)代理人的職責(zé),加強(qiáng)對境外持有人持有品種的管理�����,解決由于持有人在境外,監(jiān)管措施非常有限�����,獲取資料難��、查處難和追責(zé)難等問題����,更好地保障患者的權(quán)益。境內(nèi)代理人并非民法制度意義上的代理人��,而是《藥品管理法》語境下的代理人�����。境內(nèi)代理人與境外持有人在民事責(zé)任上連帶�����,行政和刑事責(zé)任則受到藥事法律規(guī)章的約束����。境內(nèi)代理人制度在設(shè)計中需要考慮境內(nèi)代理人責(zé)任和權(quán)利的匹配,以促進(jìn)境內(nèi)代理人制度更好地實(shí)施��。