摘 要: 微球屬于復雜的長效緩控釋注射劑�, 目前國內(nèi)外均無針對微球藥學研究的技術指南。分析國內(nèi)外微球上市及申報現(xiàn)狀發(fā)現(xiàn)���,無論是新藥還是仿制藥�,國內(nèi)微球藥學研究仍有待完善�����。本文結(jié)合藥品審評工作���,從釋放機制�����、處方工藝���、質(zhì)量控制等方面,提出微球藥學評價的特殊關注點�。
微球(microspheres)屬于長效注射劑的一種劑型,《中國藥典》2020 版四部通則 9014《微粒制劑指導原則》將其定義為藥物溶解或分散在載體輔料中形成的微小球狀實體,粒徑通常為幾微米到幾百微米[1]�����。 微球經(jīng)肌肉或皮下等途徑注射后,在注射部位形成藥物儲庫�,通過聚合物輔料的溶蝕、擴散�、降解等機制緩慢釋放藥物[2],可降低給藥頻率���,多開發(fā)用于需要長期用藥以及順應性較差 (如精神病患者)的患者�����。
微球制劑技術壁壘高�,處方工藝復雜�����,實現(xiàn)緩釋作用的關鍵輔料種類少�����,產(chǎn)業(yè)化難度大�����,微球生產(chǎn)的廠房�����、設備以及無菌控制等要求高�,使得藥物研發(fā)較為困難。 因此作為仿制藥開發(fā)的微球產(chǎn)品面臨與原研制劑保持質(zhì)量和療效一致性的巨大挑戰(zhàn)���。鑒于微球釋放周期長�, 體內(nèi)吸收和釋放行為復雜�,且關鍵輔料存在某些壟斷、質(zhì)量差異及批間穩(wěn)定性不確定等問題�, 加之專利保護等均增加了仿制難度。 目前 FDA 尚無微球類長效注射劑的仿制藥上市�;歐洲有部分微球仿制藥上市,如注射用醋酸奧曲肽微球�;國內(nèi)僅有北京博恩特藥業(yè)有限公司和上海麗珠制藥有限公司注射用醋酸亮丙瑞林微球(規(guī)格 3.75 mg)以及山東綠葉制藥有限公司的注射用利培酮微球(Ⅱ)上市。
微球制劑具有減少患者用藥次數(shù)���、 減輕醫(yī)療負擔的巨大優(yōu)勢�,市場發(fā)展空間巨大���,而我國微球制劑剛剛起步���, 因此微球制劑的開發(fā)與研究意義重大�。 2021 年 12 月 22 日工業(yè)和信息化部聯(lián)合 9部門印發(fā)《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》(工信部聯(lián)規(guī)〔2021〕217 號)�����,要求加快產(chǎn)品創(chuàng)新和產(chǎn)業(yè)化技術突破�����, 明確提出要強化對微球等復雜長效緩控釋制劑的關鍵核心技術攻關[3]���。 但現(xiàn)階段���,國內(nèi)外監(jiān)管機構(gòu)及行業(yè)協(xié)會均未發(fā)布微球制劑相關指導原則,對該類制劑的研發(fā)評價也缺少國際共識�。本文結(jié)合已上市微球的審評實踐,從釋放機制���、處方工藝�����、關鍵輔料�����、質(zhì)量控制等方面進行介紹���,旨在為微球藥學評價提供參考。
一���、 釋放機制
微球通過可生物降解的聚合物輔料實現(xiàn)緩釋作用���,其釋放機制包括:①聚合物表面溶蝕釋放出被物理包裹的藥物;②聚合物-藥物化學鍵斷裂���,經(jīng)擴散釋放藥物�����; ③藥物隨聚合物生物降解擴散釋放[4]���。微球體內(nèi)釋放行為復雜,通常為多種釋放機制共同作用���。 微球在體內(nèi)存在早期突釋���,后續(xù)穩(wěn)態(tài)釋放�,有些藥物還存在釋放停滯期�,微球釋放行為的復雜性與體內(nèi)微環(huán)境以及自身復雜的釋放機制相關。 一般認為水擴散進入微球�,微球表面以及表層藥物迅速溶解釋放,造成微球突釋�;之后,聚合物上孔隙通道不斷打開和關閉�����,加之藥物與聚合物之間的相互作用�����,共同決定了藥物后續(xù)釋放行為[5]�。
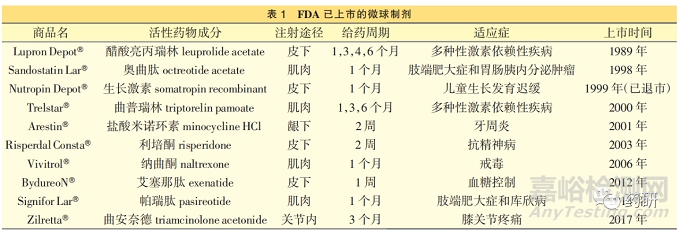
自 1989 年 FDA 批準首個注射用醋酸亮丙瑞林微球(商品名 Lupron Depot?)以來,全球共計有 10個微球類長效注射劑上市�,其中 Nutropin Depot?已退市,詳見表 1�。 這些微球制劑作為初始劑型開發(fā)的品種很少,目前上市的微球制劑均基于已上市的普通制劑(如片劑�、膠囊劑�、口服溶液���、注射劑)���,通過改變劑型和給藥途徑的方式獲批上市�����。
二�����、處方和工藝
應圍繞擬定適應癥�、用藥周期、用藥途徑���、血藥濃度范圍等進行微球制劑的開發(fā)�����, 優(yōu)選高包封率�、低突釋�����、載藥量適當?shù)奈⑶颉?應特別關注微球突釋帶來高血藥濃度的可接受性。 除理化指標的評價外�, 積累微球在動物和人體藥代動力學研究數(shù)據(jù),能夠加深對產(chǎn)品的理解�,有助于指導處方和工藝開發(fā),并建立微球理化指標和體內(nèi)行為的相關性���。
2.1 處方
目前上市的 9 種微球有 5 種為多肽類藥物�,4種為小分子化學藥物���。 微球的活性藥物成分(activepharmaceutical ingredient���,API) 通常具有較高的生物活性,如折算每日用藥量甚至為微克級���,從而確保少量藥物即可實現(xiàn)長效釋放���。 這主要是皮下(2 mL)或者肌肉注射(5 mL)給藥量有限。 微球制劑通常開發(fā)多種規(guī)格���,以滿足不同適應癥�����、給藥周期以及給藥劑量調(diào)整的需求�。 不同規(guī)格開發(fā)并不是簡單的處方等比例變化,甚至可能選擇不同的緩控釋輔料���。
微球制劑處方中最主要的緩控釋功能性輔料為聚合物���。 通過分析已上市品種發(fā)現(xiàn)�����,9 個微球品種共計 21 種規(guī)格���, 其中使用乙交酯丙交酯共聚物[poly(lactide-co-glycolide)�����,PLGA]作為緩控釋輔料的有 19 種���,使用乳酸聚合物(polylactic acid,PLA)的有 2 種���。 不同類型的聚合物在體內(nèi)降解和釋放速度不同�,且均可生物降解、安全性高�,非常適合作為微球的緩控釋輔料。
為保證藥物釋放行為一致���,絕大部分微球需配套專用溶劑�,按要求制備微球混懸液后給藥�。 其輔料除水外,還使用甘露醇���、氯化鈉等作為滲透壓調(diào)節(jié)劑�,羧甲基纖維素鈉(carboxymethyl cellulose-Na�,CMC-Na) 作為助懸劑, 以及非離子型表面活性劑(如吐溫�����、泊洛沙姆)���。 需針對適應癥�、給藥途徑、用藥劑量等�����,結(jié)合體內(nèi)外研究數(shù)據(jù)���,對微球及專用溶劑的處方合理性進行評估�����。 部分微球的混懸操作復雜���,而且也存在給藥劑量準確性的問題�����,建議在產(chǎn)品開發(fā)中對上述問題予以關注�����。為提高使用便利性�,部分產(chǎn)品改進為雙腔室的預充針或者開發(fā)為其他類型聚合物藥液直接給藥,減少了復雜的配伍操作�����。
2.2 生產(chǎn)工藝
目前,有多種工業(yè)化方法制備微球�,主要根據(jù)藥物性質(zhì)選擇適當?shù)闹苽浞椒ǎ▏婌F干燥法���、熱熔擠出法�、相分離法和乳化法等[6]�����。 建議參照 ICH Q8評價各個工序?qū)τ陉P鍵質(zhì)量屬性的影響�����,確認關鍵物料屬性�����、關鍵工藝參數(shù)及控制范圍�����。 通常將微球的包封率�����、載藥量、微球形態(tài)以及釋放度等關鍵質(zhì)量屬性作為工藝研究的考察指標�, 并根據(jù)不同生產(chǎn)工藝對可能影響微球質(zhì)量的指標進行針對性研究,如固化步驟對殘留溶劑的控制等�。
2.2.1 噴霧干燥法
該方法將含有藥物和聚合物的溶液、混懸液或者乳劑通過噴霧進入熱空氣的技術�。 隨著溶劑快速蒸發(fā),霧化液滴轉(zhuǎn)化為固體顆粒���。已上市的曲安奈德微球(商品名 Zilretta?)采用該工藝生產(chǎn)���。 噴霧干燥通常包括霧化、液滴與氣體混合���、溶劑揮發(fā)以及產(chǎn)品分離 4 個步驟�����。 其中霧化的工藝條件和參數(shù)對液滴粒徑分布起決定性作用,進而影響微球形態(tài)���,關鍵工藝參數(shù)包括噴嘴壓力�����、進料和空氣流量等[7]���。
2.2.2 熱熔擠出法
該方法工藝簡單���, 僅需將 API和聚合物混合后熱熔擠出、 粉碎�����。 已上市的微球Trelstar?和植入劑 Ozurdex?均采用此法制備[8]���。熱熔擠出可實現(xiàn)連續(xù)生產(chǎn)���,但是對熱敏感的原輔料在熱熔擠出過程中可能會降解。 該技術無需使用有機溶劑���,不存在去除溶劑固化的過程�,因而微球孔隙較少�,產(chǎn)品具有較高的包封率[9]。 建議關注熱熔擠出前物料混合的均勻性�����。 螺桿送料、攪拌�����、捏合�、高溫熔融等工序影響物料混合均勻性,冷卻�����、粉碎的工藝參數(shù)控制與微球形態(tài)相關���。 存在多晶型的藥物�,需考慮進行晶型控制的考察�。
2.2.3 乳化法
該方法是目前微球最常見的生產(chǎn)工藝。已上市產(chǎn)品 Lupron Depot?和 Risperdal Consta?等均采用乳化法制備�����。 根據(jù) API 的親脂性不同���,乳化法可選擇單乳法(O/W 法)或復乳法(初乳 W/O法�,復乳 W/O/W 法)���。 乳化法過程復雜�,通常需制備水相�����、藥物-聚合物均勻分散的有機溶劑相�����,將有機溶劑相緩慢加入水相中制備均一乳劑�����,之后通過溶劑替換/揮發(fā)等方法去除有機溶劑固化微球�����,隨即洗球�����,最終干燥制得成品�����。 乳化是形成微球形態(tài)的第一步; 固化和干燥過程中隨著溶劑不斷萃取和揮發(fā)�,溶解在有機溶劑中的聚合物會凝結(jié)固化,形成多孔結(jié)構(gòu)的微球[10]���。 兩相溶劑的選擇�����、乳化�、固化�����、洗球���、干燥等工藝參數(shù)的差異�,可能影響微球的載藥量���、形態(tài)等關鍵質(zhì)量屬性�����,進而影響藥物體內(nèi)行為�����。
2.2.4 相分離法
該方法通過將聚合物/藥物的混合溶液加入互不相溶的另一種溶劑體系中并不斷攪拌�����,聚合物隨著溶解度降低而發(fā)生相分離�����,進而固化形成微球[11]�。 已上市的注射用醋酸奧曲肽微球(商品名 Sandostatin Lar?)即采用相分離法�����。 微球固化的溶劑體系�����、攪拌速度���、溫度和時間影響微球成型以及特性�,后續(xù)干燥過程影響微球殘留的有機溶劑和水分。
2.3 緩控釋輔料 PLGA
PLGA 是目前已上市微球的主要緩釋聚合物輔料���。因此其質(zhì)控對微球質(zhì)量非常關鍵�����,可影響藥物體內(nèi)行為�。不同的生產(chǎn)工藝能夠制備分子量不同�����、端基類型���、丙交酯-乙交酯比例(L∶G 比例)和構(gòu)型各異的PLGA���,從而具備不同的理化性質(zhì)和釋放特性[12]。 因此有必要充分理解 PLGA 生產(chǎn)工藝�,如合成路線、合成條件等�。 上市許可持有人應強化 PLGA 生產(chǎn)商的審計以保障 PLGA 的連續(xù)供應。 另外�, 還應確定PLGA 合適的內(nèi)控標準和方法�, 積累多批次輔料研究數(shù)據(jù)�����,確保 PLGA 質(zhì)量穩(wěn)定可靠���。
建議結(jié)合生產(chǎn)工藝,重點關注 PLGA 結(jié)構(gòu)表征�����,如分子量及分布�����、L∶G 比例及乙醇酸嵌段�����、 封端結(jié)構(gòu)���、鏈型(直鏈���、多臂、星型等)等。 PLGA 釋放功能性相關指標包括特性粘度�、玻璃化轉(zhuǎn)變溫度(Tg)或熔融溫度(Tm)、殘留單體等�,這些指標是 PLGA 關鍵特性的反映。 其他與產(chǎn)品質(zhì)量相關的指標包括性狀�����、熾灼殘渣���、殘留溶劑�����、元素雜質(zhì)�、水分�、微生物負荷、細菌內(nèi)毒素�����、酸度���、堆密度�、粒徑、拉伸強度等���,建議結(jié)合微球質(zhì)量控制要求合理進行內(nèi)控�。
三���、質(zhì)量控制
除常規(guī)的性狀�����、鑒別、有關物質(zhì)�����、元素雜質(zhì)���、含量均勻度�����、可見異物�����、細菌內(nèi)毒素���、無菌以及含量等指標外�����, 微球制劑相關的質(zhì)控項目還包括載藥量�����、包封率�����、釋放度�、分子量及分布�、微球形態(tài)(外觀、粒徑及分布���、孔隙率�����、藥物分布狀態(tài))�、殘留溶劑、通針性���、混懸性等�����。
3.1 釋放度
微球通常采用多點法控制溶出���,一般包括早期表征突釋的、表征產(chǎn)品性能穩(wěn)定的以及表征釋放完全的時間點�。 為模擬藥物長期緩慢釋放,微球釋放度考察時間較長�,需要采用較為溫和的體外溶出方法,除常規(guī)藥典收載方法外�,還包括透析池法�����、轉(zhuǎn)瓶法�����、搖床法等�����。 需關注長期使用溶出介質(zhì)的無菌問題[13]。 釋放度方法應具備一定的區(qū)分力���,能夠適度區(qū)分可能影響微球釋放的關鍵物料屬性(如不同類型和降解程度的聚合物輔料)���、 關鍵工藝參數(shù)以及微球形態(tài)。
3.2 載藥量和包封率
這兩個指標是反映微球制劑中藥物含量的重要指標�����,與產(chǎn)品釋放密切相關�,是評價生產(chǎn)工藝成熟的標志,而且包封率可能影響樣品突釋�����,建議積累微球包封率和載藥量的研究數(shù)據(jù)���。 《中國藥典》2020 版《微粒制劑指導原則》規(guī)定考察上述兩個指標�����,其中包封率一般不得低于 80%�����,應根據(jù)藥物和聚合物的溶解性�, 合理選擇測定方法并進行驗證,如凝膠柱色譜法�、離心法或透析法等。
3.3 有關物質(zhì)
需關注原輔料自身降解以及相互作用雜質(zhì)的研究與控制���。 很多微球的 API 是多肽�, 如 LupronDepot?和 Sandostatin Lar?�。 研究表明多肽中親核性伯胺(例如 N 端和賴氨酸側(cè)鏈)與 PLGA 或其降解產(chǎn)物的羧酸端基相互作用,形成?;苌铮赡軐е禄钚越档蚚14]�。 部分微球采用終端工藝滅菌,需關注滅菌工藝下 API 和輔料的降解�,如濕熱滅菌下輔料 CMC-Na 可能降解產(chǎn)生小分子醛類雜質(zhì)。 此外���,PLGA 通過水解和自催化降解為乳酸和乙醇酸,降解產(chǎn)生的酸性產(chǎn)物可能形成高酸性的微環(huán)境[15]�����。 建議模擬體內(nèi)酸性環(huán)境,開展微球在酸性條件下的降解研究�,用于有關物質(zhì)方法的開發(fā)。
3.4 分子量及分布
由于水解和自催化降解�, 聚合物輔料在體內(nèi)存在不斷降解的趨勢。 因此建議微球考察聚合物的分子量及分布���。需關注穩(wěn)定性末期的分子量�����,結(jié)合穩(wěn)定性研究以及關鍵臨床若干批數(shù)據(jù)合理制定分子量及分布限度�。 以 PLGA 為例�,其分子量分布大,自催化降解速度快���,研究中需關注���。
3.5 微球形態(tài)
與微球形態(tài)相關的指標包括外觀、 粒徑及分布���、微球孔隙率以及微球中藥物分布狀態(tài)等�。 微球粒徑及分布對微球的通針性、分散性和釋放行為均有較大影響���。 粒徑檢測的技術手段相對比較成熟�����,除成像技術外�����,多采用激光散射法測定粒徑�。 通針性也是評價微球粒度的一種方法�,針頭尺寸小能夠降低患者注射時的疼痛感。 對于乳化法制備的微球而言���,有機溶劑從微球內(nèi)部向外遷移替換的過程中會形成大量孔隙���。 遷移過程中 API 可能隨有機溶劑向微球表面遷移。 孔隙率以及藥物分布狀態(tài)也可能對藥物早期釋放產(chǎn)生影響�����。 常見檢測微球形態(tài)的技術手段包括光學顯微鏡���、電子顯微鏡(透射電子顯微鏡���、掃描電子顯微鏡、聚焦離子束掃描電子顯微鏡)�����、X 射線顯微鏡���、 近紅外和拉曼光譜等�����。 微球孔隙率和藥物分布狀態(tài)的研究發(fā)展迅速���,有研究采用聚焦離子束掃描電子顯微鏡技術可全面了解微球的狀態(tài),包括粒徑及分布���、API 和聚合物分布�、孔隙率等���;還有研究嘗試建立基于微球形態(tài)的圖像定量指標和體外釋放特性的相關性[16]�。
3.6 殘留溶劑和水分
控制殘留溶劑不僅出于溶劑本身安全性的考慮, 還因微球內(nèi)部的殘留溶劑和水分可能與藥物�、聚合物輔料相互作用進而影響藥物體內(nèi)行為。 另外���,微球水分與聚合物輔料降解相關�,可能影響微球長期放置后的釋放行為�。
3.7 無菌和細菌內(nèi)毒素
聚合物通常不溶于水, 常規(guī)方法僅能檢測微球表面是否無菌和有無細菌內(nèi)毒素���,球內(nèi)無法檢測�。已有研究顯示[17]�����,可采用二甲亞砜為溶劑完全溶解微球后進行球內(nèi)無菌和細菌內(nèi)毒素檢查���。 應注意所選擇的檢測方法需經(jīng)適當?shù)姆椒▽W確認�, 特別關注稀釋溶劑對樣品檢測的干擾���。
3.8 與專用溶劑配伍
大部分微球使用前需采用專用溶劑配伍后給藥���,不存在按體積給藥的情況���。 微球混懸液通常具有一定的粘度,以保證皮下或肌肉注射后能夠迅速形成儲庫�����。 因此需關注使用相應給藥器具進行給藥的劑量準確性���。 另外,應考察藥液配伍后可能影響藥物釋放的混懸性�、粘度、pH�、滲透壓等理化指標。
四�����、思考
4.1 關鍵輔料產(chǎn)業(yè)發(fā)展
乙交酯�����、丙交酯類聚合物種類繁多�����,因其安全無毒、相容性良好�����,廣泛應用于可降解的醫(yī)療器械�、制劑載體等;蛋白質(zhì)類�����、肽類等藥物載體的研發(fā)也一直在進行�����。 我國“十四五”規(guī)劃相關要求有助于促進微球產(chǎn)業(yè)的發(fā)展�����,但是構(gòu)建微球等高端制劑產(chǎn)業(yè)鏈格局���,還需要加強配套關鍵輔料產(chǎn)業(yè)化的支持與保障�����,破除關鍵輔料“卡脖子”的窘境�。 國內(nèi)已有一些企業(yè)開展此類聚合物的研究與生產(chǎn),一些微球制劑企業(yè)也已自行生產(chǎn)聚合物輔料以確保穩(wěn)定供應���。此類聚合物生產(chǎn)工藝的控制較為復雜�����,不同批次間產(chǎn)品質(zhì)量可能會存在變化。 目前我國申報臨床或者已上市的微球制劑���, 仍有大部分選擇進口輔料 PLGA�。 高端輔料的發(fā)展仍是我國制藥行業(yè)的一大短板�,如何促進這類使用量小但質(zhì)量屬性關鍵的輔料發(fā)展,也是一項重要的系統(tǒng)工程�����。 建議一方面統(tǒng)籌各方力量�����,促進技術的轉(zhuǎn)化實施�����,解決質(zhì)量控制的難點;另一方面���,從審評角度明確微球與關鍵輔料評價的技術要求�,依托輔料關聯(lián)審評逐步建立微球質(zhì)量與關鍵輔料質(zhì)控的相關性�����,促進研發(fā)與審評有機結(jié)合���。
4.2 仿制藥藥學開發(fā)
微球注射于體內(nèi)后會引發(fā)體內(nèi)的系列應激反應�,加之微球本身復雜的釋放特性���,共同形成了微球仿制藥研發(fā)的技術堡壘�����。 就藥學角度而言���,應基于釋放機制加深處方和生產(chǎn)工藝對產(chǎn)品質(zhì)量影響的理解,努力建立產(chǎn)品特性和藥物釋放之間的關聯(lián)性���。建議加強對參比制劑藥學物質(zhì)基礎的研究�,如聚合物輔料的表征與控制、微球形態(tài)�����、微球含水量及殘留溶劑等�,結(jié)合體內(nèi)外釋放研究,充分了解參比制劑微球的特點���。從原輔料�����、工藝、包材以及微球特性���,開展全面的反向工程研究���,積極拓展新技術的使用。受限于專利保護���, 很多微球類仿制藥較難實現(xiàn)突破�。通過改變緩控釋輔料的類型從而改變釋放機制�����,或開發(fā)其他不同劑型的緩控釋制劑也是一種嘗試,如Camcevi?活性成分為亮丙瑞林���, 使用輔料 PLA 和N-甲基吡咯烷酮制備粘稠液體供皮下注射使用�����。