近日�����,美國(guó)FDA更新了“Requests for Feedback and Meetings for Medical Device Submissions: The Q-Submission Program”最終指導(dǎo)文件���。
本指導(dǎo)文件的目的是概述提交者可用的機(jī)制���,通過(guò)這些機(jī)制,他們可以申請(qǐng)以書(shū)面形式或在與美國(guó)食品藥品監(jiān)督管理局 (FDA)會(huì)議期間對(duì)以下潛在或計(jì)劃中的內(nèi)容請(qǐng)求反饋:
上市前批準(zhǔn) (PMA)申請(qǐng)
人道主義器械豁免 (HDE)
自動(dòng)III類指定的評(píng)估(De Nove請(qǐng)求)
上市前通告(510(k))提交
臨床實(shí)驗(yàn)室改進(jìn)修正案(CLIA)豁免申請(qǐng)(CW)
Dual 510(k)和CLIA豁免(Duals)申請(qǐng)
附件分類請(qǐng)求
提交給生物制品評(píng)估與研究中心(CBER)的某些研究性新藥申請(qǐng)(IND)
生物制劑許可申請(qǐng)(BLA)(特別是根據(jù)《公共衛(wèi)生服務(wù) (PHS) 法》第 351 條作為生物制品進(jìn)行監(jiān)管的器械 IND 和 BLA)
指導(dǎo)文件具體內(nèi)容如下:
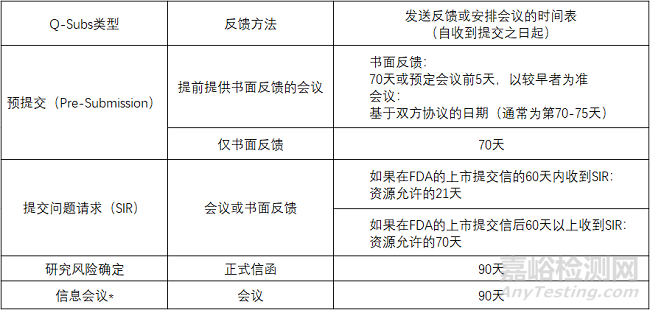
預(yù)提交(Pre-Subs)
預(yù)提交包括提交人對(duì)美國(guó)食品藥品監(jiān)督管理局反饋的正式書(shū)面請(qǐng)求��,該請(qǐng)求以正式書(shū)面回復(fù)的形式提供�����。
如果提交人有需要��,則以正式書(shū)面反饋的形式在會(huì)議后提供�����。會(huì)議期間發(fā)生的所有討論都記錄在會(huì)議紀(jì)要中�����,會(huì)議紀(jì)要由提交人起草并提交給FDA審查��。
提交問(wèn)題請(qǐng)求(SIRs)
SIRs是通過(guò)書(shū)面反饋或會(huì)議就解決上市提交保留函,CW保留函�����,IDE函或IND臨床保留函中傳達(dá)的問(wèn)題的擬議方法請(qǐng)求FDA反饋���。為了進(jìn)一步澄清SIRs的范圍���,以下是本指南中適用的上市提交保留函:
510(k)s、De Nove請(qǐng)求�����、CWs和DUALs所需的其他信息
重大缺陷��,不可批準(zhǔn)�����,可批準(zhǔn)缺陷�����,可批準(zhǔn)待GMP��,以及PMA和HDE的PAS條件批準(zhǔn)
生物制劑許可證申請(qǐng)(BLAs)的完整回復(fù)函
SIR旨在促進(jìn)FDA和提交者之間的互動(dòng)��,以快速解決這些信件中確定的問(wèn)題�����,從而使項(xiàng)目能夠向前推進(jìn)��,使提交者能夠在正式回復(fù)中充分解決懸而未決的問(wèn)題��。SIR可用于討論解決FDA信函中確定的問(wèn)題的計(jì)劃方法或策略��。然而��,SIR不應(yīng)用于要求FDA預(yù)先審查預(yù)期的正式回應(yīng)以評(píng)估充分性�����。
無(wú)論是否提交SIR���,提交者都應(yīng)在要求的時(shí)間表內(nèi)對(duì)FDA收到的任何信件做出正式回應(yīng)�����。
請(qǐng)注意�����,SIR不適合討論傳達(dá)最終決定的信件��,例如實(shí)質(zhì)上不等同��,撤回和刪除���。
研究風(fēng)險(xiǎn)確定
研究風(fēng)險(xiǎn)確定是指要求FDA確定計(jì)劃的醫(yī)療器械臨床研究為顯著風(fēng)險(xiǎn)(SR)�����,非顯著風(fēng)險(xiǎn)(NSR)還是適用免于IDE法規(guī)(21 CFR第812部分)定義的IDE法規(guī)�����。
對(duì)于不可豁免的研究���,制造商負(fù)責(zé)進(jìn)行初始風(fēng)險(xiǎn)確定(SR或NSR),并將其提交給機(jī)構(gòu)審查委員會(huì)(IRB)��。FDA為研究器械是SR還是NSR的最終仲裁者�����,并在IDE提交給FDA�����、運(yùn)營(yíng)商��、臨床研究者或IRB要求時(shí)做出決定�����。
信息會(huì)議
信息會(huì)議是要求與FDA分享信息�����,不需要反饋��。這種信息共享有助于概述正在進(jìn)行的器械開(kāi)發(fā)的情況(特別是在未來(lái)6-12個(gè)月內(nèi)計(jì)劃多次提交的情況下)�����,并使FDA審查小組熟悉新器械與當(dāng)前可用器械在技術(shù)上的顯著差異��。雖然FDA工作人員可能會(huì)在信息會(huì)議上提出澄清問(wèn)題���,但他們通常會(huì)在會(huì)議期間傾聽(tīng)�����,且不提供任何反饋���。
其他Q-Subs類型
除了上面列出的Q-Subs類型之外�����,Q-Subs還提供了一種機(jī)制來(lái)跟蹤其他FDA程序指導(dǎo)文件中描述的相互作用���。目前,除上述Q-Subs外��,Q-Subs程序中跟蹤的交互包括以下內(nèi)容:
PMA第100天會(huì)議
FDA指南中描述的協(xié)議和決定會(huì)議
FDA指南中描述的與突破性器械計(jì)劃相關(guān)的提交文件
FDA指南中描述的與更安全技術(shù)計(jì)劃(“STeP”)相關(guān)的提交文件
FDA指南中描述的附件分類請(qǐng)求
這些其他Q-Subs類型的政策和程序可以在各自的指導(dǎo)文件中找到���。
Q-Subs程序的其他用途
有些交互不符合上述Q-Subs類型的定義��,并且尚未為其創(chuàng)建新的正式Q-Subs類型�����。當(dāng)不存在新的Q-Subs類型來(lái)跟蹤特定類型的交互時(shí)���,F(xiàn)DA可以使用信息會(huì)議Q-Subs類型作為跟蹤這些交互的工具。
一般來(lái)說(shuō)�����,信息會(huì)議旨在提交人向FDA提供信息���,而不需要FDA的反饋�����。但是���,如果在尚未為該交互創(chuàng)建正式Q-Subs類型的情況下,將信息會(huì)議Q-Subs用于跟蹤目的��,則可以按照使用信息會(huì)議Q-Subs類型的程序的規(guī)定提供反饋���。
不在Q-subs計(jì)劃內(nèi)的交互
在Q-Subs計(jì)劃的范圍之外�����,還有其他幾種機(jī)制�����,行業(yè)可以通過(guò)這些機(jī)制從FDA獲得反饋���。有些需要或需要另一種形式的正式提交���,而有些可以通過(guò)非正式互動(dòng)來(lái)解決。
Q-Subs類型和相應(yīng)的反饋機(jī)制和時(shí)間表
Q-Subs流程
提交內(nèi)容
為確保正確登錄并便于審查Q-Sub���,Q-Sub申請(qǐng)書(shū)中應(yīng)包含以下內(nèi)容��。
聯(lián)系信息
Q-Sub類型
反饋方法
會(huì)議信息
為了從FDA獲得有意義的反饋���,應(yīng)在Q-Sub內(nèi)使FDA輕松識(shí)別以下內(nèi)容:
目的。Q-Sub的總體目標(biāo)包括與FDA互動(dòng)結(jié)果的目標(biāo)���。
器械或產(chǎn)品描述���。解釋器械的功能、構(gòu)成器械基礎(chǔ)的基本科學(xué)概念以及器械的重要物理和性能特征���。
建議的用途或預(yù)期用途指示�����。包括器械將診斷�����、治療���、預(yù)防、治愈或緩解的疾病或狀況的描述��,以及器械擬用于的患者人群的描述�����。
監(jiān)管歷史���。列出與FDA之前有關(guān)主題器械的任何相關(guān)通信�����,包括但不限于與主題Q-Sub相關(guān)的任何營(yíng)銷提交�����,IDE��,513(g)和/或Q-Sub申請(qǐng)?zhí)枴?/span>
強(qiáng)烈建議使用CDRH上市前審查提交封面提交給CDRH或CBER�����,以便于正確登錄并及時(shí)發(fā)送給適當(dāng)?shù)膶彶樾〗M�����。
您必須根據(jù)FD&C法案第745(A)(b)節(jié)提交Q-Sub的電子副本�����。
如果您要向CDRH提交���,我們建議通過(guò)CDRH客戶協(xié)作門(mén)戶(“CDRH Portal”)以電子方式提交eCopy提交包���。
一旦通過(guò)CDRH門(mén)戶提交,Q-Sub將由CDRH文件控制中心(DCC)接收�����?�;蛘撸峤话梢脏]寄到CDRH DCC��。CDRH DCC的當(dāng)前郵寄地址在醫(yī)療器械提交的eCopy計(jì)劃中提供�����。
對(duì)于受CBER監(jiān)管的產(chǎn)品��,我們建議通過(guò)FDA電子提交網(wǎng)關(guān)以電子方式提交提交包���。或者���,可以通過(guò)CBER提交電子郵件收件箱(最大150MB)提交��,或者通過(guò)郵件發(fā)送到CBER DCC���。
除了上述內(nèi)容,該指導(dǎo)文件中還提供了預(yù)提交(Pre-Sub)驗(yàn)收清單�����、會(huì)議紀(jì)要示例等���,幫助制造商更好地運(yùn)用Q-Sub的功能�����。