藥品全生命周期過程中����,藥學(xué)研究貫穿始終。自苗頭化合物誕生到先導(dǎo)化合物確定�����,再到候選藥物進入開發(fā)��,乃至上市�����,藥學(xué)研究工作由淺入深��,逐漸積累為產(chǎn)品的質(zhì)量可控��。這一過程中��,藥學(xué)變更工作勢必發(fā)生����。然而����,行業(yè)對于變更工作往往持消極態(tài)度����,通常不愿看到這一工作的發(fā)生,尤其怕觸碰重大變更�����。實際上����,變更過程可以對品種形成更深的認知,可以更好的支撐藥品的安全�����、有效�����、質(zhì)量可控����。特此�����,筆者基于藥品全生命周期的大背景,從原料藥開發(fā)的角度出發(fā)�����,來匯總國內(nèi)有關(guān)變更工作的階段特點和研究內(nèi)容�����。
藥品生命周期-藥學(xué)原料藥研究工作
藥品生命周期��,依據(jù)ICH指導(dǎo)原則中的定義為“一個產(chǎn)品從開始研發(fā)到上市��,直至產(chǎn)品終止上市的整個過程”�����。藥品生命周期不僅僅是一個時間上的概念�����,更多的是在這條時間線上所形成的的系統(tǒng)的研究工作和全方位的管理����。
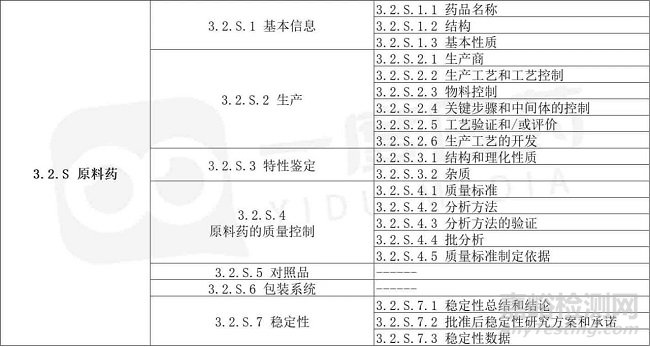
藥學(xué)研究,是藥品生命周期過程中非常重要的組成之一�����,這部分的工作大方向可分為原料藥和制劑兩部分�����,即“S”和“P”。原料藥�����,定義為“是可與輔料一起生產(chǎn)制劑的未經(jīng)配方的藥物”��,其研究過程貫穿藥品全生命周期�����?����?梢苑Q之為原料藥的物質(zhì)��,通常是已經(jīng)經(jīng)歷了早期的成藥評價、并進入到藥學(xué)開發(fā)的化學(xué)物質(zhì)��。當(dāng)進入到開發(fā)工作程序中��,其具體研究工作可參照ICH M4中2.3.S和3.2.S的具體內(nèi)容。
ICH-M4-3.2.S內(nèi)容列表
原料藥-藥學(xué)變更簡介
從發(fā)現(xiàn)到開發(fā)�����,再到上市,藥品研發(fā)必然伴隨大量的藥學(xué)變更��?����;诖?�,無論是全球大范圍的ICH指導(dǎo)原則,還是國內(nèi)相關(guān)藥政法規(guī)��,都對藥學(xué)變更進行了大量解釋說明�����,以指導(dǎo)行業(yè)開展變更相關(guān)的研究工作����。
ICH指導(dǎo)原則“變更”內(nèi)容
ICH-Q8,關(guān)于變更的表述為“在設(shè)計空間內(nèi)的變動����,在監(jiān)管上不被視為變更。而一旦超出設(shè)計空間,則應(yīng)視為變更����,并應(yīng)啟動上市后的變更申請。設(shè)計空間由申報者提出��,送交管理當(dāng)局”��?���?梢?���,ICH-Q8清楚的劃分了變更的界限。
ICH-Q12��,明確了CTD申報資料中的既定條件��,即“確保產(chǎn)品質(zhì)量所必需的�����、具有法律約束力的信息”�����。清楚的劃分了申報資料中的藥學(xué)變更范圍����。并在其他指導(dǎo)原則的基礎(chǔ)上����,側(cè)重于產(chǎn)品開發(fā)的后半段-商業(yè)化過程,對生產(chǎn)質(zhì)量相關(guān)內(nèi)容進行了進一步的細化和強化����。
CDE-ICH指導(dǎo)原則Q8-Q12
國內(nèi)相關(guān)法規(guī)&指導(dǎo)原則
《藥品注冊管理辦法》(2020年1月22日國家市場監(jiān)督管理總局令第27號公布)第十一條規(guī)定:“變更原藥品注冊批準證明文件及其附件所載明的事項或者內(nèi)容的,申請人應(yīng)當(dāng)按照規(guī)定��,參照相關(guān)技術(shù)指導(dǎo)原則�����,對藥品變更進行充分研究和驗證�����,充分評估變更可能對藥品安全性��、有效性和質(zhì)量可控性的影響����,按照變更程序提出補充申請、備案或者報告”��。
第二十九條規(guī)定:“藥物臨床試驗期間����,發(fā)生藥物臨床試驗方案變更、非臨床或者藥學(xué)的變化或者有新發(fā)現(xiàn)的�����,申辦者應(yīng)當(dāng)按照規(guī)定����,參照相關(guān)技術(shù)指導(dǎo)原則�����,充分評估對受試者安全的影響��。申辦者發(fā)生變更的����,由變更后的申辦者承擔(dān)藥物臨床試驗的相關(guān)責(zé)任和義務(wù)”。
第四十條規(guī)定:“藥品上市許可申請審評期間��,發(fā)生可能影響藥品安全性����、有效性和質(zhì)量可控性的重大變更的,申請人應(yīng)當(dāng)撤回原注冊申請��,補充研究后重新申報��。申請人名稱變更����、注冊地址名稱變更等不涉及技術(shù)審評內(nèi)容的��,應(yīng)當(dāng)及時書面告知藥品審評中心并提交相關(guān)證明性資料”����。
第七十七條規(guī)定:“藥品上市后的變更,按照其對藥品安全性����、有效性和質(zhì)量可控性的風(fēng)險和產(chǎn)生影響的程度����,實行分類管理��,分為審批類變更�����、備案類變更和報告類變更”����。
第七十八條規(guī)定:“以下變更,持有人應(yīng)當(dāng)以補充申請方式申報��,經(jīng)批準后實施:(一)藥品生產(chǎn)過程中的重大變更����;(二)藥品說明書中涉及有效性內(nèi)容以及增加安全性風(fēng)險的其他內(nèi)容的變更����;(三)持有人轉(zhuǎn)讓藥品上市許可;(四)國家藥品監(jiān)督管理局規(guī)定需要審批的其他變更”�����。
除以上國家市場監(jiān)督管理總局發(fā)布的《藥品注冊管理辦法》外,針對各種變更情況�����,還在相應(yīng)的指導(dǎo)原則中進行了細化��。化藥方面��,主要為《創(chuàng)新藥(化學(xué)藥)臨床試驗期間藥學(xué)變更技術(shù)指導(dǎo)原則(試行)》�����、《已上市化學(xué)藥品生產(chǎn)工藝變更研究技術(shù)指導(dǎo)原則》�����、《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》��、《化學(xué)藥品變更受理審查指南(試行)》等����。以下將根據(jù)藥品研發(fā)的邏輯順序,對其過程中的變更進行階段性介紹和重點研究內(nèi)容匯總����。
臨床期間-原料藥藥學(xué)變更研究特點
創(chuàng)新藥藥學(xué)研究具有漸進性�����、階段性和不確定性特點��,其研究的廣度和深度伴隨臨床試驗的進展不斷推進�����。
基于以上研發(fā)規(guī)律,由于創(chuàng)新藥不同研究階段的藥學(xué)研究目標(biāo)不同�����,決定了研究進程中必然伴隨著大量藥學(xué)變更�����。藥學(xué)變更可能會在臨床樣品中引入質(zhì)量風(fēng)險�����,進而可能對受試者安全性和(或)臨床試驗結(jié)果的科學(xué)性造成影響,故需全面審慎地評估變更引入的質(zhì)量風(fēng)險并開展相關(guān)研究��,以支持這些變更應(yīng)用于臨床樣品的制備����。
在進行藥學(xué)變更研究時�����,首先需明確變更的原因�����、變更的事項和變更的程度����,然后結(jié)合品種特點和具體的變更內(nèi)容�����,基于風(fēng)險評估的思路�����,評估變更對藥品質(zhì)量、臨床試驗受試者安全性����、臨床試驗結(jié)果科學(xué)性的可能影響,在此基礎(chǔ)上判斷變更為重大變更還是一般變更��,并開展相應(yīng)的研究工作����,評估變更的可行性�����。
根據(jù)藥學(xué)變更對臨床受試者安全性����、臨床試驗結(jié)果科學(xué)性影響的可能性大小��,可將臨床期間的藥學(xué)變更分為重大變更和一般變更����。重大變更是指經(jīng)評估可能顯著影響臨床樣品的質(zhì)量��,進而可能對臨床試驗受試者的安全性或臨床試驗結(jié)果的科學(xué)性產(chǎn)生明顯影響的變更。申請人應(yīng)當(dāng)審慎地評估此類變更帶來的風(fēng)險��,并開展相關(guān)研究��,以支持變更應(yīng)用于臨床試驗樣品的制備�����。一般變更是指經(jīng)評估可能對臨床樣品的質(zhì)量、臨床試驗的安全性以及試驗結(jié)果的科學(xué)性無明顯影響的變更����,申請人可酌情開展相關(guān)研究。
申請人評估認為可能增加受試者安全性風(fēng)險的變更,應(yīng)當(dāng)按《藥品注冊管理辦法》提出補充申請����,認為不影響受試者安全的,可以直接實施并在研發(fā)期間安全性更新報告中報告��。具體變更范疇及重點示例如下表所示�����。
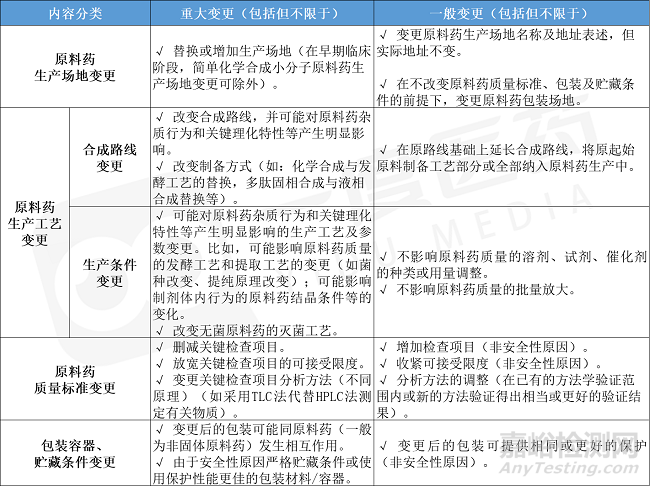
表3-1 原料藥-藥學(xué)變更舉例
(注:原料藥變更主要關(guān)注“關(guān)鍵理化性質(zhì)”&“雜質(zhì)行為”)
上市后-原料藥藥學(xué)變更研究特點
對于已上市化學(xué)原料藥����,根據(jù)變更對藥品安全性��、有效性和質(zhì)量可控性產(chǎn)生影響的風(fēng)險��,國內(nèi)指導(dǎo)原則對所述及的變更分為3類:重大變更�����、中等變更�����、微小變更��。持有人/登記企業(yè)完成研究工作后,按照《藥品管理法》��、《藥品注冊管理辦法》��、《藥品生產(chǎn)監(jiān)督管理辦法》�����、《藥品上市后變更管理辦法(試行)》的規(guī)定�����,通過補充申請��、備案或者年度報告實施各項變更�����。
變更原料藥生產(chǎn)工藝
一般包括變更合成路線(如延長/縮短合成路線�����,變更起始原料等)、變更生產(chǎn)條件�����、變更物料控制/過程控制及其它可能的變更����。
對于原料藥��,當(dāng)對比研究結(jié)果符合以下條件時��,則可認為雜質(zhì)譜一致:①新增雜質(zhì)未高于《化學(xué)藥物雜質(zhì)研究的技術(shù)指導(dǎo)原則》及ICH Q3A等規(guī)定的鑒定限度����;②已有雜質(zhì)(包含立體異構(gòu)體)及雜質(zhì)總量均在質(zhì)量標(biāo)準規(guī)定的限度內(nèi)����,如標(biāo)準中無規(guī)定,應(yīng)在原工藝生產(chǎn)的多批產(chǎn)品測定范圍內(nèi)��;③新使用的溶劑殘留量符合《化學(xué)藥物有機溶劑殘留量研究的技術(shù)指導(dǎo)原則》及ICHQ3C等的有關(guān)規(guī)定����;④新的無機雜質(zhì)符合《化學(xué)藥物雜質(zhì)研究的技術(shù)指導(dǎo)原則》及ICHQ3D等的有關(guān)要求����。⑤應(yīng)參考ICH M7對致突變雜質(zhì)進行考察,必要時進行控制����。
已上市品種-變更原料藥生產(chǎn)工藝
變更生產(chǎn)批量
生產(chǎn)批量變更是指在原批準批量(如關(guān)鍵臨床試驗批、BE批等)基礎(chǔ)上擴大或縮小生產(chǎn)批量����。如變更生產(chǎn)批量的同時��,其工藝參數(shù)�����、生產(chǎn)設(shè)備等發(fā)生變更��,需進行關(guān)聯(lián)變更研究��。
對此�����,微小變更和中等變更的主要分界點是“10倍”����。原料藥的生產(chǎn)批量變更在原批準批量的10倍以內(nèi)(包括10倍)��,屬微小變更��;10倍以上��,屬中等變更����。
變更注冊標(biāo)準
變更藥品注冊標(biāo)準一般包括變更原料藥注冊標(biāo)準中的檢驗項目��、檢驗方法����、限度等��。藥品注冊標(biāo)準變更可能只涉及上述某一種情況的變更����,也可能涉及上述多種情況的變更�����。一般而言�����,變更原料藥注冊標(biāo)準不應(yīng)引起藥品質(zhì)量控制水平的降低�����。
變更藥品注冊標(biāo)準尚需考慮是否會影響到藥品的有效期��,如對標(biāo)準進行了提高(例如收緊限度��、增加檢驗項目�����、優(yōu)化檢測方法等)����,需考察在原定的有效期內(nèi)�����,藥品是否符合修訂后質(zhì)量標(biāo)準的要求�����。對于隨國家藥品標(biāo)準變更而引起的注冊標(biāo)準變更��,可參照相關(guān)公告要求執(zhí)行(如�����,國家藥品監(jiān)督管理局關(guān)于實施《中華人民共和國藥典》有關(guān)事宜的公告)����。
中等變更�����,包括但不限于1)新增檢驗項目����,應(yīng)可以更有效地控制產(chǎn)品質(zhì)量����;2)在原標(biāo)準規(guī)定范圍內(nèi)收緊限度
重大變更,包括但不限于1)變更檢驗方法��;2)放寬控制限度��;3)刪除注冊標(biāo)準中的任何項目��。
變更有效期和貯藏條件
藥品有效期和貯藏條件變更可能包含以下幾種情況:1)延長有效期��;2)縮短有效期����;3)嚴格貯藏條件;4)放寬貯藏條件��。
中等變更����,包括但不限于以下情形:1)延長藥品有效期��。有效期變更主要依據(jù)長期穩(wěn)定性試驗結(jié)果�����。延長藥品有效期不應(yīng)超過長期穩(wěn)定性試驗已完成的時間��。2)縮短藥品有效期�����。此類變更不包括因藥品的生產(chǎn)或穩(wěn)定性出現(xiàn)問題而要求縮短藥品有效期����。
重大變更,包括但不限于以下情形:1)變更藥品貯藏條件�����。2)由于藥品的生產(chǎn)工藝、處方�����、質(zhì)量標(biāo)準��、直接接觸藥品的包裝材料和容器等方面的變更導(dǎo)致的有效期變更�����。
變更生產(chǎn)場地
生產(chǎn)場地變更����,包括生產(chǎn)地址的改變或新增����,或同一生產(chǎn)地址內(nèi)的生產(chǎn)場地的新建����、改建�����、擴建��。
變更原料藥生產(chǎn)場地:1)在同一生產(chǎn)地址內(nèi)變更非無菌原料藥或無菌原料藥的非無菌生產(chǎn)步驟的生產(chǎn)場地,同時變更前后的生產(chǎn)設(shè)備����、操作規(guī)程、環(huán)境條件(比如溫度和濕度)��、質(zhì)量控制過程和人員素質(zhì)等方面一致����。2)同一生產(chǎn)地址內(nèi)變更無菌原料藥無菌生產(chǎn)步驟的生產(chǎn)場地����,或者原料藥的生產(chǎn)地址變更至另一不同生產(chǎn)地址��。
國內(nèi)藥學(xué)變更受理方式
參照國內(nèi)發(fā)布的《化學(xué)藥品變更受理審查指南(試行),變更資料的受理方式主要按照《藥品注冊管理辦法》��、《藥品上市后變更管理辦法(試行)》及《已上市化學(xué)藥品變更事項及申報資料要求》等規(guī)定�����,提供符合要求的申報資料��。這里想重點強調(diào)下“申報資料審查要點”中的“證明性文件”��,這塊的內(nèi)容在日常工作中息息相關(guān),特此列表如下����。
變更受理-證明性文件內(nèi)容
階段總結(jié)
以上,即為國內(nèi)當(dāng)前藥學(xué)研究原料藥變更工作相關(guān)的階段特點����、研究內(nèi)容和監(jiān)管要求�����。從其階段性過程可以看出,監(jiān)管部門對變更的管控是在逐漸收緊����,一定程度上允許早期藥學(xué)研究的淺顯��,但隨著產(chǎn)品逐漸走向商業(yè)化��,尤其是在進入到關(guān)鍵臨床試驗階段及其后的市場化進程��,藥學(xué)變更工作就需要詳細的研究排查����,以保證藥品的安全��、有效��、質(zhì)量可控����。實際上�����,藥學(xué)變更是藥品研發(fā)過程中所必然經(jīng)歷的一道程序,研究者在正確看待這件事情的同時����,更需要充分利用好這一過程,從而為藥學(xué)研究打下夯實的基礎(chǔ)�����,以避免后期生產(chǎn)中潛在的風(fēng)險��,繼而提升產(chǎn)品的自身質(zhì)量以及過程中的周期管理��。
參考:
1.ICH指導(dǎo)原則
2.CDE官網(wǎng)信息
3.NMPA官網(wǎng)信息
4.CNKI文獻
5.《藥品管理法》
6.《藥品注冊管理辦法》
7.《藥品生產(chǎn)監(jiān)督管理辦法》
8.《藥品上市后變更管理辦法(試行)》
9.《創(chuàng)新藥(化學(xué)藥)臨床試驗期間藥學(xué)變更技術(shù)指導(dǎo)原則(試行)》
10.《已上市化學(xué)藥品生產(chǎn)工藝變更研究技術(shù)指導(dǎo)原則》
11.《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》
12.《化學(xué)藥品變更受理審查指南(試行)》
13.《中華人民共和國藥典》