目的:建立某高風(fēng)險(xiǎn)注射劑生產(chǎn)企業(yè)制藥用水系統(tǒng)微生物數(shù)據(jù)庫(kù),為企業(yè)制藥用水系統(tǒng)污染微生物的有效控制和溯源調(diào)查提供指導(dǎo)����。
方法:連續(xù)4個(gè)季度對(duì)某大容量注射劑生產(chǎn)企業(yè)的純化水系統(tǒng)和注射用水系統(tǒng)監(jiān)控收集微生物,采用基于16S rRNA 和ITS rDNA 序列比對(duì)等方法鑒定污染微生物��,結(jié)合微生物種屬和來(lái)源信息進(jìn)行分析�����,建立企業(yè)制藥用水系統(tǒng)的微生物菌庫(kù)�����。
結(jié)果:共分離鑒定1499 株細(xì)菌和20株真菌��,注射用水系統(tǒng)和純化水系統(tǒng)的微生物分別占比9.0%和91.0%����。純化水系統(tǒng)中鞘氨醇單胞菌和甲基桿菌最多����,分別占全部分離菌的28.9%和25.2%。注射用水系統(tǒng)中葡萄球菌和微球菌較多�����,分別占全部收集菌的24.9%和18.2%。純化水系統(tǒng)中污染的微生物主要為革蘭氏陰性菌����,占污染微生物總數(shù)的67.0%。注射用水系統(tǒng)中污染的微生物主要為革蘭氏陽(yáng)性菌��,占污染微生物總數(shù)的60.3%��。制藥用水系統(tǒng)中較為常見(jiàn)的真菌為雜色曲霉菌和產(chǎn)黃青霉��。此外�����,經(jīng)分析發(fā)現(xiàn)����,純化水系統(tǒng)的微生物在第二季度和第三季度數(shù)量占比較多,占全年微生物總量67.8%����,第一季度和第四季度微生物數(shù)量則下降;注射用水系統(tǒng)微生物數(shù)量則在第二季度較多�����,其余3個(gè)季節(jié)數(shù)量差不多。
結(jié)論:建立制藥用水系統(tǒng)微生物菌庫(kù)可指導(dǎo)制藥用水系統(tǒng)的運(yùn)行維護(hù)及消毒滅菌����,同時(shí)也為高風(fēng)險(xiǎn)藥品生產(chǎn)企業(yè)的微生物污染事件提供溯源調(diào)查基礎(chǔ)。
制藥用水是藥品生產(chǎn)過(guò)程中使用量最大最廣的一種原料��,尤其是注射劑生產(chǎn)企業(yè)使用的注射用水�����,會(huì)通過(guò)注射直接進(jìn)入人體��,直接影響患者的安全[1]�����。制藥用水的制備�����、儲(chǔ)存和分配系統(tǒng)是藥品生產(chǎn)的關(guān)鍵系統(tǒng)��,《藥品生產(chǎn)質(zhì)量管理規(guī)范》(GMP)規(guī)定藥品生產(chǎn)企業(yè)應(yīng)根據(jù)監(jiān)控計(jì)劃對(duì)制藥用水的微生物負(fù)載等指標(biāo)進(jìn)行監(jiān)測(cè)�����,并通過(guò)年度質(zhì)量回顧工作分析制藥用水是否持續(xù)處于穩(wěn)定�����、受控狀態(tài)�����。隨著新版GMP 的實(shí)施����,各制藥企業(yè)開(kāi)始關(guān)注制藥用水系統(tǒng)的風(fēng)險(xiǎn)控制,尤其是水中微生物的控制����。因?yàn)樗到y(tǒng)中的微生物可浮游或黏附于管道和儲(chǔ)罐的內(nèi)壁等部位,并能大量繁殖形成生物膜�����,可以持續(xù)釋放微生物從而形成持久的污染源��,同時(shí)生物膜也是形成內(nèi)毒素的主要原因[2]����。
微生物檢測(cè)是評(píng)價(jià)制藥用水是否合格的重要指標(biāo)��,微生物指標(biāo)的檢測(cè)與控制是一項(xiàng)必要而復(fù)雜的工作[3-4]����。尤其針對(duì)高風(fēng)險(xiǎn)無(wú)菌藥品生產(chǎn)企業(yè)��,通過(guò)對(duì)制藥用水系統(tǒng)的微生物進(jìn)行系統(tǒng)科學(xué)的收集和分析�����,采用合適的鑒定手段對(duì)制藥用水正常狀態(tài)下微生物進(jìn)行調(diào)研�����,可以幫助生產(chǎn)企業(yè)更好地對(duì)日常制藥用水系統(tǒng)運(yùn)行及消殺情況進(jìn)行評(píng)價(jià)��,也可以進(jìn)一步指導(dǎo)制藥用水系統(tǒng)的滅菌�����、消毒和清潔[5-6]��。建立的制藥用水系統(tǒng)微生物菌庫(kù)也可為基于微生物和藥品特性分析風(fēng)險(xiǎn)等級(jí)收集的藥品生產(chǎn)環(huán)境菌庫(kù)奠定數(shù)據(jù)基礎(chǔ)����,幫助藥品中污染微生物進(jìn)行溯源調(diào)查。
1��、材料
1.1儀器
ME2002E 電子天平(瑞士梅特勒-托利多公司)�����;MLS-3781-PC 高壓蒸汽滅菌器(日本三洋公司)����;生物安全柜(力康生物醫(yī)療科技控股有限公司);SF450滅菌箱����、IF450 恒溫培養(yǎng)箱、ICP55 低溫培養(yǎng)箱均來(lái)自德國(guó)Memmert��;HTY-2000B 型集菌儀��、FC502 一次性使用集菌培養(yǎng)器均來(lái)自杭州泰林生物技術(shù)設(shè)備有限公司��;ABI3730-XL 測(cè)序儀(美國(guó)ABI 公司)����。
1.2培養(yǎng)基
胰酪大豆胨瓊脂培養(yǎng)基(TSA ����, 批號(hào):1064583)����、R2A 瓊脂培養(yǎng)基(批號(hào):1061327)均由廣東環(huán)凱微生物科技有限公司提供;以上培養(yǎng)基適用性檢查均符合中國(guó)藥典2015 年版規(guī)定[7]����。
2、方法與結(jié)果
2.1制藥用水系統(tǒng)微生物的收集
本研究連續(xù)4 個(gè)季度對(duì)某大容量注射劑無(wú)菌藥品生產(chǎn)企業(yè)純化水的各分配系統(tǒng)總供水點(diǎn)��、回水點(diǎn)����、使用點(diǎn)和注射用水系統(tǒng)供水點(diǎn)、各車(chē)間回水點(diǎn)及使用點(diǎn)進(jìn)行取樣��,按照中國(guó)藥典2015 年版純化水標(biāo)準(zhǔn)進(jìn)行微生物限度檢查�����。純化水的各分配系統(tǒng)總供水點(diǎn)��、回水點(diǎn)每天取樣檢測(cè)��,各使用點(diǎn)每月取樣檢測(cè)����;注射用水系統(tǒng)供水點(diǎn)、各車(chē)間回水點(diǎn)每天取樣檢測(cè)�����,各使用點(diǎn)每月取樣檢測(cè)��。
2.2制藥用水系統(tǒng)微生物的分離和保存
一共收集獲得1 499 株細(xì)菌和20 株真菌�����,對(duì)收集的微生物進(jìn)行復(fù)蘇分離純化�����,復(fù)蘇培養(yǎng)基采用TSA 和R2A 瓊脂培養(yǎng)基����,采用磁珠保存管置−70 ℃冰箱保存。部分無(wú)法復(fù)蘇的菌株采用直接單個(gè)純菌落鑒定�����。
2.3細(xì)菌16S rDNA 全長(zhǎng)測(cè)序及真菌ITS rDNA 測(cè)序鑒定
對(duì)制藥用水系統(tǒng)收集獲得的1 499 株細(xì)菌及20 株真菌分別采用測(cè)序儀進(jìn)行細(xì)菌16S rDNA 和真菌ITS rDNA 測(cè)序鑒定。本研究比對(duì)的數(shù)據(jù)庫(kù)包含NCBI-Fungi 和NCBI-Bacteria(同源性>98.65%判定為同一種微生物[8])�����。
2.4制藥用水系統(tǒng)微生物污染分析
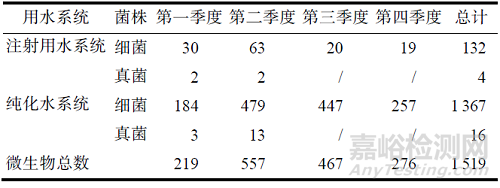
本次通過(guò)4 個(gè)季度連續(xù)收集到制藥用水系統(tǒng)微生物菌株共計(jì)1 519 株����,包括1 499 株細(xì)菌和20株真菌。其中132 株細(xì)菌來(lái)源于注射用水系統(tǒng)�����,1 367 株細(xì)菌來(lái)源于純化水系統(tǒng)����;4 株真菌來(lái)源于注射用水系統(tǒng),16 株真菌來(lái)源于純化水系統(tǒng)����。來(lái)源于注射用水系統(tǒng)的微生物占比9.0%,來(lái)源于純化水系統(tǒng)的微生物占比91.0%��。整個(gè)制藥用水系統(tǒng)細(xì)菌占比98.7%����,真菌占比1.3%。結(jié)果見(jiàn)表1��。
表1 菌株數(shù)統(tǒng)計(jì)
2.5隨季節(jié)微生物污染變化
純化水系統(tǒng)的微生物在第二季度和第三季度數(shù)量占比較多��,占全年微生物總量67.8%��,第一季度和第四季度微生物數(shù)量則下降��;注射用水系統(tǒng)微生物數(shù)量則在第二季度較多�����,其余三個(gè)季節(jié)數(shù)量都差不多����。結(jié)果見(jiàn)表1。這可能和溫度��、濕度等季節(jié)性因素存在關(guān)聯(lián)�����。也有報(bào)道顯示��,在豐水期制藥用水系統(tǒng)管路內(nèi)檢出革蘭氏陰性菌比例上升,提示在這些時(shí)期需注意水系統(tǒng)管路等清潔消毒是否到位�����。
2.6制藥用水系統(tǒng)微生物菌庫(kù)的建立和分析
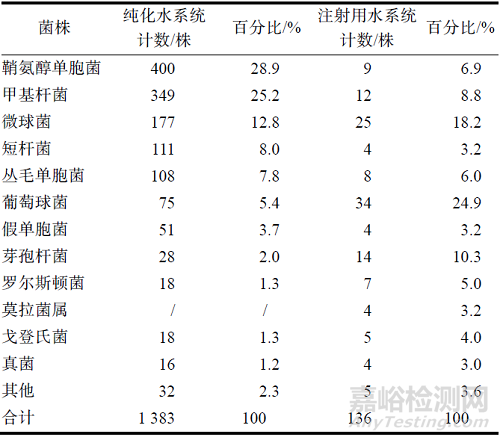
從制藥用水系統(tǒng)收集的1 519 株微生物的測(cè)序鑒定結(jié)果統(tǒng)計(jì)見(jiàn)表2����。純化水系統(tǒng)中鞘氨醇單胞菌和甲基桿菌最多,分別占全部分離菌的28.9%和25.2%����;其次為微球菌、短桿菌和叢毛單胞菌����,分別占全部收集菌的12.8%,8.0%和7.8%�����。注射用水系統(tǒng)中葡萄球菌和微球菌較多�����,分別占全部收集菌的24.9%和18.2%�����;其次為芽孢桿菌和甲基桿菌,分別占全部分離菌的10.3%和8.8%����。本研究通過(guò)對(duì)4 個(gè)季度收集的制藥用水微生物的測(cè)序鑒定結(jié)果進(jìn)行整理和分析��,初步建立了制藥用水微生物菌庫(kù)����。
表2 制藥用水系統(tǒng)微生物鑒定結(jié)果
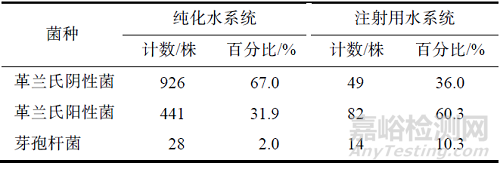
對(duì)微生物鑒定結(jié)果分析總結(jié)見(jiàn)表3,純化水系統(tǒng)中污染的微生物主要為革蘭氏陰性菌����,占污染微生物總數(shù)的67.0%,其中也有芽孢桿菌污染(占比2.0%)�����。注射用水系統(tǒng)中污染的微生物主要為革蘭氏陽(yáng)性菌����,占污染微生物總數(shù)的60.3%,其中芽孢桿菌污染占比10.3%�����。
表3 制藥用水系統(tǒng)微生物污染結(jié)果
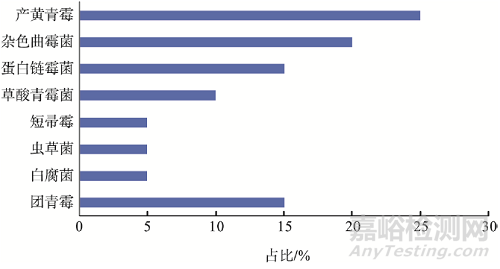
本研究從制藥用水系統(tǒng)中一共收集到20 株真菌,污染真菌種群的多樣性分析見(jiàn)圖1��。青霉菌是制藥用水系統(tǒng)中主要污染真菌�����,占比50%�����,其中最常見(jiàn)的為產(chǎn)黃青霉�����。其次為雜色曲霉菌�����,占比20%����。注射用水系統(tǒng)中污染的真菌為團(tuán)青霉和白腐菌。
圖1 制藥用水系統(tǒng)污染真菌種群多樣性分析
3�����、討論
從建立的制藥用水微生物菌庫(kù)各方面的對(duì)比情況分析可知,制藥用水系統(tǒng)中微生物占比絕大多數(shù)為革蘭氏陰性菌��,占比64.2%����。其中收集到假單胞菌55 株,假單胞菌屬的微生物容易形成生物膜��,易造成水系統(tǒng)的微生物負(fù)載超標(biāo)����,對(duì)產(chǎn)品和患者安全帶來(lái)影響�����,因此需要在水系統(tǒng)中嚴(yán)格控制��,可采用熱消毒方式(通常80 ℃)對(duì)這類(lèi)熱敏感微生物進(jìn)行殺滅�����。芽孢類(lèi)微生物占比3%����,目前國(guó)際上也將芽孢類(lèi)微生物列為產(chǎn)品中不可接受微生物�����,因此制藥用水系統(tǒng)中如果出現(xiàn)這類(lèi)較難消殺的微生物[9]�����,也需要引起重視�����。在制藥用水系統(tǒng)中較為常見(jiàn)的真菌為雜色曲霉菌和產(chǎn)黃青霉�����。從FDA 的Bad Bud Book 致病菌參考手冊(cè)可知����,曲霉菌屬和青霉菌屬均屬于不可接受微生物范疇����,F(xiàn)DA 也曾經(jīng)因?yàn)楫a(chǎn)品中出現(xiàn)這兩大類(lèi)微生物把產(chǎn)品進(jìn)行召回,因此針對(duì)水系統(tǒng)出現(xiàn)的這2 類(lèi)霉菌,需要制定有效的消毒殺菌手段����,防止這類(lèi)微生物形成生物膜,造成更大的危害�����。
本次研究收集的注射用水系統(tǒng)污染的微生物主要為革蘭氏陽(yáng)性菌����,可能革蘭氏陽(yáng)性菌細(xì)胞壁較厚耐熱性好,比革蘭氏陰性菌更能耐受注射用水系統(tǒng)溫度(70~80 ℃)��。而純化水系統(tǒng)污染的微生物主要為革蘭氏陰性菌����,因此可根據(jù)純化水系統(tǒng)和注射用水系統(tǒng)微生物種類(lèi)的不同����,采取有針對(duì)性的控制微生物手段。注射用水系統(tǒng)出現(xiàn)的革蘭氏陽(yáng)性菌主要考慮少量來(lái)源于純化水系統(tǒng)����,更多可能是外部環(huán)境帶來(lái)的污染,因此企業(yè)需要重點(diǎn)考察外部環(huán)境對(duì)注射用水系統(tǒng)的影響����,確保注射用水系統(tǒng)的清潔干凈(包括各個(gè)取樣點(diǎn)��、使用點(diǎn))����,同時(shí)應(yīng)對(duì)注射用水系統(tǒng)進(jìn)行系統(tǒng)檢查����,重點(diǎn)檢查維護(hù)是否到位、是否存在可能與外部相通的位置�����。
本研究通過(guò)4個(gè)季度的持續(xù)采樣收集制藥用水微生物�����,初步建立了高風(fēng)險(xiǎn)藥品生產(chǎn)企業(yè)制藥用水系統(tǒng)的微生物菌庫(kù)����,但是環(huán)境微生物庫(kù)的建立是個(gè)持續(xù)動(dòng)態(tài)的過(guò)程,因此需要在日常監(jiān)測(cè)中不斷完善[9]�����。制藥用水系統(tǒng)微生物菌庫(kù)的建立,可幫助生產(chǎn)企業(yè)更好地評(píng)價(jià)日常水系統(tǒng)運(yùn)行情況及消殺效果����,并根據(jù)菌群建立不同的消殺方案,同時(shí)也為高風(fēng)險(xiǎn)藥品生產(chǎn)企業(yè)的微生物污染事件提供溯源調(diào)查基礎(chǔ)��。
參考文獻(xiàn)
[1] 丁玉蓮, 杜文革, 羅艷娥. 注射用水系統(tǒng)微生物控制的風(fēng)險(xiǎn)管理[J]. 今日藥學(xué), 2013, 23(1): 14-18.
[2] 李志龍, 趙虹, 孫俊峰, 等. 制藥用水系統(tǒng)微生物控制分析[J]. 中國(guó)衛(wèi)生工程學(xué), 2014, 13(4): 324-326.
[3] GU M, XU D, GU B R. A tentative exploration on fluorescence staining counting method as the alternative method of microbial limit test for the pharmaceutical water[J].Drug Stand China(中國(guó)藥品標(biāo)準(zhǔn)), 2017, 18(4): 298-303.
[4] GAO C Y, WU G P, MA W D, et al. Validation of fast testing of microorganism with a Milliflex Quantum method[J]. Chin J New Drugs(中國(guó)新藥雜志), 2015, 24(1): 85-89.
[5] MEISI L S. Microbial detection and control analysis of pharmaceutical water[J]. Chem Intermediate(當(dāng)代化工研究) ,2018(7): 159-160.
[6] SONG M H, LI Q Q, QIN F. Establishment and data analysis of a contaminated microorganisms library for sterile pharmaceutical production processes[J]. Chin J Pharm Anal(藥物分析雜志), 2019, 39(11), 1954-1960.
[7] 中國(guó)藥典. 四部[S]. 2015: 140-141.
[8] KIM M, OH H S, PARK S C, et al. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J]. Int J Syst Evol Microbiol, 2014(64): 346-351.
[9] ZHENG X L, WANG Z N, WANG Z J, et al. Establishment of the environmentally microbial library in the drug sterility testing laboratory[J]. Chin J Mod Appl Pharm(中國(guó)現(xiàn)代應(yīng)用藥學(xué)), 2015, 32(7): 847-850.