今日頭條
和譽CSF-1R抑制劑獲歐盟PRIME����。和譽醫(yī)藥創(chuàng)新CSF-1R抑制劑pimicotinib(ABSK021)獲歐洲藥品管理局(EMA)授予優(yōu)先藥物資格(PRIME)���,用于治療不可手術的腱鞘巨細胞瘤(TGCT)。ABSK021通過阻斷CSF1/CSF-1R信號通路來調節(jié)和改變巨噬細胞功能�,在多種巨噬細胞相關疾病中發(fā)揮作用。公布于ASCO2023年會上的Ⅰb期臨床數(shù)據(jù)顯示�,Pimicotinib(50mg QD)劑量組達到77.4%的客觀緩解率���,有87.5%患者維持客觀緩解長達25周���。
國內藥訊
1.瓴路CD19靶向ADC擬納入優(yōu)先審評����。瓴路藥業(yè)注射用loncastuximab tesirine獲CDE擬納入優(yōu)先審評,用于治療二線或多線系統(tǒng)治療后復發(fā)或難治性大B細胞淋巴瘤(DLBCL)成年患者�。loncastuximab tesirine是首款獲得FDA批準的靶向CD19的抗體偶聯(lián)藥物(ADC),瓴路藥業(yè)與ADC Therapeutics成立的合資公司瓴路愛迪思擁有該藥在大中華區(qū)和新加坡的權益�。在中國II期注冊臨床OL-ADCT-402-001中,該新藥的有效性與安全性數(shù)據(jù)與全球關鍵臨床試驗ADCT-402-201結果一致����。
2.澤布替尼新適應癥擬納入優(yōu)先審評。百濟神州BTK抑制劑澤布替尼獲CDE擬納入優(yōu)先審評���,聯(lián)合CD20單抗奧妥珠單抗用于既往接受過至少二線治療的復發(fā)/難治濾泡性淋巴瘤(FL)。公布于ASCO2023年會上的全球Ⅱ期ROSEWOOD臨床更新數(shù)據(jù)顯示����,中位隨訪為20.2個月時,聯(lián)合療法ORR為69.0%(vs45.8%)�,完全緩解率為39.3%(vs19.4%),18個月持續(xù)緩解時間為69.3%(vs41.9%)�,中位無進展生存期為28.0個月(vs10.4個月)。
3.迪哲JAK1抑制劑PTCL國際臨床積極�。迪哲醫(yī)藥在ASCO2023年會上公布JAK1抑制劑戈利昔替尼治療復發(fā)/難治外周T細胞淋巴瘤(r/r PTCL)的國際臨床(JACKPORT8 Part B)積極數(shù)據(jù)。獨立評審委員會(IRC)評估的ORR達44.3%(39/88)���,完全緩解率為23.9%���;中位緩解持續(xù)時間(mDoR)尚未達到,最長DoR達16.8個月且仍持續(xù)緩解���。藥物總體安全可控���。2022年���,F(xiàn)DA已授予戈利昔替尼治療r/r PTCL的快速通道資格。
4.易慕峰EpCAM靶向CAR-T胃腸癌臨床積極����。易慕峰宣布在ASCO2023年會上公布其靶向EpCAM的CAR-T產品IMC001用于晚期結直腸癌和胃癌末線治療的最新臨床積極結果。數(shù)據(jù)顯示����,在低劑量和中劑量下,6例晚期胃癌患者中有2例患者被評定為部分緩解(PR)����,3例患者仍為疾病穩(wěn)定(SD)。中劑量組3例患者的存活時間均已超過7個月����,其中1例PR患者在IMC001輸注后28周成功進行了胃癌根治手術。
5.優(yōu)替濟生CAR-T獲批實體瘤臨床���。上海優(yōu)替濟生創(chuàng)新CAR-T細胞治療產品UCMYM802獲國家藥監(jiān)局臨床許可����,擬開發(fā)用于治療MSLN陽性晚期實體腫瘤。MSLN(間皮素)是一種細胞表面糖蛋白���,在惡性間皮瘤�、胰腺癌���、卵巢癌和肺癌等多種腫瘤中過表達。MSLN高表達調控了多種細胞信號通路�,并與腫瘤增殖、侵襲和不良預后有密切聯(lián)系�。值得一提的是,該公司還開發(fā)了一款靶向BCMA的CAR-T候選產品�,針對多發(fā)性骨髓瘤(MM)。
6.中源協(xié)和干細胞療法獲批兩項臨床���。中源協(xié)和旗下武漢光谷中源1類生物制品“VUM02注射液”獲國家藥監(jiān)局兩項臨床試驗默示許可���,適應癥分別為慢加急性(亞急性)肝衰竭患者和急性呼吸窘迫綜合征。VUM02是一款冷凍保存型干細胞制劑�,是由健康新生兒臍帶組織經體外分離、篩選����、擴增后制備的人臍帶源間充質干細胞 (UC-MSC) 懸液。目前,全球尚無用于上述兩種適應癥的同類細胞藥物獲批上市����。
國際藥訊
1.低濃度阿托品在美報兒童近視NDA。Vyluma公司0.01%低濃度阿托品眼藥水NVK002用于治療兒童近視的上市申請獲FDA受理���,PDUFA日期為2024年1月31日�。在III期CHAMP研究中�,與安慰劑組相比,NVK002組患者在包括應答者分析(Responder Analysis)�、平均等效球面度數(shù)(SER)、與基線相較的平均眼軸長度等療效指標上����,均具有統(tǒng)計學意義的改善。兆科眼科擁有NVK002在中國����、韓國和部分東南亞國家的開發(fā)和商業(yè)化授權。
2.葛蘭素史克PD-1抗體組合獲FDA優(yōu)先審評���。葛蘭素史克(GSK)開發(fā)的PD-1抗體Jemperli(dostarlimab)的補充生物制品許可申請(sBLA)獲FDA受理,與化療聯(lián)用一線治療DNA錯配修復缺陷(dMMR)和高微衛(wèi)星不穩(wěn)定性(MSI-H)的原發(fā)性晚期或復發(fā)性子宮內膜癌�。FDA同時授予其優(yōu)先審評資格�,PDUFA日期為今年9月23日�。今年1月,F(xiàn)DA已批準dostarlimab從加速批準轉變?yōu)橥耆鷾?��,用于治療含鉑化療后進展����、攜帶dMMR的復發(fā)或晚期子宮內膜癌患者���。
3.NO療法纖維化間質性肺病III期臨床失敗。Bellerophon公司評估通過藥物-器械聯(lián)合療法INOpulse將吸入式一氧化氮(iNO)直接送到纖維化間質性肺病(fILD)患者的肺部�,用于幫助血管(動脈)擴張降低肺部血壓的III期REBUILD研究未達到主要終點。與安慰劑相比�,INOpulse(劑量iNO45,45μg/kg IBW/hr)組患者16周時通過活動記錄儀測量的中度至劇烈體力活動(MVPA)變化每天相差5.49分鐘(p=0.2646)���;INOpulse耐受性良好����,未發(fā)現(xiàn)新的安全性信號�。
4.心血管藥物公司融資開發(fā)CD47靶向藥。Bitterroot Bio公司宣布完成由ARCH Venture Partners和Deerfield Management共同領投的1.45億美元的A輪融資����,以支持其靶向CD47/SIRPα途徑的先導項目BRB-002的開發(fā)����,用于治療動脈粥樣硬化等心血管疾病�。CD47蛋白可與表達在免疫細胞表面的SIRPα蛋白相互作用,傳遞“別吃我”信號來抑制免疫細胞對癌細胞的吞噬�。與同類產品治療腫瘤相比,BRB-002無需穿透腫瘤����,只需要進入血管壁,少量的藥物就能發(fā)揮治療效果�。
5.博迪生物TLR7/8激動劑授權Eikon公司。Seven and Eight Biopharmaceuticals(博迪生物)與Eikon Therapeutics就其臨床早期新型免疫調節(jié)劑Toll樣受體7和8(TLR7/8)激動劑達成授權許可協(xié)議�,授權后者在全球范圍內開發(fā)并商業(yè)化該產品用于治療紅斑狼瘡等免疫疾病。抑制TLR7/8有望廣泛抑制狼瘡相關效應因子����,同時保持對非ssRNA微生物病原體的先天性免疫反應。在Ⅰ期臨床中���,該新藥單藥或與PD-1/L1抗體聯(lián)合治療均顯示出良好的安全性以及初步療效���。
6.加州眼科公司完成1.5億美元B輪融資����。Alkeus公司宣布完成1.5億美元B輪融資�。本輪融資將用于支持其核心候選管線--維生素A衍生藥物gildeuretinol(ALK-001)用于治療常染色體隱性遺傳的眼底黃色斑點癥(又名Stargardt病,STGD1)的注冊和上市工作���,以及團隊規(guī)模的擴張���。該公司還宣布Vertex Pharmaceuticals(福泰醫(yī)藥)創(chuàng)始人Joshua Boger博士已加入Alkeus公司并擔任執(zhí)行主席。
醫(yī)藥熱點
1.第二十三屆吳楊獎揭曉����。第二十三屆吳階平-保羅·楊森醫(yī)學藥學獎正式揭曉�,中國醫(yī)學科學院北京協(xié)和醫(yī)院鐘守先教授獲吳楊獎特殊貢獻獎,以表彰其對我國腹部外科疾病領域�,特別是肝膽胰外科的開拓性貢獻。軍事科學院軍事醫(yī)學研究院微生物流行病研究所秦成峰教授����、北京大學生命科學學院魏文勝研究員等14位中國醫(yī)藥衛(wèi)生領域的優(yōu)秀工作者榮獲吳楊獎。
2.廣東17部門發(fā)布鼓勵生育18項舉措�。6月7日,廣東省衛(wèi)健委等17個部門聯(lián)合發(fā)布《關于進一步完善和落實積極生育支持措施的實施意見》提出����,加快建設生育友好省����,穩(wěn)妥有序實施一對夫妻可以生育三個子女政策及配套支持措施�,不斷深化優(yōu)生優(yōu)育及婦女兒童健康服務,完善托育����、財政、稅收����、保險、教育�、住房、就業(yè)等十八方面的生育支持措施���。
3.上海啟動醫(yī)保經辦服務直通車活動�。為優(yōu)化營商環(huán)境���,積極服務和促進上海市生物醫(yī)藥產業(yè)發(fā)展����,上海市醫(yī)保中心6月8日首次舉辦“醫(yī)保經辦服務直通車”活動,介紹本市醫(yī)保藥品目錄經辦工作����、可另行收費一次性使用醫(yī)療器械和新增醫(yī)療服務項目醫(yī)保編碼申報流程。上海市醫(yī)保中心表示�,目前,上海市已將“達芬奇手術機器人”等76個新增醫(yī)療服務項目納入醫(yī)保支付范圍����,今年將繼續(xù)采取有力舉措,擴大條件成熟的新項目�、新醫(yī)療器械(耗材)條目納入醫(yī)保支付范圍。
評審動態(tài)
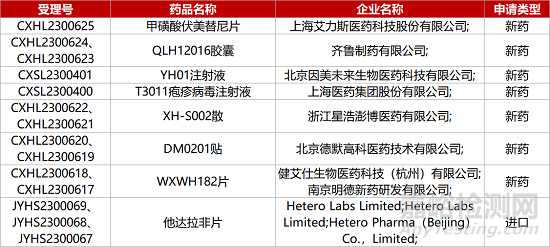
1. CDE新藥受理情況(06月08日)
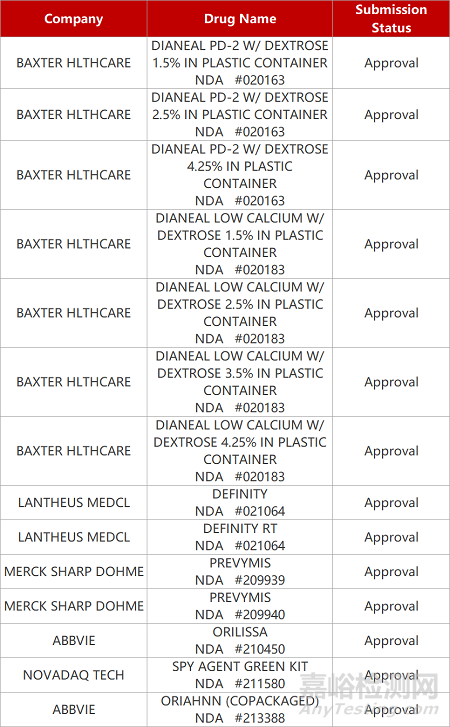
2. FDA新藥獲批情況(北美06月07日)