一次性生物工藝袋的市場和應(yīng)用發(fā)展
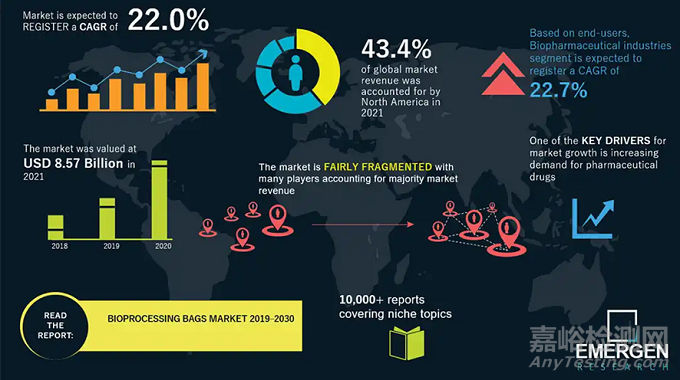
一次性袋子應(yīng)用于制藥生產(chǎn)過程已經(jīng)超過二三十年的歷史�����。目前�,一次性生物工藝袋已廣泛應(yīng)用于細(xì)胞培養(yǎng)��、產(chǎn)品混合和儲存轉(zhuǎn)移���、培養(yǎng)基和緩沖液的配制和儲存��、半成品和成品的儲存和凍存等����。一次性生物工藝系統(tǒng)市場仍然處于高速增長區(qū)間�����,根據(jù)Report Linker, Emergen Research, Businesswire等多個市場調(diào)研機構(gòu)的數(shù)據(jù),2021~2022全球市場容量約在82~122億美金��,年復(fù)合增速約16~22%��。不同機構(gòu)的統(tǒng)計范圍存在差異��,并且該數(shù)據(jù)包含了與一次性袋子�����、配套耗材及相關(guān)工藝設(shè)備����。另外,根據(jù)中信建投的統(tǒng)計和預(yù)測�,國內(nèi)一次性袋子2022年市場約50~60億元,年復(fù)合增速13~20%�。
▲圖1. 一次性生物工藝袋市場(圖片來源:Emergen Research)
驅(qū)動該市場增長的因素主要有:
全球人口老齡化,生物藥的開發(fā)和生產(chǎn)需求增長
全球發(fā)展中國家的人均醫(yī)療支出增加
新興療法對小規(guī)模�����、多品種生產(chǎn)的靈活性�����、適應(yīng)性需求增加
一次性使用系統(tǒng)的產(chǎn)品范圍和滲透率增加��,據(jù)American Pharmaceutical Review, 一次性工藝的滲透率在過去10年從10%上升至近30%��。
在應(yīng)用方面���,一次性使用袋早期主要被用于培養(yǎng)基��、緩沖液等的混合�、儲存以及細(xì)胞擴增��。隨著大規(guī)模細(xì)胞培養(yǎng)技術(shù)和一次性生物反應(yīng)器的發(fā)展���,一次性使用袋的應(yīng)用拓展到大規(guī)模生物反應(yīng)器并用于抗體����、疫苗等的生產(chǎn)�����,目前已經(jīng)開始在微生物發(fā)酵領(lǐng)域替代不銹鋼系統(tǒng)�。在大規(guī)模原液儲存方面�����,一次性袋子相比于傳統(tǒng)塑料瓶或不銹鋼容器的便利性和安全性已經(jīng)得到證實����,被更廣泛地應(yīng)用��。
隨著新興療法技術(shù)的發(fā)展���,比如細(xì)胞與基因治療�����、mRNA藥物���、外泌體、基因編輯等����,藥物和治療手段向小型化、個性化和靈活化發(fā)展�����,這也進一步促進了一次性使用系統(tǒng)的應(yīng)用。一次性使用系統(tǒng)的應(yīng)用降低了項目前期投資并縮短了建設(shè)周期����,并提升了工藝開發(fā)和驗證速度��,從而極大地加速了這些新興療法的上市����。
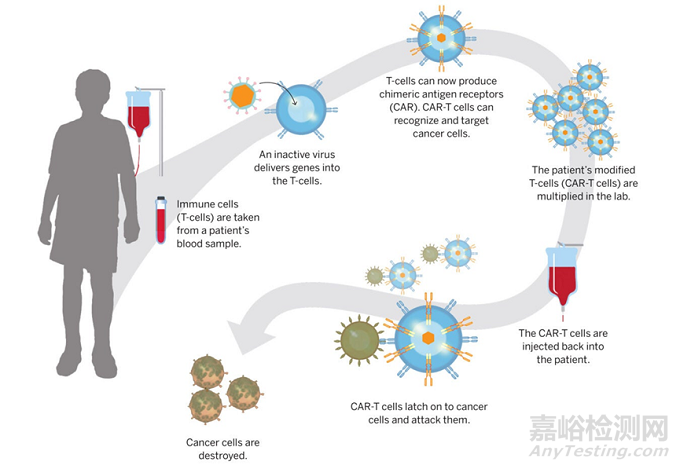
以細(xì)胞與基因治療為例,一方面����,其生產(chǎn)設(shè)施規(guī)模通常較小,靈活性要求更高��。一次性使用系統(tǒng)已經(jīng)實現(xiàn)了模塊化設(shè)計��,密閉式��、自動化操作����,進一步確保了小批量靈活化生產(chǎn)的安全性和高效性。據(jù)BioPlan統(tǒng)計���,細(xì)胞治療1000L以下生產(chǎn)規(guī)模占比59%��,基因治療該比例為53%�����。另一方面����,NMPA于2022年發(fā)布《藥品生產(chǎn)質(zhì)量管理規(guī)范-細(xì)胞治療產(chǎn)品附錄(征求意見稿)》,要求直接接觸細(xì)胞產(chǎn)品的無菌耗材應(yīng)當(dāng)盡可能使用一次性材料[1]����。
▲圖2. 細(xì)胞基因治療流程(圖片來源:Harvard Medical School)
一次性生物工藝膜的市場和技術(shù)趨勢
長期以來,許多因素也在制約著一次性生物工藝系統(tǒng)的發(fā)展和應(yīng)用�����,比如供應(yīng)鏈安全���、耗材成本�����、標(biāo)準(zhǔn)化程度等�����,其中兩大主要挑戰(zhàn)便是袋子泄漏和溶出析出風(fēng)險��。一次性生物工藝膜作為生物工藝袋的關(guān)鍵原材料之一����,很大程度上決定了生物工藝袋的安全性��。
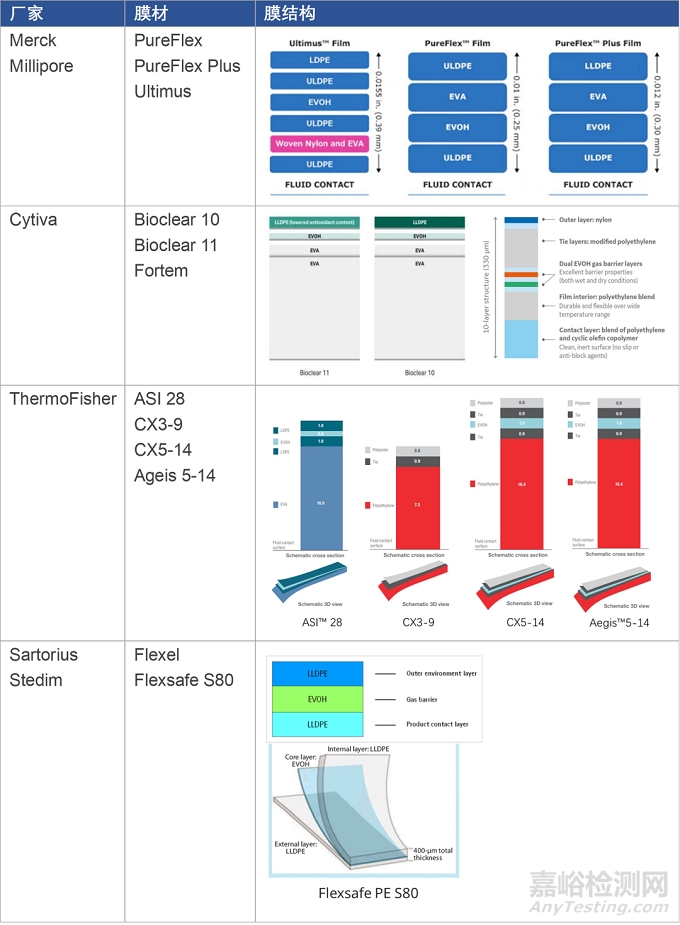
一次性袋子廠家在早期更多地采用商業(yè)化的膜材��,甚至從別的行業(yè)(如醫(yī)療����、食品)借用膜材,而后隨著應(yīng)用經(jīng)驗積累和用量提升��,開始針對生物工藝行業(yè)應(yīng)用需求開發(fā)并擁有自己的膜材�����。例如���,ThermoFisher最初HyperForma BPC使用Renolit 9101膜��,而后增加了自己的AEGIS 5-14膜����。國內(nèi)的樂純和科百特也在使用Renolit 9101膜后又推出了自有的膜材料。
早期的生物工藝膜(2006~2012)主要由低密度聚乙烯(LDPE)和乙烯-醋酸乙烯共聚物(EVA)組成接觸層�����,而更現(xiàn)代的膜(2014及以后)則主要由線性低密度聚乙烯(LLDPE)和超低密度聚乙烯(ULDPE)組成接觸層����。對一次性生物工藝膜材的升級得益于長期的應(yīng)用經(jīng)驗積累和問題發(fā)現(xiàn),通過優(yōu)化膜材結(jié)構(gòu)���、抗氧化劑����、潤滑劑等提升膜材的機械���、焊接和生物兼容性能�����。比如�����,膜材中抗氧化劑TBPP(商品名Irgafos 168)的降解產(chǎn)物(bDtBPP)對部分細(xì)胞系的生長抑制�����,促使了膜材Bioclear 10升級為Bioclear 11�����,CX 5-14升級為Ageis 5-14�����。
膜材的升級和變更需要經(jīng)過一系列耗時耗力的驗證��,對袋子生產(chǎn)企業(yè)和最終袋子用戶都意味著高昂的費用和時間成本[2, 3]��。因此����,為了降低膜材驗證和供應(yīng)鏈成本����,制藥企業(yè)以及袋子廠家都希望能夠采用統(tǒng)一的���、標(biāo)準(zhǔn)化的膜材。比如���,Cytiva推出Fortem膜是為了在上下游工藝采用統(tǒng)一膜材����,Sartorius也推出了基于Flexsafe的上下游解決方案��。
▲圖3. Cytiva Fortem膜介紹(圖片來源:Bioprocess Development Forum)
然而���,由于生物工藝行業(yè)應(yīng)用點較多�����,不同應(yīng)用環(huán)節(jié)對膜材性能的要求不盡相同�,設(shè)計一款適用于各個工藝應(yīng)用要求的膜材幾乎是不可能的����。比如,用于細(xì)胞培養(yǎng)袋的膜材關(guān)注的是析出成分對細(xì)胞成長的影響�、用于大體積袋體的膜材則更關(guān)注材料的機械和焊接強度�、用于原液和制劑生產(chǎn)的袋子則要求低溶出析出及生物安全性����、用于細(xì)胞或原液凍存的袋子則注重膜材的耐低溫性能。再加上制藥行業(yè)對工藝變更的保守����,許多一次性袋子廠家在其產(chǎn)品線中同時保留著多款膜材制成的不同袋子產(chǎn)品。
▼ 表1. 進口品牌膜材組合
不論是從技術(shù)還是市場角度��,未來一次性使用技術(shù)是走向標(biāo)準(zhǔn)化還是差異化���,行業(yè)內(nèi)的辯論從來就沒有停止過��,包括設(shè)計標(biāo)準(zhǔn)化�����、測試標(biāo)準(zhǔn)化、材料標(biāo)準(zhǔn)化等[4~8]�����,生物工藝膜也不例外���。行業(yè)用戶的呼聲是趨向標(biāo)準(zhǔn)化���,然而新材料的迭代周期和利益相關(guān)方的博弈都很漫長��,我們?nèi)匀粺o法預(yù)測未來的標(biāo)準(zhǔn)化程度及時間線����?����;蛟S�����,一次性生物工藝膜也會遵循不銹鋼材料的路徑����,未來將有統(tǒng)一的膜材標(biāo)準(zhǔn)和驗證測試方法,符合相同標(biāo)準(zhǔn)的膜材可彼此替換以降低用戶成本��;同時�,膜材供應(yīng)鏈會更集中,以使產(chǎn)業(yè)鏈綜合成本更低��。
一次性膜材的國產(chǎn)化趨勢和挑戰(zhàn)
全球范圍的公共衛(wèi)生事件以及國際政治動蕩都使得我們不得不考慮供應(yīng)鏈安全的問題。在新冠疫情期間����,我國在抗體、疫苗等生物制品生產(chǎn)中仍然使用著大量進口耗材��,即使其中已經(jīng)國產(chǎn)化的一次性袋子����,仍主要依賴進口的一次性生物工藝膜。這些原材料的供應(yīng)穩(wěn)定性對國內(nèi)藥品生產(chǎn)企業(yè)的研發(fā)與生產(chǎn)造成了相當(dāng)?shù)挠绊憽?/span>
盡管制藥裝備的國產(chǎn)化進程已進行多年�����,但國內(nèi)在核心零部件和原材料上的積累和水平仍然與國外差距較大���。工信部于2021年底發(fā)布了《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》��,提出了產(chǎn)業(yè)鏈供應(yīng)鏈穩(wěn)定可控為主要發(fā)展目標(biāo)之一�����,并為上游產(chǎn)業(yè)發(fā)展規(guī)劃提供了具體指導(dǎo),包括支持攻關(guān)核心裝備和新型材料[9]����。
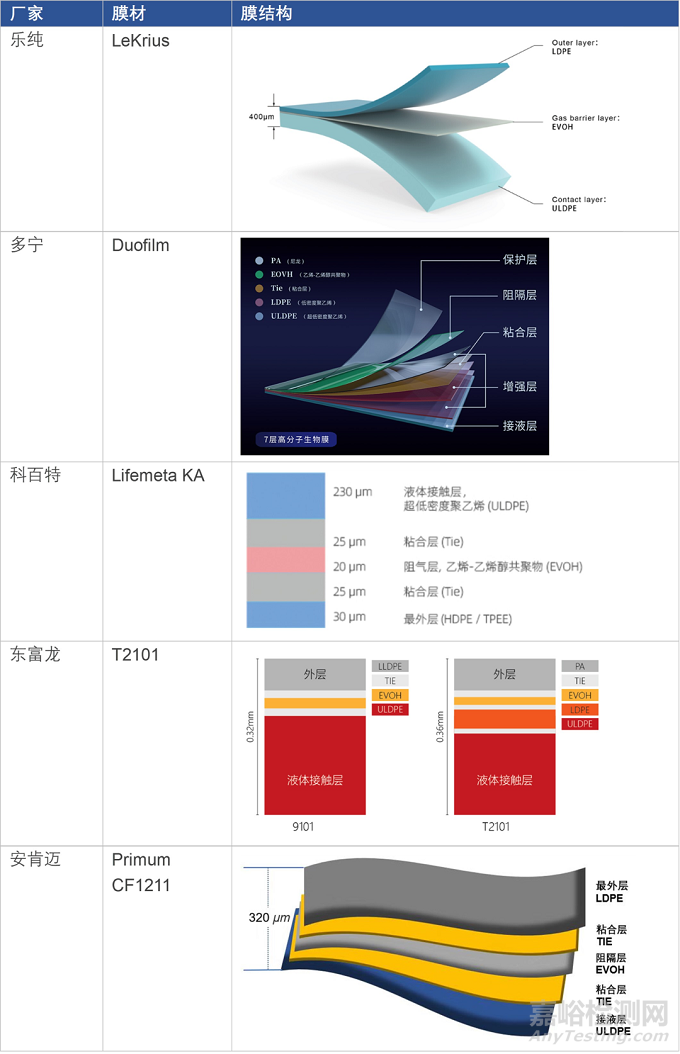
近年來�����,一次性生物工藝系統(tǒng)的國產(chǎn)化如火如荼���。據(jù)不完全統(tǒng)計,包含國際品牌在國內(nèi)的一次性袋子生產(chǎn)工廠����,國內(nèi)已經(jīng)超過30家一次性袋子生產(chǎn)企業(yè)。在膜材方面����,據(jù)公開市場信息,目前已經(jīng)有多家企業(yè)推出自有一次性膜材��,與國外類似�����,其中既有一次性袋子廠家�����,如樂純、多寧�����、科百特���,也有專供膜材的廠家���,如安肯邁、博生�����。
▼ 表2. 國產(chǎn)膜材對比
然而�����,由于進口膜材在原有制藥企業(yè)生產(chǎn)工藝中已經(jīng)過驗證����,即使部分袋子生產(chǎn)企業(yè)已經(jīng)推出一次性生物工藝膜材,其新推出的自有膜材仍然僅限于小規(guī)?����;蚍顷P(guān)鍵工藝環(huán)節(jié)的應(yīng)用��,距離大規(guī)模進口替代仍然任重道遠��。同時�����,大部分的袋子生產(chǎn)企業(yè)仍然完全依賴進口Renolit膜���。
▲圖4. AKM Primum CF1211多層共擠膜(圖片來源:www.anchormanbiotech.com)
除了膜材替代成本高以外���,另一個挑戰(zhàn)是膜材的研發(fā)和制造成本。膜材的研發(fā)對材料學(xué)和制膜工藝經(jīng)驗的要求極高���,也需要大量的資金和時間投入����。Cytiva在開發(fā)Fortem膜的過程中�,與Sealed Air共同篩選評估了約22種試樣才確認(rèn)了最終的膜材設(shè)計[10]。對大部分一次性袋子生產(chǎn)企業(yè)而言�,對材料學(xué)和制膜過程缺乏專業(yè)能力,并且膜材的用量不足以支持其開展原材料的研發(fā)和制造。只有當(dāng)這些膜材用量集中起來����,由專門的膜材生產(chǎn)企業(yè)負(fù)責(zé),才能夠集中研發(fā)與生產(chǎn)資源�����,實現(xiàn)供應(yīng)鏈的成本優(yōu)化�。
總結(jié)與展望
隨著更多生物藥的持續(xù)開發(fā)和上市,以及新興治療藥物對小規(guī)模����、靈活化生產(chǎn)的更高需求,一次性生物工藝系統(tǒng)市場將繼續(xù)保持高增長速率���,尤其是其中一次性使用技術(shù)滲透率相對較低的工藝系統(tǒng)����,如超濾���、層析等���,以及新興治療藥物生產(chǎn)工藝所需的工藝系統(tǒng)��,如病毒收獲�����、細(xì)胞分選等。
一次性生物工藝膜作為一次性袋子的關(guān)鍵原材料�����,已隨著行業(yè)應(yīng)用數(shù)據(jù)和經(jīng)驗的積累��,完成了新一代膜材的開發(fā)升級���,并已經(jīng)在逐步替代較老的膜材�����。新一代膜材要么在某些特定工藝環(huán)節(jié)有著更優(yōu)的性能表現(xiàn)����,如細(xì)胞培養(yǎng)���,要么增強了袋子生產(chǎn)廠家對膜材供應(yīng)鏈的控制�,要么有助于在上下游工藝統(tǒng)一膜材。然而�,對于生物工藝膜材在未來將走向標(biāo)準(zhǔn)化還是個性化,行業(yè)仍然處于爭論與博弈之中����,似乎還沒有達成一致意見。
在產(chǎn)業(yè)鏈國產(chǎn)化方面�����,國際貿(mào)易和政治局勢正在加速國產(chǎn)化向上游供應(yīng)鏈轉(zhuǎn)移���。一次性生物工藝膜材作為關(guān)鍵原材料���,其國產(chǎn)化受到了國家政策的支持,并已在企業(yè)行動中已經(jīng)取得了初步成果��,部分國產(chǎn)膜材的性能測試數(shù)據(jù)已經(jīng)與進口膜材不分伯仲����。然而,大規(guī)模應(yīng)用中的一次性膜材仍主要依賴進口�����,國產(chǎn)化膜材替代道阻且長,機遇與挑戰(zhàn)并存���。同時�����,筆者也期待看到國產(chǎn)化一次性系統(tǒng)和原材料在國際市場占有更多的市場份額����,成為全球供應(yīng)鏈體系的重要組成���。
參考文獻
[1] NMPA. 藥品生產(chǎn)質(zhì)量管理規(guī)范-細(xì)胞治療產(chǎn)品附錄(征求意見稿). 2022-01-06. https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20220106165600150.html
[2] Susan Burke. Considerations in Evaluating New Plastic Film for Single-Use Technologies and Film Development. Downstream Column. Feb 08, 2016. https://downstreamcolumn.com/considerations-evaluating-new-plastic-film-single-use-technologies-film-development/
[3] Katharina Blaschczok, Nina Steiger, Elke Jurkiewicz, Ute Husemann, Franziska Faulstich, Regine Eibl and Gerhard Greller. Evaluating New Film for Single-Use Bags: Growth Performance Studies with Animal and Human Cells. Bioprocess International. Mar 14, 2016. https://bioprocessintl.com/upstream-processing/upstream-single-use-technologies/evaluating-new-film-for-single-use-bags-growth-performance-studies-with-animal-and-human-cells/
[4] Maribel Rios. Outlooks on Standardization. Bioprocess International, May 1, 2012. https://bioprocessintl.com/manufacturing/monoclonal-antibodies/outlooks-on-standardization-330194/
[5] Extractables and Leachables Subcommittee of the Bio-Process Systems Alliance. Extractables and Leachables Subcommittee of the Bio-Process Systems Alliance. Bioprocess International, Mar 10, 2015. https://bioprocessintl.com/manufacturing/single-use/toward-industry-standardization-extractables-testing-single-use-systems-collective-bpsa-perspective/
[6] David Wolton, Luke Heaven, Scott McFeaters and Mahesh Kodilkar. Standardization of Disposables Design: The Path Forward for a Potential Game Changer. Bioprocess International, Dec 16, 2015. https://bioprocessintl.com/manufacturing/supply-chain/standardization-of-disposables-design-the-path-forward-for-a-potential-game-changer/
[7] Javier Lozano and Austin Lock. Benefits of Single-Use Standardization: Adopting a Standard Design Approach. Bioprocess International, May 21, 2021. https://bioprocessintl.com/manufacturing/single-use/benefits-of-single-use-standardization-adopting-a-standard-design-approach/
[8] Dan Stanton. Industry calls for standardization and simplification to boost manufacturing agility. Bioprocess International. Mar 1, 2021. https://bioprocessintl.com/bioprocess-insider/industry-calls-for-standardization-and-simplification-to-boost-manufacturing-agility/
[9] 工信部. “十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃. 2021-12-22. https://www.gov.cn/zhengce/zhengceku/2022-01/31/content_5671480.htm
[10] Cytiva. Developing a fit-for-purpose bioprocess film. https://www.cytivalifesciences.com/en/us/solutions/bioprocessing/knowledge-center/developing-a-fit-for-purpose-bioprocess-film