摘 要 / Abstract
目的 :梳理我國藥品進(jìn)口備案法規(guī)體系及相關(guān)管理,研究我國現(xiàn)行藥品進(jìn)口備案制度及存在的問題��,為今后政策制定和優(yōu)化提供文獻(xiàn)參考�。方法 :運(yùn)用文獻(xiàn)研究和統(tǒng)計(jì)分析等方法,對(duì)現(xiàn)有藥品進(jìn)口備案管理制度進(jìn)行深入研究����,梳理藥品進(jìn)口備案中不同進(jìn)口情形的法規(guī)文件及管理要求,找出存在的突出問題及爭(zhēng)議點(diǎn)�。結(jié)果與結(jié)論 :當(dāng)前藥品進(jìn)口備案工作中存在法規(guī)制度略顯滯后、覆蓋面相對(duì)較窄��、種類繁雜����、部分規(guī)定尚不夠明確具體,首次進(jìn)口品種的認(rèn)定��、準(zhǔn)許證進(jìn)口且無需口岸檢驗(yàn)的藥品是否需要備案存在爭(zhēng)議,證件核驗(yàn)程序滯后�、信息共享渠道不暢等問題。以上問題使得行政主體和相對(duì)人很難全面了解和正確把握相關(guān)法規(guī)制度�,各口岸執(zhí)行標(biāo)準(zhǔn)不統(tǒng)一,易影響進(jìn)口藥品市場(chǎng)供應(yīng)�,不利于建立統(tǒng)一、規(guī)范��、高效的進(jìn)口備案監(jiān)管體系和營造良好的營商環(huán)境����。針對(duì)存在的突出問題及爭(zhēng)議點(diǎn)�,提出完善規(guī)章制度、加強(qiáng)進(jìn)口備案信息化建設(shè)等針對(duì)性建議�。完善藥品進(jìn)口備案制度,能夠提高藥品進(jìn)口備案工作的質(zhì)量和效率�,更好地為行政決策提供信息支撐、為政府服務(wù)提供信息指引�、為事后監(jiān)管提供管理線索。
Objective: To sort out the regulatory system and relevant management of drug import filing in China, study the current drug import filing system and existing problems in China, and provide literature reference for future policy formulation and optimization.Methods: Using the methods of literature research and statistical analysis to conduct in-depth research on the existing drug import filing management regulatory system, sort out the regulatory documents and management requirements for different import situations in the drug import filing, and find out the outstanding problems and disputes. Results and Conclusion: At present, there are some problems in the drug import filing work, such as slightly lagging laws and regulations, relatively narrow coverage, multifarious types, unclear and unspecific provisions, disputes over whether the first-time import is recognized, whether the drugs imported without port inspection need to be filed or not, lagging document verification procedures, and poor information sharing channels. The above problems make it difficult for the administrative subject and the counterpart to fully understand and correctly grasp the laws and regulations. Also,the implementation standards at various ports are not uniform, which is easy to affect the market supply of imported drugs, and is not conducive to establishing a unified, standardized and efficient import filing supervision system and creating a good business environment. Aiming at the outstanding problems and controversial points, this paper puts forward some pertinent suggestions such as perfecting regulations and strengthening the informatization construction of import record keeping. Perfecting the drug import filing system can improve the quality and efficiency of drug import filing, better provide information support for administrative decisionmaking, information guidance for government services, and management clues for post-event supervision.
關(guān) 鍵 詞 / Key words
進(jìn)口藥品�;進(jìn)口備案;法規(guī)����;問題�;建議
imported drugs; import filing; regulations; problems; suggestions
從行政主體角度而言,藥品進(jìn)口備案是口岸藥品監(jiān)管部門按程序向藥品進(jìn)口單位發(fā)放《進(jìn)口藥品通關(guān)單》[1]和通知口岸藥品檢驗(yàn)機(jī)構(gòu)對(duì)進(jìn)口藥品進(jìn)行抽查檢驗(yàn)的過程[2]�。海關(guān)憑藥品監(jiān)管部門出具的《進(jìn)口藥品通關(guān)單》辦理通關(guān)手續(xù)。無《進(jìn)口藥品通關(guān)單》的,海關(guān)不得放行[2]����。因此,藥品進(jìn)口備案工作關(guān)系到國民能否用上正規(guī)的進(jìn)口藥品。而未經(jīng)備案,相對(duì)人就不能從事藥品進(jìn)口活動(dòng),可見進(jìn)口備案直接影響相對(duì)人的權(quán)利義務(wù)[3]��。從法律意義上看,進(jìn)口備案兼具行政許可的特性����。此外,收集和管理進(jìn)口藥品信息可為行政決策提供信息支撐、為政府服務(wù)提供信息指引�、為事后監(jiān)管提供信息線索[3]。因此,藥品進(jìn)口備案具有十分重要的意義�。
本文對(duì)藥品進(jìn)口備案法規(guī)體系(包括相關(guān)的法律、法規(guī)��、規(guī)章��、規(guī)范性文件等)進(jìn)行研究��,對(duì)不同進(jìn)口情況進(jìn)行梳理�,同時(shí)對(duì)藥品進(jìn)口備案工作中存在的突出問題進(jìn)行分析并為此提出針對(duì)性建議。期望給進(jìn)口單位提供業(yè)務(wù)幫助,并為進(jìn)一步提高我國藥品進(jìn)口備案工作的質(zhì)量和效率提供參考����。
1����、藥品進(jìn)口備案法規(guī)體系及管理規(guī)定
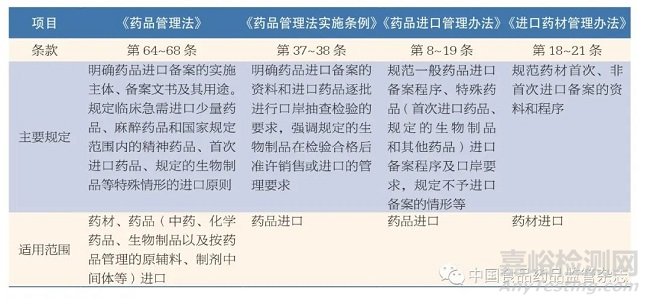
藥品進(jìn)口備案工作涉及的法規(guī)文件主要包括《藥品管理法》[2]�、《藥品管理法實(shí)施條例》[4]、《藥品進(jìn)口管理辦法》[1]�、《進(jìn)口藥材管理辦法》[5]等。前兩部法律法規(guī)規(guī)范了藥品進(jìn)口備案工作的基本原則和形式����。后兩部國家藥品監(jiān)管部門的規(guī)章是開展進(jìn)口備案工作的主要依據(jù)。經(jīng)提煉,具體內(nèi)容見表1��。
表1 法律��、法規(guī)��、規(guī)章對(duì)藥品進(jìn)口備案的管理規(guī)定
除以上法律法規(guī)�、部門規(guī)章外,為保證藥品進(jìn)口備案工作的質(zhì)量和效率,國家藥品監(jiān)管部門制定了《藥品進(jìn)口備案工作指南》[6],進(jìn)一步細(xì)化了備案受理的基本原則�、備案工作的基本程序、申請(qǐng)表的審查規(guī)范��、備案審查要點(diǎn)及注意事項(xiàng)等�。此外,為應(yīng)對(duì)進(jìn)口藥品備案工作中的現(xiàn)實(shí)問題,國家藥品監(jiān)管部門陸續(xù)出臺(tái)一系列通知�、公告以及政策解讀等規(guī)范性文件,共同組成了藥品進(jìn)口備案的法規(guī)體系�。在日常工作中,從備案程序及藥品屬性可分為藥材、藥品����、非藥用物品進(jìn)口備案。
1.1 藥材進(jìn)口備案
除前文提到的《進(jìn)口藥材管理辦法》外,藥材進(jìn)口備案還主要依據(jù)《國家藥監(jiān)局海關(guān)總署市場(chǎng)監(jiān)管總局關(guān)于實(shí)施〈進(jìn)口藥材管理辦法〉有關(guān)事項(xiàng)的公告》[7]�。該公告中公布了《非首次進(jìn)口藥材品種目錄》,凡申請(qǐng)進(jìn)口列入目錄中的藥材品種,申請(qǐng)人無須取得《進(jìn)口藥材批件》,直接按非首次進(jìn)口藥材備案。
1.2 藥品進(jìn)口備案
藥品進(jìn)口的備案范圍不僅包括中藥�、化學(xué)藥品、生物制品,還包括化學(xué)原料藥�、輔料和制劑中間體的進(jìn)口。這類進(jìn)口占比較大,規(guī)定較細(xì),按具體用途可細(xì)分為上市藥品進(jìn)口備案和注冊(cè)用樣品進(jìn)口備案����。
除常規(guī)藥品外,上市藥品進(jìn)口備案還涉及特殊情形,包含首次在中國境內(nèi)銷售的藥品(以下簡稱首次進(jìn)口品種)、規(guī)定的生物制品��、麻醉藥品和精神藥品�、蛋白同化制劑和肽類激素,相應(yīng)的法律、法規(guī)��、規(guī)章及規(guī)范性文件對(duì)上述特殊進(jìn)口情形做了具體要求,相關(guān)法規(guī)梳理見表2����。
表2 上市藥品進(jìn)口備案中特殊情形的制度梳理
注冊(cè)用樣品進(jìn)口備案包括藥學(xué)研究��、注冊(cè)檢驗(yàn)����、臨床試驗(yàn)研究三類不同研究類型的備案,在進(jìn)口前需取得相應(yīng)的批準(zhǔn)證明性文件方可進(jìn)口�。按照《藥品進(jìn)口管理辦法》的規(guī)定,這類進(jìn)口須經(jīng)國家藥品監(jiān)管部門批準(zhǔn),憑《進(jìn)口藥品批件》辦理進(jìn)口備案[1]。為與進(jìn)口藥品注冊(cè)制度銜接,國家藥品監(jiān)管部門陸續(xù)發(fā)布了相應(yīng)的通知����、公告等規(guī)范性文件以簡化注冊(cè)用樣品進(jìn)口程序,具體制度文件梳理見表3。
表3 注冊(cè)用樣品進(jìn)口備案的制度文件梳理
1.3 非藥用物品進(jìn)口備案
根據(jù)《藥品進(jìn)口管理辦法》的規(guī)定,列入《進(jìn)口藥品目錄》的物品必須辦理《進(jìn)口藥品通關(guān)單》�。由于該目錄是按照商品稅則的分類和編制方式制定的,致使有些非藥用物品(食用原、輔料和藥品合成前體)也按照藥品管理�。因此該類物品進(jìn)口時(shí),需要進(jìn)口備案并取得《進(jìn)口藥品通關(guān)單》[18]。非藥用物品的進(jìn)口實(shí)行目錄管理和審批管理,目錄內(nèi)物品可以直接按程序辦理進(jìn)口備案,目錄外物品需先取得國家藥品監(jiān)管部門的批準(zhǔn)文件,再辦理進(jìn)口備案����。迄今,國家藥品監(jiān)管部門先后共發(fā)布三批非藥用物品目錄[18-20]。
2�、藥品進(jìn)口備案工作尚存在的問題與爭(zhēng)議
2.1 法規(guī)體系建設(shè)方面的問題
2.1.1 法規(guī)制度略顯滯后
藥品進(jìn)口備案工作中具有指導(dǎo)意義的《藥品進(jìn)口管理辦法》《藥品進(jìn)口備案工作指南》是2003年由原國家食品藥品監(jiān)督管理局制定的,并于2004年1月1日起實(shí)施至今,僅在2012年,將《藥品進(jìn)口管理辦法》第十七條和第二十五條中“其他不符合我國藥品管理有關(guān)規(guī)定的”和“其他不符合國家藥品監(jiān)督管理法律�、法規(guī)和規(guī)章規(guī)定的”修正為“藥品監(jiān)督管理部門有其他證據(jù)證明進(jìn)口藥品可能危害人體健康的”。期間近20年,并未做出實(shí)質(zhì)性修訂�。但是,近年來不論是醫(yī)藥產(chǎn)業(yè)的發(fā)展,還是藥品監(jiān)管理念和監(jiān)管方式方法都發(fā)生了很大的變化,這部法規(guī)的內(nèi)容相對(duì)滯后,不能適應(yīng)時(shí)代的發(fā)展需要。為彌補(bǔ)法規(guī)的缺陷以順應(yīng)時(shí)代,國家藥品監(jiān)管部門陸續(xù)發(fā)布一系列公告和通知,有些公告����、通知要求與實(shí)際執(zhí)行并不完全一致����。隨著藥品注冊(cè)審批制度的改革,相關(guān)注冊(cè)文書的類型及內(nèi)容發(fā)生了很大變化,但涉及進(jìn)口備案的法規(guī)并未隨之修改��。如在臨床試驗(yàn)樣品進(jìn)口備案中,《辦理藥品進(jìn)口備案手續(xù)有關(guān)事宜公告》明確規(guī)定,申請(qǐng)人持注有“憑此件辦理所需樣品進(jìn)口手續(xù)”的《藥物臨床研究批件》辦理進(jìn)口備案手續(xù)�。而如今批件已變更了多個(gè)版本,名稱先后為《藥物臨床試驗(yàn)批件》《藥物臨床試驗(yàn)通知書》《藥物臨床試驗(yàn)批準(zhǔn)通知書》等,“憑此件辦理所需樣品進(jìn)口手續(xù)”的文字備注后來也予取消。
2.1.2 法規(guī)制度覆蓋面相對(duì)較窄
現(xiàn)有法規(guī)制度對(duì)藥品進(jìn)口的實(shí)際情況并未完全涵蓋,對(duì)注冊(cè)用樣品進(jìn)口備案沒有做單獨(dú)細(xì)致的規(guī)定,各口岸藥品監(jiān)管部門也只能參照《藥品進(jìn)口管理辦法》及《藥品進(jìn)口備案工作指南》執(zhí)行��。對(duì)參照標(biāo)準(zhǔn)中有些政策理解不同,如藥品剩余有效期必須大于12個(gè)月的適用性,各口岸執(zhí)行尺度不統(tǒng)一�。臨床試驗(yàn)研究中經(jīng)常會(huì)用到聯(lián)合用藥、病例篩選用藥�、背景用藥、訓(xùn)練指導(dǎo)用藥��、急救用藥����、安慰劑等,但對(duì)此類藥品進(jìn)口備案法規(guī)依據(jù)、具體申報(bào)程序及要求并沒有做詳細(xì)規(guī)定����。用于申請(qǐng)進(jìn)口藥材批件的注冊(cè)檢驗(yàn)、基原鑒定的藥材如何入境,同樣在《進(jìn)口藥材管理辦法》中并沒有涉及,通過隨身行李攜帶等方式入境,也面臨藥品是否合法入境的爭(zhēng)議。
2.1.3 法規(guī)制度種類繁雜��,部分規(guī)定尚不夠明確具體
據(jù)筆者統(tǒng)計(jì),各類藥品進(jìn)口備案相關(guān)的法律�、法規(guī)、規(guī)章��、規(guī)范性文件近40項(xiàng)之多,有些規(guī)定重復(fù),有些規(guī)定尚不夠明確��。如化學(xué)藥品5.2類BE試驗(yàn)備案樣品和對(duì)照品的進(jìn)口備案規(guī)定在《〈化學(xué)藥品注冊(cè)分類改革工作方案〉政策解讀(五)》中,規(guī)定可以憑備案號(hào)辦理進(jìn)口備案,但具體備案程序�、備案資料的要求并未提及。眾多種類繁雜����、內(nèi)容不明確的規(guī)定使得行政主體和相對(duì)人很難全面了解和正確把握,不易提高進(jìn)口備案工作的質(zhì)量。
2.2 進(jìn)口備案工作中的爭(zhēng)議點(diǎn)
2.2.1 首次進(jìn)口品種的認(rèn)定存在爭(zhēng)議
《國家藥品監(jiān)督管理局關(guān)于進(jìn)口化學(xué)藥品通關(guān)檢驗(yàn)有關(guān)事項(xiàng)的公告》[21]規(guī)定,取消進(jìn)口化學(xué)藥品的口岸檢驗(yàn),但首次進(jìn)口品種情形除外,辦理該情形通關(guān)備案時(shí),仍需口岸所在地藥品監(jiān)管部門通知口岸藥品檢驗(yàn)所抽查檢驗(yàn)��。但對(duì)首次進(jìn)口品種相關(guān)法規(guī)沒有給出明確的認(rèn)定標(biāo)準(zhǔn),各口岸執(zhí)行尺度也不統(tǒng)一��。目前大致有3種觀點(diǎn),一是所進(jìn)口藥品符合《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》[22]中藥學(xué)變更的情形,認(rèn)定為首次進(jìn)口品種����。二是所進(jìn)口藥品只有涉及《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》中重大變更的,按首次進(jìn)口品種辦理。三是不考慮所進(jìn)口藥品的藥學(xué)變更情況,僅依據(jù)申請(qǐng)單位是否能提供該藥品之前的進(jìn)口記錄來做判定�。各口岸執(zhí)行標(biāo)準(zhǔn)的不一致,同一藥品從不同口岸進(jìn)口時(shí),是否被要求強(qiáng)制檢驗(yàn),有截然不同的結(jié)果。而口岸檢驗(yàn)需要數(shù)周時(shí)間,期間藥品不得銷售,會(huì)影響藥品持續(xù)供應(yīng)����。
2.2.2 準(zhǔn)許證進(jìn)口且無需口岸檢驗(yàn)的藥品是否需要備案存在爭(zhēng)議
按照《蛋白同化制劑和肽類激素進(jìn)出口管理辦法》規(guī)定,進(jìn)口科研教學(xué)用途的蛋白同化制劑和肽類激素,無需口岸檢驗(yàn),無需辦理《進(jìn)口藥品通關(guān)單》,申報(bào)單位可憑準(zhǔn)許證向海關(guān)申請(qǐng)報(bào)關(guān),進(jìn)口備案不再具有進(jìn)口程序上的強(qiáng)制性,同時(shí)也無相關(guān)法規(guī)提及這類備案的備案憑證。在《國家藥品監(jiān)督管理局關(guān)于進(jìn)口化學(xué)藥品通關(guān)檢驗(yàn)有關(guān)事項(xiàng)的公告》發(fā)布后,非首次進(jìn)口麻醉藥品��、精神藥品的進(jìn)口備案也面臨同樣的問題����。很多口岸認(rèn)為申請(qǐng)進(jìn)口準(zhǔn)許證便是進(jìn)口備案,因此取消對(duì)該類藥品備案。然而,進(jìn)口準(zhǔn)許證審批與進(jìn)口備案所采集信息的口徑和內(nèi)容完全不同,造成對(duì)這類本該加強(qiáng)管制的特殊情形藥品的進(jìn)口底數(shù)不清,對(duì)事后監(jiān)管不利��。
2.3 證件核驗(yàn)程序滯后
2020年1月1日起,藥品進(jìn)口備案正式實(shí)行“單一窗口”系統(tǒng)網(wǎng)上申請(qǐng)��。備案通過后,申請(qǐng)單位仍需到現(xiàn)場(chǎng)領(lǐng)取紙質(zhì)《進(jìn)口藥品通關(guān)單》,攜帶《進(jìn)口藥品注冊(cè)證》等批準(zhǔn)證明文件原件進(jìn)行現(xiàn)場(chǎng)核驗(yàn),未能從真正意義上實(shí)現(xiàn)全程網(wǎng)上辦理����。按照《藥品進(jìn)口備案工作指南》的要求,《進(jìn)口藥品注冊(cè)證》應(yīng)每次查驗(yàn),為減少經(jīng)營環(huán)節(jié)的運(yùn)輸成本,一種藥品通常需要在全國多個(gè)口岸進(jìn)口,申報(bào)單位往往需要持注冊(cè)證原件在全國各地奔波。這樣網(wǎng)上辦理快捷便利的優(yōu)勢(shì)不能完全體現(xiàn),不利于國內(nèi)營商環(huán)境��。
2.4 信息共享渠道不暢
藥品進(jìn)口備案與藥品注冊(cè)聯(lián)系緊密,全面掌握藥品的注冊(cè)信息,有助于更好地開展進(jìn)口備案工作��?���?诎侗O(jiān)管人員獲取藥品注冊(cè)信息的渠道往往局限于申報(bào)單位提交的藥品批準(zhǔn)證明文件,而藥品的注冊(cè)信息是以補(bǔ)充申請(qǐng)的形式在不斷更新的,所進(jìn)口的藥品是否符合最新的注冊(cè)要求,沒有暢通的信息共享渠道做支撐,很難做出精準(zhǔn)判斷。原輔料登記號(hào)��、檢驗(yàn)通知單、臨床試驗(yàn)通知書����、BE備案號(hào)等文件不同程度地缺少生產(chǎn)廠商、質(zhì)量標(biāo)準(zhǔn)等進(jìn)口備案所需的關(guān)鍵信息�。由于從法定申報(bào)資料中所能獲取注冊(cè)信息量有限,又無其他獲取注冊(cè)信息便捷渠道,易引起備案信息偏差,藥品進(jìn)口備案的工作質(zhì)量和工作效率很難提高。
3����、討論建議
3.1 完善藥品進(jìn)口備案的法規(guī)制度
藥品進(jìn)口備案的法規(guī),是有效保障合規(guī)藥品入境的先決條件和基礎(chǔ)。建議以《藥品管理法》為支撐,在把握基本原則的基礎(chǔ)上設(shè)立合理的監(jiān)管制度,合理規(guī)劃具體的操作規(guī)則��。注意法規(guī)體系的縱向連貫,重點(diǎn)完善修訂《藥品進(jìn)口管理辦法》《進(jìn)口藥材管理辦法》,整合陸續(xù)出臺(tái)的以彌補(bǔ)這兩個(gè)辦法不足的一系列通知����、公告,吸收實(shí)踐中好的經(jīng)驗(yàn)做法,及時(shí)廢除過時(shí)、內(nèi)容重復(fù)�、與兩個(gè)辦法矛盾的文件,同時(shí)與藥品注冊(cè)改革中相關(guān)的法規(guī)制度相銜接,進(jìn)一步修訂《藥品進(jìn)口備案工作指南》。在完善原有法規(guī)的同時(shí),整合一系列繁雜��、不明確的通知和公告,針對(duì)注冊(cè)用樣品進(jìn)口管理,出臺(tái)專門的規(guī)章制度����。同時(shí),在完善法規(guī)的過程中,要暢通大眾的信息來源和表達(dá)渠道,做到公開透明。
3.2 加強(qiáng)指導(dǎo)�,消除備案中的問題與爭(zhēng)議
建議加強(qiáng)對(duì)口岸藥品監(jiān)管部門的監(jiān)督和指導(dǎo),推出口岸藥品監(jiān)管部門的年度報(bào)告制度,及時(shí)了解各口岸的工作情況和問題,掌握進(jìn)口藥品監(jiān)管部門和檢驗(yàn)機(jī)構(gòu)年度工作情況,了解各口岸藥品監(jiān)管部門存在的問題,聽取對(duì)藥品進(jìn)口管理的意見建議,督促各口岸藥品監(jiān)管部門更好地履職盡責(zé)��。同時(shí)建立日常問題收集和反饋機(jī)制,及時(shí)消除進(jìn)口備案中的問題及爭(zhēng)議�。明確首次進(jìn)口品種認(rèn)定的標(biāo)準(zhǔn),在藥品發(fā)生產(chǎn)地��、處方����、工藝等重大變更時(shí),仍需按首次進(jìn)口程序開展法定檢驗(yàn),嚴(yán)把質(zhì)量關(guān)�。對(duì)研究用蛋白同化制劑和肽類激素及非首次進(jìn)口麻醉藥品、精神藥品這類進(jìn)口備案沒有程序約束的特殊情形,通過完善相應(yīng)法規(guī),建立強(qiáng)制進(jìn)口備案制度,規(guī)范備案憑證等方式加強(qiáng)監(jiān)管�。
3.3 推行電子證照,建立信息共享平臺(tái)
建議推出《進(jìn)口藥品注冊(cè)證》《進(jìn)口藥品通關(guān)單》等進(jìn)口備案工作相關(guān)的電子證照,為進(jìn)口藥品上市許可持有人發(fā)放與注冊(cè)證一一對(duì)應(yīng)的密鑰設(shè)備,在進(jìn)口備案審核系統(tǒng)(中國國際貿(mào)易單一窗口)中,通過計(jì)算機(jī)技術(shù)對(duì)密鑰的識(shí)別,實(shí)現(xiàn)注冊(cè)證的遠(yuǎn)程核驗(yàn),既符合現(xiàn)有法規(guī)對(duì)注冊(cè)證核驗(yàn)的規(guī)定,又可以讓信息流動(dòng)代替人工跑動(dòng),實(shí)現(xiàn)真正意義的全程網(wǎng)上辦理,進(jìn)一步優(yōu)化營商環(huán)境�。加快建立注冊(cè)信息共享平臺(tái),該平臺(tái)與進(jìn)口備案系統(tǒng)互聯(lián),通過開發(fā)信息自動(dòng)核查功能,實(shí)現(xiàn)進(jìn)口藥品報(bào)驗(yàn)單內(nèi)容與注冊(cè)信息自動(dòng)比對(duì),有爭(zhēng)議時(shí),口岸藥品監(jiān)管部門可通過賬號(hào)登錄平臺(tái)查詢所需進(jìn)口藥品的注冊(cè)信息,對(duì)電子審單結(jié)果進(jìn)行必要的人工干預(yù),從而降低單純?nèi)斯弳蔚牟铄e(cuò)率,提高效率,監(jiān)管人員把注意力重點(diǎn)集中在具體申報(bào)材料和產(chǎn)品本身的查驗(yàn)上,有效提高進(jìn)口備案工作的質(zhì)量和效率。
第一作者簡介:王鵬峰����,碩士,北京市藥品監(jiān)督管理局政務(wù)服務(wù)中心主任科員�,藥師。專業(yè)方向:藥事法規(guī)
通訊作者簡介:田麗娟��,博士��,沈陽藥科大學(xué)工商管理學(xué)院��,碩士生導(dǎo)師。專業(yè)方向:藥事法規(guī)