經(jīng)典的傷口愈合過(guò)程主要由四個(gè)階段組成��,即止血���、炎癥、增殖和重塑�����,其中免疫微環(huán)境的調(diào)節(jié)是以順序方式促進(jìn)傷口愈合進(jìn)展的關(guān)鍵因素��。然而���,免疫調(diào)節(jié)功能障礙的傷口愈合受損可能導(dǎo)致慢性傷口的產(chǎn)生��,這些傷口通常停滯在炎癥階段��。而早期持續(xù)的炎癥反應(yīng)與真皮附屬物的缺陷直接相關(guān)��,常常會(huì)導(dǎo)致皮膚功能缺陷以及疤痕的形成��。因此��,臨床上迫切需要在不同的修復(fù)階段對(duì)傷口微環(huán)境進(jìn)行特定的調(diào)節(jié)���,尤其是對(duì)慢性傷口來(lái)說(shuō)�。
有鑒于此�����,浙江大學(xué)顧臻教授/張宇琪研究員和Shenqiang Wang等人設(shè)計(jì)了一種具有程序化功能的核殼結(jié)構(gòu)微針陣列貼片(PF-MNs)�,可根據(jù)不同的愈合階段動(dòng)態(tài)調(diào)節(jié)傷口免疫微環(huán)境。具體而言�,PF-MNs通過(guò)在激光照射下產(chǎn)生活性氧(ROS),在傷口愈合早期對(duì)抗耐多藥細(xì)菌生物膜����。隨后,ROS敏感的MN外殼逐漸降解���,暴露出MN核心成分���,從而中和各種炎癥因子,促進(jìn)從炎癥到增殖的相變����。此外���,釋放的維替泊芬可通過(guò)阻斷成纖維細(xì)胞中Engrailed-1(En1)的激活來(lái)抑制瘢痕形成�����。實(shí)驗(yàn)表明�����,PF-MNs在急性和慢性傷口的小鼠模型中均可促進(jìn)無(wú)瘢痕傷口修復(fù)�����,并在兔耳模型中抑制增生性疤痕的形成��。相關(guān)工作以“Scarless wound healing programmed by core-shell microneedles”為題發(fā)表在Nature Communications��。
一�、PF-MNs
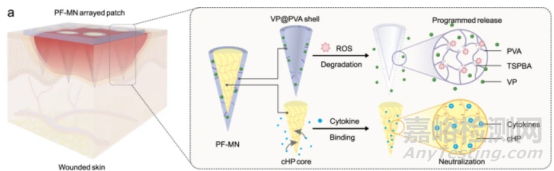
如圖1所示,在這項(xiàng)研究中���,作者所描述的核殼結(jié)構(gòu)MN貼片�,可以程序化的方式調(diào)節(jié)炎癥����、增殖和重塑階段。為了實(shí)現(xiàn)這一系列功能, 作者利用ROS可降解的聚乙烯醇(VP@PVA外殼)作為PF-MN的外殼層��,其中還負(fù)載有治療劑維替泊芬(VP)��,用于細(xì)菌抑制和傷口重塑���;而由交聯(lián)肝素(cHP內(nèi)核)作為內(nèi)核組分��,可發(fā)揮免疫調(diào)節(jié)作用�。
圖1 PF-MNs的結(jié)構(gòu)
二�����、無(wú)疤修復(fù)
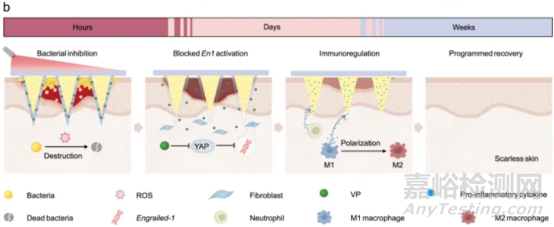
如圖2所示����,應(yīng)用于傷口后,MNs有效地破壞了細(xì)菌生物膜�����,然后嵌入的VP在激光照射下可產(chǎn)生ROS��,以根除抗生素都無(wú)法徹底相除的細(xì)菌���。隨后���,隨著炎癥階段的發(fā)展,MN外殼在氧化應(yīng)激下逐漸降解�,導(dǎo)致負(fù)載的VP釋放。釋放的VP是Yes相關(guān)蛋白(YAP)的抑制劑���,可以進(jìn)一步阻斷成纖維細(xì)胞中Engrailed-1(En1)的激活��,以促進(jìn)無(wú)瘢痕皮膚再生��。同時(shí)���,暴露的cHP核心通過(guò)結(jié)合和中和各種炎癥因子來(lái)啟動(dòng)免疫微環(huán)境的調(diào)節(jié),誘導(dǎo)巨噬細(xì)胞從M1(促炎)表型向M2(抗炎)表型分化��,促進(jìn)從炎癥向增殖的相變����。此外,免疫微環(huán)境的調(diào)節(jié)還促進(jìn)了血管生成和細(xì)胞外基質(zhì)沉積���,最終導(dǎo)致無(wú)瘢痕再生���。根據(jù)這一設(shè)計(jì)���,在急性傷口和糖尿病小鼠模型以及兔耳疤痕模型上,無(wú)瘢痕傷口愈合過(guò)程都得到了有效加速�����。
圖2 微針程序性調(diào)節(jié)微環(huán)境治療過(guò)程
原文鏈接:https://www.nature.com/articles/s41467-023-39129-6