IVDR 標簽 & 說明書
IVDR附錄II要求制造商在IVD器械的技術(shù)文檔中提供“制造商提供的信息”,一般指的是標簽和說明書�����。制造商一定要確保提供的標簽和說明書的合規(guī)性�����。
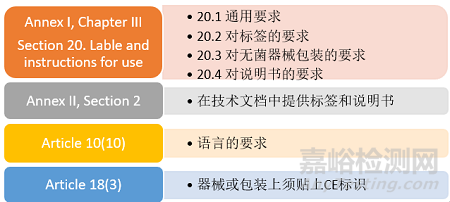
那么在IVDR法規(guī)中的哪些章節(jié)中提到了對標簽和說明書的要求呢�����?
制造商在準備標簽和說明書時,不能僅關(guān)注法規(guī)對其內(nèi)容(即識別器械與制造商�����,與用戶或任何其他人有關(guān)的任何安全和性能信息)的要求(見附錄I�����,20.2,20.3和20.4)�����,還要關(guān)注法規(guī)其他條款的要求如通用要求、語言要求等�����。本次�����,我們不對具體要求展開解讀�����,強調(diào)幾個容易被忽視的問題�����。
通用要求
雖然IVD產(chǎn)品具有多樣性�����,標簽的呈現(xiàn)方式也多種多樣�����,但還是要基于這個一般原則�����,即標簽上要求的信息應(yīng)提供在器械本身上�����。如果這不可行或不合適�����,部分或全部信息可以出現(xiàn)在每個單元的包裝上�����。如果給每個單元單獨貼全標簽不可行,則應(yīng)在多個器械的包裝上列出信息。
如何理解“在器械本身上提供信息不可行或不合適”�����?參考EN ISO 20417�����,可以給出答案:
器械的尺寸不允許將該信息固定在器械上�����;
外表面的性質(zhì)不允許將這些信息固定在器械上;或
根據(jù)ISO 14971:2019�����,省略這些標識不會對利益/風(fēng)險平衡產(chǎn)生不利影響�����。
語言要求
IVDR第10條制造商的一般義務(wù)中的第10點提到�����,說明書和標簽應(yīng)使用預(yù)期使用者或患者所在的成員國的官方語言�����,尤其是自測用途或NPT器械�����。這里又能衍生出另一個問題�����,在向公告機構(gòu)提交產(chǎn)品技術(shù)文檔時�����,文檔中是否要包含器械目標市場的所有語言的說明書和標簽�����?
答案是不需要�����。制造商應(yīng)在技術(shù)文檔中寫明器械預(yù)期上市的國家并總結(jié)出翻譯的過程�����。在產(chǎn)品上市前�����,需要將說明書和標簽翻譯成目標市場所需的所有語言�����。然而�����,只要翻譯程序有效�����,在最初提交的文件中只提供一種語言(NB所要求的語言)。
CE標志的要求
CE標志應(yīng)明顯�����、清晰和不可磨滅地貼在器械或其無菌包裝上�����。如果由于器械的性質(zhì)不可能貼上或不能保證貼上�����,則應(yīng)將CE標志貼在包裝上�����。CE標志也應(yīng)出現(xiàn)在說明書和銷售包裝上�����。IVDR第18條及附錄V中規(guī)定了使用CE的要求�����。對于企業(yè)而言�����,最重要的是要使用正確�����、合規(guī)的CE標志�����。
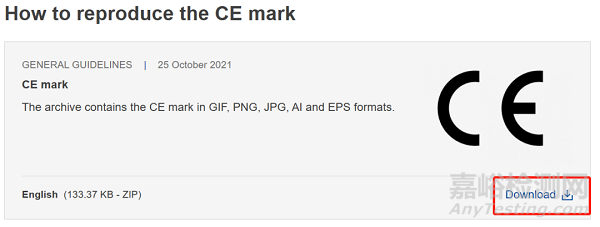
以往不少企業(yè)因為不知道CE標志的正規(guī)獲取途徑�����、為了追求美觀隨意調(diào)整CE兩個字母間距等而使用了不合規(guī)的CE標志�����,在審核或流通過程中被發(fā)現(xiàn)而引起整改活動�����。歐盟官方下載鏈接如下:
CE marking (europa.eu)
https://single-market-economy.ec.europa.eu/single-market/ce-marking_en
下載后記得檢查當前使用的CE標志是否正確。
另外�����,要格外注意�����,CE標志的各個組成部分應(yīng)具有基本相同的垂直尺寸�����,該尺寸不得小于5毫米�����。對于小型器械�����,可以免除這一最小尺寸�����。