今日頭條
加科思PARP7抑制劑獲批實(shí)體瘤臨床�����。加科思藥業(yè)口服小分子新藥PARP7抑制劑JAB-26766獲國家藥監(jiān)局批準(zhǔn),即將開展一項(xiàng)用于治療晚期實(shí)體腫瘤的Ⅰ/Ⅱ期臨床研究�����。在腫瘤中�����,PARP7的表達(dá)讓腫瘤細(xì)胞逃避衰老�����,并且避免被免疫系統(tǒng)識別和消滅�����。臨床前研究顯示�����,JAB-26766已在多種小鼠腫瘤模型中展現(xiàn)出積極的抗腫瘤活性�����;而且與其自研CD73 STING-iADCs(免疫激活性抗體偶聯(lián)藥物)聯(lián)合用藥具有開發(fā)潛力�����。
國內(nèi)藥訊
1.石藥EGFR-ADC獲快速通道資格�����。石藥集團(tuán)靶向EGFR的同類首創(chuàng)ADC藥物CPO301獲FDA授予快速通道資格�����,用于治療EGFR靶向治療無效的轉(zhuǎn)移性EGFR突變非小細(xì)胞肺癌。在臨床前研究中�����,CPO301呈劑量依賴性地抑制免疫缺陷小鼠中EGFR突變或野生型EGFR高表達(dá)的人類腫瘤的生長�����;尤其在EGFR三重突變(Exon19Del�����、T790M及C797S)的非小細(xì)胞肺癌PDX模型中具有積極的抗腫瘤效果�����;而且藥物的安全性和耐受性良好�����。
2.奧布替尼治療ITP的Ⅱ期臨床積極�����。諾誠健華在EHA年會上公布其BTK抑制劑奧布替尼治療原發(fā)免疫性血小板減少癥(ITP)的Ⅱ期臨床積極結(jié)果�����。最新數(shù)據(jù)顯示�����,有36.4%(12/33)接受奧布替尼(50mg和30mg)治療的患者達(dá)到至少連續(xù)兩次血小板計(jì)數(shù)達(dá)到≥50x109/L且近4周內(nèi)未使用過補(bǔ)救治療的主要終點(diǎn)�����;在第14周至24周隨訪期間�����,至少有4次血小板計(jì)數(shù)≥50x109/L的患者比例達(dá)到83.3%(10/12)�����。藥物總體耐受性良好�����。
3.以明LILRB4單抗血癌早期臨床積極�����。以明生物L(fēng)ILRB4單抗IO-202在單藥治療或與阿扎胞苷聯(lián)合治療復(fù)發(fā)或難治性(R/R)急性髓系白血病(AML)和慢性髓系單核細(xì)胞白血病(CMML)的Ⅰ期臨床結(jié)果積極�����。在單藥隊(duì)列(n=31)中�����,1例CMML患者獲得一年以上的臨床獲益�����,1例AML患者達(dá)到部分緩解(PR)�����。在聯(lián)合治療隊(duì)列(n=15)中�����,1例LILRB4高表達(dá)的AML患者達(dá)到完全緩解長達(dá)10個月�����。藥物總體耐受性良好�����。
4.維立志博MUC16/CD3雙抗美國獲批臨床�����。維立志博1類新藥MUC16/CD3雙特異抗體注射用LBL-033獲FDA批準(zhǔn)開展Ⅰ/Ⅱ期臨床試驗(yàn)�����,評估用于治療卵巢癌等惡性腫瘤的安全性與有效性�����。LBL-033可同時靶向表達(dá)MUC16的腫瘤細(xì)胞和表達(dá)CD3的T細(xì)胞�����,介導(dǎo)T細(xì)胞對MUC16陽性腫瘤細(xì)胞特異性殺傷�����,促進(jìn)免疫細(xì)胞因子的分泌�����,具協(xié)同抗腫瘤潛力。今年2月�����,該藥已在國內(nèi)獲批臨床�����,擬開發(fā)用于治療MUC16陽性惡性腫瘤�����。
5.誠益融資1.8億開發(fā)小分子GLP-1R激動劑�����。誠益生物宣布獲得由聯(lián)新資本�����、張科禾潤聯(lián)合領(lǐng)投的1.8億元人民幣(約2500萬美元)B輪融資�����。本輪融資將用于支持該公司擬用于治療肥胖和2型糖尿病(T2D)的小分子GLP-1R激動劑ECC5004�����,以及用于NASH和脂質(zhì)紊亂的THRβ完全激動劑ECC4703的臨床開發(fā)�����。ECC5004目前正在美國開展一項(xiàng)針對T2D適應(yīng)癥的Ⅰ期臨床�����;ECC4703目前也在美國Ⅰ期臨床中評估用于治療低密度脂蛋白升高的受試者的潛力�����。
6.兆科眼科引進(jìn)一款干眼癥醫(yī)療器械�����。兆科眼科宣布已與Eyedetec Medical公司訂立獨(dú)家許可協(xié)議�����,獲得后者一款擬用于居家治療干眼病的醫(yī)療器械Eye Lipid Mobilizer(ELM)在大中華區(qū)�����、韓國及東盟國家(文萊�����、柬埔寨�����、印度尼西亞�����、老撾�����、馬來西亞�����、緬甸�����、菲律賓、新加坡�����、泰國及越南)開發(fā)和商業(yè)化獨(dú)家權(quán)利�����。ELM旨在通過穩(wěn)定眼睛淚膜的脂質(zhì)層來減少淚液蒸發(fā)�����。目前�����,Eyedetec正在計(jì)劃向FDA提交上市申請�����。
國際藥訊
1.賽諾菲長效RSV抗體獲FDA推薦上市�����。FDA咨詢委員會推薦賽諾菲與阿斯利康開發(fā)的長效呼吸道合胞病毒(RSV)抗體Nirsevimab上市�����,用于新生兒在第一個RSV感染季預(yù)防RSV感染,F(xiàn)DUFA日期為2023年第三季度�����。臨床匯總數(shù)據(jù)顯示�����,與安慰劑相比�����,nirsevimab降低足月出生或早產(chǎn)嬰兒因RSV感染需要治療的下呼吸道感染風(fēng)險79.5%(p<0.0001)�����。去年11月�����,該新藥已在歐盟獲得全球首批�����,商品名為Beyfortus。
2.CRISPR基因編輯療法早期臨床積極�����。Editas Medicine公司基于新型Cas酶AsCas12a進(jìn)行CRISPR基因編輯開發(fā)的細(xì)胞療法EDIT-301在治療鐮狀細(xì)胞貧血病(SCD)和輸血依賴性β地中海貧血癥(TDT)的兩項(xiàng)Ⅰ/Ⅱ期臨床(RUBY和EdiTHAL)獲積極結(jié)果�����。所有4例在RUBY試驗(yàn)接受治療的患者�����,在隨訪期間均未出現(xiàn)血管閉塞性事件(VOEs)�����;其中有2例患者達(dá)到正常的血紅蛋白水平并維持長達(dá)6個月�����。在EdiTHAL試驗(yàn)首例患者中觀察到的臨床應(yīng)答與前4例RUBY試驗(yàn)患者相似�����。臨床中沒有與EDIT-301治療相關(guān)的不良事件�����。
3.吸入式基因療法早期臨床積極�����。4D Molecula公司由治療性載體A101和優(yōu)化的CFTR?R轉(zhuǎn)基因組成的候選產(chǎn)品4D-710�����,在通過氣溶膠方式給藥治療囊性纖維化肺部疾病的Ⅰ/Ⅱ期臨床AEROW獲積極中期數(shù)據(jù)�����。3例接受4D-710治療的受試者在囊性纖維化問卷調(diào)查-修訂版呼吸道癥狀評分(CFQ-R-R)測量的囊性纖維化相關(guān)生活質(zhì)量上表現(xiàn)出顯著改善�����,同時1秒用力呼氣容積的預(yù)測百分比(ppFEV1)也具有改善趨勢�����。此外�����,藥物的總體耐受性良好。
4.AR靶向口服PROTAC早期臨床積極�����。Arvinas公司靶向雄激素受體(AR)的口服PROTAC蛋白降解劑ARV-766在治療轉(zhuǎn)移性去勢抵抗性前列腺癌(mCRPC)男性患者的Ⅰ/Ⅱ期試驗(yàn)結(jié)果積極�����。在AR LBD突變的4例可評估患者中�����,ARV-766達(dá)到50%的部分緩解�����;其中有42%患者的前列腺特異性抗原(PSA)水平降低≥50%(PSA50)�����。在AR L702H突變的5例患者中有3例達(dá)到PSA50�����。臨床中未觀察到劑量限制性毒性�����。
5.PKP2相關(guān)心肌病基因療法獲孤兒藥認(rèn)定�����。Rocket公司AAV基因療法RP-A601獲FDA授予快速通道以及孤兒藥資格�����,用于治療PKP2相關(guān)致心律失常性心肌病(PKP2-ACM)�����。RP-A601旨在通過腺相關(guān)病毒(AAV.rh74)載體將含有PKP2基因的功能拷貝遞送至心肌�����,以達(dá)到一次性治愈的目的�����。目前�����,RP-A601正在Ⅰ期劑量遞增試驗(yàn)中評估用于植入式心律轉(zhuǎn)復(fù)除顫器(ICD)的PKP2-ACM成人患者中的安全性和初步療效。
6.阿斯利康超20億美元布局Treg細(xì)胞療法�����。阿斯利康與Quell公司將利用后者專有Treg細(xì)胞工程模塊專有工具箱(包括其創(chuàng)新的Foxp3 Phenotype Lock)�����,合作開發(fā)多種針對1型糖尿病(T1D)和炎癥性腸病(IBD)的工程調(diào)節(jié)性T細(xì)胞(Treg)候選產(chǎn)品�����。根據(jù)協(xié)議�����,Quell將獲得8500萬美元的預(yù)付款�����,可能超過20億美元的開發(fā)和商業(yè)化里程碑潛在付款�����,以及產(chǎn)品的銷售分成�����。此外�����,Quell保留了一項(xiàng)選擇權(quán)�����,與阿斯利康在美國共同開發(fā)T1D項(xiàng)目的Treg細(xì)胞療法�����。
醫(yī)藥熱點(diǎn)
1.甘肅:優(yōu)秀大學(xué)生村醫(yī)可入編�����。近日�����,甘肅省衛(wèi)健委�����、省委編辦等5部門印發(fā)《甘肅省關(guān)于實(shí)施大學(xué)生鄉(xiāng)村醫(yī)生專項(xiàng)計(jì)劃工作方案》,其中提出鄉(xiāng)鎮(zhèn)衛(wèi)生院應(yīng)當(dāng)拿出一定數(shù)量的崗位�����,通過事業(yè)單位公開招聘形式�����,選拔錄用優(yōu)秀的大學(xué)生鄉(xiāng)村醫(yī)生納入編制管理�����?����!斗桨浮访鞔_�����,每年5月舉辦大學(xué)生鄉(xiāng)村醫(yī)生招聘會�����,市�����、縣級衛(wèi)生健康部門到省內(nèi)醫(yī)學(xué)院校開展“鄉(xiāng)村醫(yī)生招聘月”活動�����。
2.中疾控:5月新增新冠死亡病例164例�����。6月11日�����,國家疾控中心發(fā)布全國新冠病毒感染疫情情況�����。2023年5月1日-5月31日�����,全國31個?����。ㄗ灾螀^(qū)、直轄市)及新疆生產(chǎn)建設(shè)兵團(tuán)報告新增重癥病例2777例�����、死亡病例164例(其中新冠病毒感染導(dǎo)致呼吸功能衰竭死亡病例3例�����、基礎(chǔ)疾病合并新冠病毒感染死亡病例161例)�����;主要流行株為XBB系列變異株�����,占比前三位的分別為XBB.1.9及其亞分支�����、XBB.1.16及其亞分支�����、XBB.1.5及其亞分支。
3.河北省發(fā)文推進(jìn)公立醫(yī)院薪酬制度改革�����。6月3日�����,河北省人民政府發(fā)布《河北省人民政府辦公廳印發(fā)關(guān)于進(jìn)一步完善醫(yī)療衛(wèi)生服務(wù)體系實(shí)施方案的通知》�����。在深化薪酬制度改革方面�����,《通知》明確提到到2023年底�����,全部省直公立醫(yī)院�����、50%的市級公立醫(yī)院�����、50%的縣(市�����、區(qū))至少1家縣級公立醫(yī)院落實(shí)黨委書記�����、院長年薪制�����,年薪由同級財政負(fù)擔(dān)�����。2012年�����,福建省三明市推出年薪制的政策�����,不再區(qū)分醫(yī)院等級,全部按醫(yī)務(wù)人員職稱核定基本年薪�����,基本年薪總額核定標(biāo)準(zhǔn)為:主任醫(yī)師基本年薪30萬元�����,副主任醫(yī)師基本年薪25萬元�����,主治醫(yī)師基本年薪20萬元�����,住院醫(yī)師基本年薪15萬元�����。
評審動態(tài)
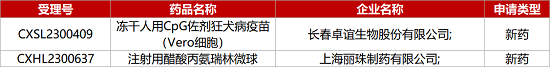
1. CDE新藥受理情況(06月12日)
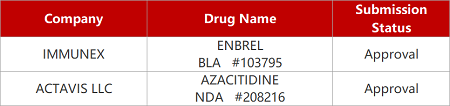
2. FDA新藥獲批情況(北美06月09日)