摘要:該文通過(guò)查閱官方文件和研究文獻(xiàn)���,梳理、分析了 FDA 復(fù)雜仿制藥注冊(cè)審評(píng)過(guò)程中的溝通機(jī)制�����,從會(huì)議目標(biāo)�����、細(xì)分類型��、申請(qǐng)審核時(shí)限和會(huì)議程序幾方面進(jìn)行闡述�����,結(jié)合本國(guó)復(fù)雜仿制藥審評(píng)審批溝通機(jī)制的現(xiàn)狀�����,對(duì)兩國(guó)復(fù)雜仿制藥審評(píng)審批溝通機(jī)制進(jìn)行對(duì)比和思考�����。FDA 復(fù)雜仿制藥溝通機(jī)制分為仿制藥上市申請(qǐng)?zhí)峤磺?Pre-abbreviated New DrugApplication���,Pre-ANDA)程序�����、書(shū)面咨詢和同步科學(xué)建議(Parallel Scientific Advice��,PSA)程序��,通過(guò)細(xì)分的會(huì)議類型充分解決了復(fù)雜仿制藥研發(fā)過(guò)程中審評(píng)審批層面的難題�����。建議本國(guó)可參考 FDA 做法���,探索多樣化的復(fù)雜仿制藥溝通機(jī)制�����,從而提高審評(píng)效率�����,加快具有臨床價(jià)值的復(fù)雜仿制藥上市���。
在開(kāi)發(fā)新靶點(diǎn)越來(lái)越難、仿制藥競(jìng)爭(zhēng)越來(lái)越大的情況下�����,對(duì)于無(wú)法承擔(dān)創(chuàng)新轉(zhuǎn)型的仿制藥企業(yè)���,復(fù)雜仿制藥正在成為一個(gè)較為優(yōu)勢(shì)的選擇[1]�����。某些復(fù)雜仿制藥���,例如一些吸入或注射產(chǎn)品���,即使在藥品專利和獨(dú)占權(quán)不再阻礙仿制藥獲得上市批準(zhǔn)之后�����,其仿制對(duì)仿制藥企業(yè)仍具有一定的挑戰(zhàn)性��,導(dǎo)致部分仿制藥領(lǐng)域缺乏競(jìng)爭(zhēng)��。鼓勵(lì)復(fù)雜仿制藥的研發(fā)可幫助仿制藥企業(yè)開(kāi)拓競(jìng)爭(zhēng)尚不充分的領(lǐng)域以提高研發(fā)回報(bào)率��。因此�����,美國(guó)食品藥品監(jiān)督管理局(FDA)已建立多種復(fù)雜仿制藥溝通模式���,以解決不同程度的研發(fā)技術(shù)問(wèn)題[2—4]��。
建立和完善復(fù)雜仿制藥溝通機(jī)制有利于提高復(fù)雜仿制藥的審評(píng)效率�����,是鼓勵(lì)復(fù)雜仿制藥研發(fā)的重要途徑���。然而���,本國(guó)復(fù)雜仿制藥的溝通機(jī)制建立尚處于初步探索階段,因此�����,本文對(duì) FDA 復(fù)雜仿制藥的溝通機(jī)制進(jìn)行梳理和分析��,以為本國(guó)復(fù)雜仿制藥溝通機(jī)制的建立提供經(jīng)驗(yàn)借鑒��。
一�����、美國(guó)復(fù)雜仿制藥審評(píng)審批溝通機(jī)制的形式
目前 FDA 對(duì)復(fù)雜仿制藥的主要溝通方式有書(shū)面咨詢�����、仿制藥上市申請(qǐng)?zhí)峤磺?Pre-abbreviated New Drug Application Program�����,Pre-ANDA Program)程序和同步科學(xué)建議(Parallel Scientific Advice,PSA)[5]�����,其中書(shū)面咨詢主要適用于已發(fā)布特定產(chǎn)品指南(Product-Specific Guidance��,PSG)的復(fù)雜仿制藥�����,且只適用于解決單個(gè)問(wèn)題或一系列密切相關(guān)的問(wèn)題���。Pre-ANDA 程序主要適用于未發(fā)布 PSG指南的復(fù)雜仿制藥,解決單獨(dú)依靠書(shū)面咨詢不能解決的問(wèn)題��。PSA 程序是為申請(qǐng)人提供同時(shí)向歐洲藥品管理局(EMA)和 FDA 舉辦溝通會(huì)議的渠道�����,可同時(shí)了解 2 個(gè)監(jiān)管機(jī)構(gòu)對(duì)相關(guān)技術(shù)問(wèn)題的建議[6—8]���。
1.1 Pre-ANDA 程序
2017 年《仿制藥使用者付費(fèi)法案Ⅱ》(Generic Drug User Fee Amendments Ⅱ�����,GDUFA Ⅱ)中提出了 Pre-ANDA 程序��。
1.1.1 Pre-ANDA 程序目標(biāo)
該程序旨在為申請(qǐng)者向 FDA 提交仿制藥上市申請(qǐng)前提供幫助��,協(xié)助申請(qǐng)者提交完整申請(qǐng)���、提高監(jiān)管機(jī)構(gòu)審評(píng)效率��、減少?gòu)?fù)雜仿制藥 ANDA 審評(píng)周期���,以達(dá)到提高復(fù)雜仿制藥可及性的目標(biāo)。對(duì)于 ANDA 申請(qǐng)人而言���,Pre-ANDA 程序是一條具有較高價(jià)值的信息資源渠道�����,通過(guò)書(shū)面溝通和會(huì)議可為申請(qǐng)者提供藥物研發(fā)協(xié)助���,以及舉辦提交申請(qǐng)前會(huì)議和中期審查周期會(huì)議,以幫助闡明產(chǎn)品研發(fā)早期和申請(qǐng)審查期間的監(jiān)管意圖��。
1.1.2 Pre-ANDA 會(huì)議類型
Pre-ANDA 會(huì)議類型包括藥物研發(fā)會(huì)議(Product development meeting���,RPM)�����、提交申請(qǐng)前會(huì)議(Pre-submission meeting���,PSM)�����、審評(píng)中期會(huì)議(Midreview cycle meeting,MRCM)���。其中�����,進(jìn)行 PSM 的要求是應(yīng)當(dāng)明確表明潛在ANDA 申請(qǐng)人是否與 FDA 舉行了藥物研發(fā)會(huì)議���,如果沒(méi)有召開(kāi)藥物研發(fā)會(huì)議,潛在 ANDA 申請(qǐng)人應(yīng)解釋為何應(yīng)當(dāng)批準(zhǔn)召開(kāi) PSM���。
1.1.3 Pre-ANDA 會(huì)議申請(qǐng)審核時(shí)限
GDUFA Ⅱ?qū)?3 種類型會(huì)議的批準(zhǔn)或拒絕設(shè)定了期限��,具體見(jiàn)表 1�����。
1.1.4 Pre-ANDA 會(huì)議程序
(1)會(huì)議申請(qǐng):復(fù)雜仿制藥的 RPM 和 PSM 的會(huì)議包(Meeting Package)應(yīng)與會(huì)議請(qǐng)求書(shū)同時(shí)提交給仿制藥辦公室(Office of Generic Drugs��,OGD)��,而且會(huì)議包還應(yīng)與會(huì)議請(qǐng)求一起以電子方式發(fā)送到藥品評(píng)價(jià)和研究中心(Center forDrug Evaluation and Research���,CDER)���。另外會(huì)議包應(yīng)包含與所申請(qǐng)的產(chǎn)品、研發(fā)階段和會(huì)議類型相關(guān)的信息��,以及幫助 FDA 回復(fù)申請(qǐng)人提出的問(wèn)題所需的任何補(bǔ)充信息���。
(2)會(huì)議請(qǐng)求的評(píng)估與答復(fù):OGD 的研究與標(biāo)準(zhǔn)辦公室(Office of Researchand Standards��,ORS)與藥品質(zhì)量辦公室(Office of Pharmaceutical Quality���,OPQ)共同確定是否批準(zhǔn) RPM 或 PSM 的請(qǐng)求。FDA 員工負(fù)責(zé)對(duì)會(huì)議包進(jìn)行評(píng)估�����,如對(duì)會(huì)議包存在疑問(wèn)可向申請(qǐng)人發(fā)送詢問(wèn)信息,申請(qǐng)人可通過(guò)信息門(mén)戶進(jìn)行回復(fù)���,評(píng)估完畢后會(huì)根據(jù) GDUFA Ⅱ批準(zhǔn)或拒絕會(huì)議請(qǐng)求并向潛在 ANDA 申請(qǐng)人答復(fù)��。
(3)發(fā)布初步書(shū)面評(píng)論:在復(fù)雜仿制藥的 RPM 或 PSM 之前��,F(xiàn)DA 會(huì)召開(kāi)內(nèi)部會(huì)議討論會(huì)議方案���,就對(duì)潛在 ANDA 申請(qǐng)人問(wèn)題的初步答復(fù)達(dá)成內(nèi)部一致。對(duì)于 RPM�����,如果 FDA 沒(méi)有向潛在 ANDA 申請(qǐng)人提供書(shū)面答復(fù)��,F(xiàn)DA 應(yīng)當(dāng)在會(huì)議前 5 天向潛在 ANDA 申請(qǐng)人的聯(lián)系人提供初步書(shū)面意見(jiàn)���。對(duì)于 PSM,如果FDA 認(rèn)為在會(huì)議前提供初步書(shū)面意見(jiàn)是合適的�����,則任何此類意見(jiàn)會(huì)在會(huì)議前 5天通過(guò)電子郵件發(fā)送給潛在 ANDA申請(qǐng)人的聯(lián)系人。潛在 ANDA申請(qǐng)人和 FDA之間的會(huì)議前溝通包括初步書(shū)面評(píng)論���,可作為討論的基礎(chǔ)�����,也可作為最終會(huì)議的回應(yīng)���。然而,除非潛在 ANDA 申請(qǐng)人和 FDA之間達(dá)成協(xié)議�����,否則初步的書(shū)面評(píng)論不應(yīng)被解釋為最終回應(yīng)���。在收到初步書(shū)面評(píng)論之后�����,潛在 ANDA 申請(qǐng)人應(yīng)提供更新后的議程��,并在預(yù)定會(huì)議前的 48 小時(shí)內(nèi)按優(yōu)先級(jí)順序提供其討論的問(wèn)題列表���。需要注意的是��,F(xiàn)DA 傳達(dá)的初步書(shū)面評(píng)論不應(yīng)引起新問(wèn)題��,并且會(huì)議上也不應(yīng)遇到新問(wèn)題���。
(4)會(huì)議的主持:復(fù)雜仿制藥的 RPM 和 PSM 會(huì)由 FDA 工作人員(通常是ORS主任或指定人員)主持,并以介紹議程聲明開(kāi)始��。一般而言��,與會(huì)者會(huì)討論潛在 ANDA 申請(qǐng)人提出的問(wèn)題和提供的數(shù)據(jù)�����,以協(xié)助其制定復(fù)雜仿制藥的研發(fā)計(jì)劃��。分配給 ANDA 的監(jiān)管項(xiàng)目經(jīng)理(Regulatory Project Manager�����,RPM)會(huì)主持MRCM�����,該會(huì)議會(huì)討論審查人員或?qū)彶閳F(tuán)隊(duì)在審查結(jié)束時(shí)發(fā)現(xiàn)的部分缺陷��,以及會(huì)議前已向潛在 ANDA 申請(qǐng)人傳達(dá)的缺陷��。
(5)會(huì)議過(guò)程中申請(qǐng)人的陳述:RPM 過(guò)程中通常不需要潛在 ANDA 申請(qǐng)人或 ANDA 申請(qǐng)人進(jìn)行陳述��,因?yàn)閷彶楹陀懻撍璧男畔⒁炎鳛闀?huì)議包的一部分進(jìn)行了討論���。如果潛在 ANDA 申請(qǐng)人或 ANDA 申請(qǐng)人計(jì)劃做演示�����,申請(qǐng)人應(yīng)提前與 FDA 討論��,以確保在會(huì)議前準(zhǔn)備好演示材料��,且所有的陳述都應(yīng)盡量保持簡(jiǎn)短�����,從而最大限度地節(jié)省時(shí)間�����。會(huì)議時(shí)長(zhǎng)通常不會(huì)因發(fā)言而增加��,但是如果演示文稿中包含了少量與以前數(shù)據(jù)不同的內(nèi)容�����,或新增了未包含在提交給 FDA審查的原始會(huì)議包中的數(shù)據(jù)���,F(xiàn)DA 工作人員可能無(wú)法對(duì)新信息進(jìn)行及時(shí)審查���,這可能延長(zhǎng)會(huì)議時(shí)間。另外�����,F(xiàn)DA并不要求參加 MRCM的申請(qǐng)人進(jìn)行任何演示[9]���。
(6)會(huì)議紀(jì)要:在會(huì)議結(jié)束前���,F(xiàn)DA 參會(huì)者和潛在 ANDA 申請(qǐng)人或 ANDA申請(qǐng)人應(yīng)總結(jié)討論要點(diǎn)和相關(guān)協(xié)議要求。一般情況下�����,F(xiàn)DA 會(huì)要求潛在 ANDA申請(qǐng)人或 ANDA 申請(qǐng)人提交會(huì)議紀(jì)要以確保對(duì)會(huì)議結(jié)果和行動(dòng)項(xiàng)目達(dá)成相互理解�����。FDA 工作人員可在會(huì)議記錄中添加或進(jìn)一步澄清總結(jié)中未涉及的要點(diǎn)��,總結(jié)可以在會(huì)議結(jié)束時(shí)完成��,也可以在討論每個(gè)問(wèn)題后完成��。
1.2 書(shū)面咨詢
FDA 在 GDUFA Ⅱ承諾函[10]中提出�����,對(duì)于復(fù)雜仿制藥�����,F(xiàn)DA 會(huì)對(duì)標(biāo)準(zhǔn)的書(shū)面咨詢和復(fù)雜的書(shū)面咨詢進(jìn)行審查���,并做出有意義的回答��,為藥物研發(fā)或監(jiān)管決策提供信息���。書(shū)面咨詢適用于解決單個(gè)問(wèn)題或一系列密切相關(guān)的問(wèn)題,在《有關(guān)仿制藥研發(fā)的書(shū)面咨詢》(Controlled Correspondence Related to GenericDrug Development)[11]指南中提出��,F(xiàn)DA 會(huì)在提交日期后 60 天內(nèi)審查并回復(fù) 90%的標(biāo)準(zhǔn)書(shū)面咨詢,在提交日期的 120 天內(nèi)審查并回復(fù) 90%的復(fù)雜書(shū)面咨詢��,并在收到請(qǐng)求后的 14 天內(nèi)澄清書(shū)面咨詢回復(fù)中的歧義���。
1.3 PSA 程序
FDA 與 EMA 合作啟動(dòng)了一項(xiàng)試點(diǎn)計(jì)劃��,為 FDA 復(fù)雜仿制藥產(chǎn)品的 ANDA和 EMA 混合產(chǎn)品的上市授權(quán)申請(qǐng)(Marketing Authorization Applications�����,MAAs)提供科學(xué)建議[12]�����。
1.3.1 PSA 程序目標(biāo)
PSA 程序的目標(biāo)是為 EMA 和 FDA 提供一種機(jī)制��,與申請(qǐng)者共同交流雙方機(jī)構(gòu)對(duì)混合/復(fù)雜仿制藥產(chǎn)品研發(fā)階段科學(xué)問(wèn)題的看法���。PSA 程序預(yù)計(jì)從混合/復(fù)雜仿制藥產(chǎn)品的生命周期開(kāi)始就增加雙方機(jī)構(gòu)與申請(qǐng)者之間的溝通,成功的合作可能會(huì)使申請(qǐng)人更深入地了解雙方的監(jiān)管決策基礎(chǔ)���,優(yōu)化申請(qǐng)人的產(chǎn)品研發(fā)計(jì)劃��,并幫助申請(qǐng)人避免為了滿足雙方機(jī)構(gòu)需求而進(jìn)行不必要的研究���。
PSA 程序的重點(diǎn)是分享信息和觀點(diǎn)���,潛在優(yōu)勢(shì)是實(shí)現(xiàn)雙方機(jī)構(gòu)的協(xié)調(diào)和融合���,申請(qǐng)人可使用 PSA 程序來(lái)確定研究設(shè)計(jì)是否可能為 2 個(gè)監(jiān)管機(jī)構(gòu)接受��,可能受益于 PSA 程序的研究包括涉及創(chuàng)新生物等效性研究設(shè)計(jì)以及使用建模和模擬等方法的比較性非臨床和臨床研究��。在進(jìn)行 PSA 會(huì)議之后���,申請(qǐng)人會(huì)對(duì)雙方機(jī)構(gòu)各自的監(jiān)管要求和所討論的研發(fā)項(xiàng)目科學(xué)建議有更清晰的了解,如果 2 個(gè)機(jī)構(gòu)的建議有分歧�����,申請(qǐng)人會(huì)清楚地了解產(chǎn)生分歧的原因��。FDA 還公布了 EMA和 FDA 達(dá)成一致的試點(diǎn)項(xiàng)目一般原則�����,將使 PSA 程序的過(guò)程和目標(biāo)更透明���,并有助于回答有關(guān)該程序的問(wèn)題�����。PSA 會(huì)議的申請(qǐng)將根據(jù)工作量��、工作人員的可獲得性和 PSA 程序的預(yù)期價(jià)值而獲得批準(zhǔn)��。對(duì)于每個(gè)申請(qǐng)��,各機(jī)構(gòu)會(huì)關(guān)注具體發(fā)展問(wèn)題與申請(qǐng)者舉行一次三方會(huì)議���,三方會(huì)議一般為 1.5 h��,但時(shí)間會(huì)根據(jù)會(huì)議要討論的問(wèn)題數(shù)量和復(fù)雜性而延長(zhǎng)���。
1.3.2 PSA 程序會(huì)議流程
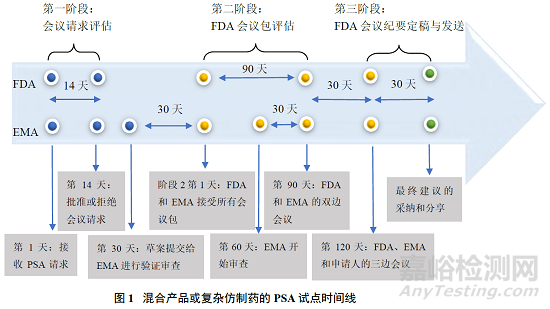
2021 年 9 月 15 日,PSA 程序試點(diǎn)開(kāi)始�����。試點(diǎn) PSA 會(huì)議流程主要可分為 3 個(gè)階段�����,申請(qǐng)人請(qǐng)求與 EMA 和 FDA 展開(kāi)會(huì)議、PSA 會(huì)議準(zhǔn)備與召開(kāi)和 EMA 和FDA 向申請(qǐng)人傳達(dá)書(shū)面答復(fù)���,下面分階段詳細(xì)論述���。
(1)第一階段——申請(qǐng)人請(qǐng)求與 EMA 和 FDA 展開(kāi)會(huì)議
一般而言,提交 PSA 會(huì)議要求的申請(qǐng)人應(yīng)將重點(diǎn)放在涉及混合產(chǎn)品或復(fù)雜仿制藥研發(fā)的特定科學(xué)問(wèn)題上���,希望從 EMA 和 FDA 獲得進(jìn)一步的科學(xué)建議。另 外 PSA 申 請(qǐng) 人 應(yīng) 當(dāng) 通 過(guò) emainternational@ema.europa.eu 向 EMA 和atpreANDAHelp@fda.hhs.gov 向 FDA 發(fā)送請(qǐng)求進(jìn)行 PSA 的信函(論證函)���,以啟動(dòng) PSA 會(huì)議���。
提交 PSA 申請(qǐng)并不能保證 PSA 會(huì)議得到批準(zhǔn),由于各種原因雙方機(jī)構(gòu)可能會(huì)拒絕參加這樣的會(huì)議��。如果申請(qǐng)人的 PSA 會(huì)議申請(qǐng)未獲批準(zhǔn)���,申請(qǐng)人可按照各機(jī)構(gòu)的正常程序��,單獨(dú)向各機(jī)構(gòu)咨詢�����,在協(xié)商咨詢過(guò)程中��,PSA 申請(qǐng)人會(huì)邀請(qǐng)任何一方一定數(shù)量的專家參加另一方機(jī)構(gòu)的討論�����。但是��,申請(qǐng)人不應(yīng)同時(shí)通過(guò) PSA 和 FDA 的 Pre-ANDA 程序提交相同的會(huì)議請(qǐng)求�����。
(2)第二階段——PSA 會(huì)議準(zhǔn)備與召開(kāi)
如果 2 個(gè)機(jī)構(gòu)都批準(zhǔn)了申請(qǐng)人的 PSA 請(qǐng)求���,則申請(qǐng)人將按照各機(jī)構(gòu)的電子郵件內(nèi)容確認(rèn)該協(xié)議并指定各機(jī)構(gòu)的主要聯(lián)系人��。申請(qǐng)人應(yīng)在提交完整會(huì)議包30 天前通過(guò) IRIS 門(mén)戶(https://iris.ema.europa.eu/)向 EMA 提交會(huì)議包草案以進(jìn)行驗(yàn)證審查和修訂��。
一旦會(huì)議包草案由 EMA 驗(yàn)證通過(guò)��,申請(qǐng)人應(yīng)通過(guò) IRIS 門(mén)戶向 EMA 和通過(guò)preandahelp@fda.hhs.gov 向 FDA 提交最終的完整會(huì)議包��。在完整的會(huì)議計(jì)劃中���,申請(qǐng)人應(yīng)提供研發(fā)計(jì)劃的簡(jiǎn)要?dú)v史和產(chǎn)品研發(fā)狀態(tài)討論的問(wèn)題列表���,根據(jù)主題分組并對(duì)每個(gè)問(wèn)題明確編號(hào)。申請(qǐng)人應(yīng)對(duì)每個(gè)問(wèn)題的背景��、目的��,以及任何支持的理由或數(shù)據(jù)進(jìn)行簡(jiǎn)要說(shuō)明��,而且會(huì)議包應(yīng)放在所有問(wèn)題的摘要列表之后�����,每個(gè)問(wèn)題后都應(yīng)有相應(yīng)的理由�����、基本原理或數(shù)據(jù)支持��。
PSA流程的第2階段通常對(duì)應(yīng)于FDA的Pre-ANDA前會(huì)議的120天時(shí)間線��,覆蓋了 EMA 科學(xué)建議工作組(Scientific Advice Working Party��,SAWP)為其科學(xué)建議流程規(guī)定的 70 天時(shí)間線���,因此這 2 個(gè)機(jī)構(gòu)目前確定的舉行科學(xué)會(huì)議的時(shí)間表可進(jìn)行適當(dāng)調(diào)整��,以與雙方機(jī)構(gòu)制定的時(shí)間線保持一致��。2個(gè)機(jī)構(gòu)的主要聯(lián)系人會(huì)商定 EMA 和 FDA 的雙邊會(huì)議和與申請(qǐng)人的三邊會(huì)議的時(shí)間���,并達(dá)成共識(shí),然后與申請(qǐng)人共享三邊會(huì)議的時(shí)間�����。雙方機(jī)構(gòu)會(huì)在三邊會(huì)議舉行前進(jìn)行雙邊電話會(huì)議或視頻會(huì)議�����,以進(jìn)一步討論申請(qǐng)人提出的問(wèn)題���。之后���,申請(qǐng)人會(huì)與 EMA和 FDA 一起參加三邊 PSA 電話會(huì)議,雙方機(jī)構(gòu)可在三邊會(huì)議之后與申請(qǐng)人進(jìn)行電話或視頻會(huì)議�����。
申請(qǐng)人和雙方機(jī)構(gòu)的電話會(huì)議或視頻會(huì)議通常安排在申請(qǐng)人提交完整會(huì)議包后 120 天左右。EMA 問(wèn)題清單和 FDA 的初步答復(fù)會(huì)在三方會(huì)議前約 14 天公布��,各機(jī)構(gòu)的指定主要聯(lián)系人會(huì)與申請(qǐng)人協(xié)調(diào)會(huì)議的后續(xù)工作���。
(3)第三階段——EMA 和 FDA 向申請(qǐng)人傳達(dá)書(shū)面答復(fù)
在經(jīng)過(guò) PSA 會(huì)議之后���,各機(jī)構(gòu)會(huì)保留其關(guān)于藥物研發(fā)和上市申請(qǐng)的單獨(dú)監(jiān)管決策。在聯(lián)合討論后各機(jī)構(gòu)的建議可能仍然不同�����,因此各機(jī)構(gòu)會(huì)根據(jù)通常的程序和時(shí)間就 PSA 會(huì)議期間提出的問(wèn)題向申請(qǐng)人提供獨(dú)立的建議��。參與 PSA 程序不應(yīng)被理解為確保任何一方機(jī)構(gòu)對(duì)上市申請(qǐng)采取任何行動(dòng)���,雙方機(jī)構(gòu)將努力提供相似的 PSA 回應(yīng)��,但是雙方機(jī)構(gòu)仍會(huì)致力于滿足各自的會(huì)議進(jìn)程和時(shí)間。另外 PSA 程序不應(yīng)對(duì)任何一個(gè)機(jī)構(gòu)滿足其個(gè)人業(yè)績(jī)期望的能力產(chǎn)生不利影響���,因此�����,這 2 個(gè)機(jī)構(gòu)都會(huì)承諾已清楚認(rèn)識(shí)到對(duì)方的國(guó)內(nèi)業(yè)績(jī)預(yù)期�����,并在安排 PSA會(huì)議時(shí)盡可能表現(xiàn)出靈活性��。
根據(jù)上述 PSA 程序 3 個(gè)階段的概述���,可總結(jié)出 EMA 與 FDA 的混合產(chǎn)品或復(fù)方仿制藥的 PSA 試點(diǎn)時(shí)間表��,如圖 1 所示��。
二��、本國(guó)復(fù)雜仿制藥審評(píng)審批溝通機(jī)制演變與建立
2016 年 6 月 2 日���,原國(guó)家食品藥品監(jiān)管總局發(fā)布的《藥物研發(fā)與技術(shù)審評(píng)溝通交流管理辦法(試行)》[13]中提出規(guī)定的溝通交流會(huì)議優(yōu)先適用于創(chuàng)新藥物、采用先進(jìn)制劑技術(shù)藥物���,以及臨床急需藥物研發(fā)的注冊(cè)申請(qǐng)的溝通交流���。未明確提到復(fù)雜仿制藥。2020 年 12 月 11 日�����,國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心發(fā)布了《藥物研發(fā)與技術(shù)審評(píng)溝通交流管理辦法》的通告(2020年第 48號(hào))[14],提出Ⅲ類會(huì)議包括復(fù)雜仿制藥��、一致性評(píng)價(jià)或再評(píng)價(jià)品種就重大研發(fā)問(wèn)題(參比制劑的選擇��、生物等效性的評(píng)價(jià)標(biāo)準(zhǔn)等)提出的溝通交流申請(qǐng)�����。Ⅲ類會(huì)議一般安排在申請(qǐng)后的 75 天內(nèi)召開(kāi)�����。雖然本國(guó)在藥物研發(fā)溝通機(jī)制的探索中逐漸開(kāi)始重視復(fù)雜仿制藥��,但是相較 FDA�����,本國(guó)復(fù)雜仿制藥溝通交流機(jī)制的相關(guān)規(guī)定仍不夠全面細(xì)致���,特別是對(duì)相關(guān)主體的職責(zé)以及一些流程化的規(guī)定仍需進(jìn)一步完善。
三��、結(jié)語(yǔ)
本國(guó)針對(duì)復(fù)雜仿制藥統(tǒng)一以Ⅲ類會(huì)議來(lái)處理,為統(tǒng)一的時(shí)限�����。FDA 專門(mén)針對(duì)復(fù)雜仿制藥細(xì)化設(shè)置了 3 種不同的會(huì)議類型���,適用于不同的情境�����,并根據(jù)不同會(huì)議類型分別設(shè)置時(shí)限��,且通過(guò)細(xì)分的會(huì)議類型�����,F(xiàn)DA 復(fù)雜仿制藥溝通機(jī)制可充分解決復(fù)雜仿制藥研發(fā)過(guò)程中的技術(shù)難題��,以鼓勵(lì)復(fù)雜仿制藥的研發(fā)��,對(duì)本國(guó)的復(fù)雜仿制藥審評(píng)溝通交流機(jī)制有諸多啟示���。目前,本國(guó)復(fù)雜仿制藥特定指南尚不完善���,注重復(fù)雜仿制藥的研發(fā)各階段的溝通交流機(jī)制的建設(shè)尤為重要��,可參考�����、借鑒 FDA 在溝通機(jī)制方面的經(jīng)驗(yàn)��,專門(mén)建立復(fù)雜仿制藥的溝通交流機(jī)制��,探索多樣化的復(fù)雜仿制藥的溝通機(jī)制��,以提高審評(píng)效率���,加快具有臨床價(jià)值的復(fù)雜仿制藥上市���。