摘要
自上世紀(jì)90年代起���,監(jiān)管機(jī)構(gòu)陸續(xù)發(fā)布相關(guān)指南�����,推動(dòng)對(duì)藥物及醫(yī)療器械與包裝材料的相容性的研究�����,相關(guān)法規(guī)亦在二十來年中逐步建立完善���,本問梳理國(guó)際國(guó)內(nèi)監(jiān)管機(jī)構(gòu)對(duì)醫(yī)療器械包材相容性的監(jiān)管法規(guī)��,結(jié)合實(shí)驗(yàn)室經(jīng)典案例深入解析�����,旨在進(jìn)一步明確醫(yī)療器械包材研究?jī)?nèi)容���。
一、研究背景
上世紀(jì)八九十年代�����,美國(guó)FDA在監(jiān)管中陸續(xù)檢測(cè)到強(qiáng)致癌物多環(huán)芳香烴(PAHs)��、致癌物亞硝胺類化合物和致敏物2-巰基苯并噻唑(2-MBT)�����,開始重視相關(guān)可提取物的報(bào)告,業(yè)界自此逐漸關(guān)注對(duì)藥物包裝材料中金屬元素含量的考察��。
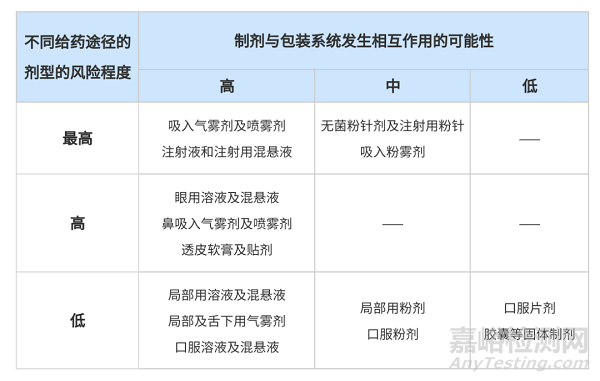
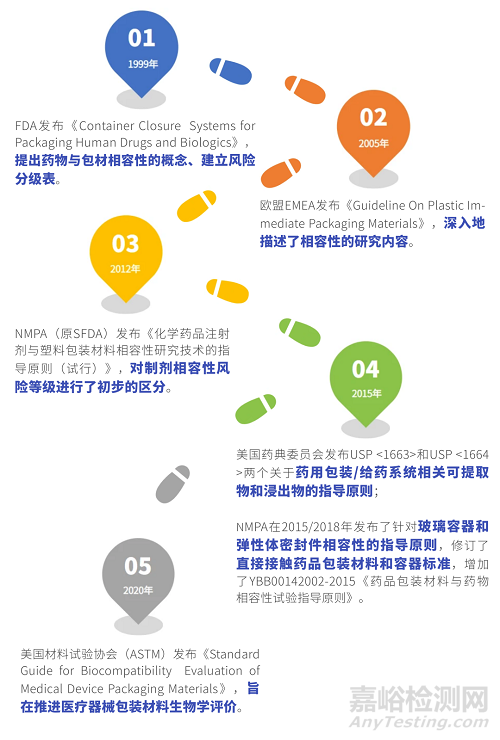
1999年���,F(xiàn)DA發(fā)布《Container Closure Systems for Packaging Human Drugs and Biologics》���,提出了藥物與包材相容性的概念,根據(jù)不同給藥途徑制劑與包裝系統(tǒng)發(fā)生相互作用的可能性建立了風(fēng)險(xiǎn)分級(jí)表(表格詳情見下文)�����。在此時(shí)期�����,藥物與包材相容性研究正式起步���。
包裝系統(tǒng)起初來源于藥品領(lǐng)域�����,其研究?jī)?nèi)容主要針對(duì)直接接觸藥品的包裝系統(tǒng)進(jìn)行闡述���。包裝系統(tǒng)一方面為藥品提供保護(hù)��,以滿足其預(yù)期的安全有效性用途�����;另一方面還應(yīng)與藥品具有良好的相容性�����,即不能引入可致安全性風(fēng)險(xiǎn)的浸出物��,或引入浸出物的水平符合安全性要求���。
standard guide for biocompatibility evaluation ofmedical device packaging materials
醫(yī)療器械包材(生物)相容性的定義來源于ASTM F2475(國(guó)內(nèi)轉(zhuǎn)化標(biāo)準(zhǔn):T/CAMDI 033-2022《醫(yī)療器械包裝材料的生物學(xué)評(píng)價(jià)指南(征求意見稿)》)���,是指材料防止所包裝醫(yī)療器械在預(yù)期應(yīng)用中對(duì)宿主產(chǎn)生不良反應(yīng)的化學(xué)變化的固有能力。
三���、醫(yī)療器械包材相容性相關(guān)法規(guī)發(fā)展
3.1 國(guó)際方面
1999年���,F(xiàn)DA發(fā)布《Container Closure Systems for Packaging Human Drugs and Biologics》,提出了藥物與包材相容性的概念�����,并建立制劑相容性風(fēng)險(xiǎn)分級(jí)表(見表1)。此表后來也被其他國(guó)家的法規(guī)(包括我國(guó)NMPA發(fā)布的三項(xiàng)指導(dǎo)原則)陸續(xù)引用��,一直沿用至今��,具有深遠(yuǎn)的影響�����。
表1 制劑相容性風(fēng)險(xiǎn)等級(jí)
——《Container Closure Systems for Packaging Human Drugs and Biologics》/《化學(xué)藥品注射劑與塑料包裝材料相容性研究技術(shù)指導(dǎo)原則(試行)》
2005年���,歐盟EMEA發(fā)布《Guideline On Plastic Immediate Packaging Materials》���,深入地描述了相容性的研究?jī)?nèi)容——提取研究和相互作用研究的原則。
2015年��,美國(guó)藥典委員會(huì)分別發(fā)布USP <1663>和USP <1664>兩個(gè)關(guān)于藥用包裝/給藥系統(tǒng)相關(guān)可提取物和浸出物的指導(dǎo)原則�����。2020年�����,美國(guó)材料試驗(yàn)協(xié)會(huì)(ASTM)發(fā)布《Standard Guide for Biocompatibility Evaluation of Medical Device Packaging Materials》��,旨在推進(jìn)醫(yī)療器械包裝材料生物學(xué)評(píng)價(jià)���。
3.2 國(guó)內(nèi)方面
2012年��,我國(guó)NMPA(原CFDA)發(fā)布了第一項(xiàng)關(guān)于包材相容性的指導(dǎo)原則——《化學(xué)藥品注射劑與塑料包裝材料相容性研究技術(shù)的指導(dǎo)原則(試行)》�����,并對(duì)制劑相容性風(fēng)險(xiǎn)等級(jí)進(jìn)行了初步的區(qū)分(見表1)��。
隨著研究水平飛速增長(zhǎng)和監(jiān)管力度的不斷加強(qiáng)�����,NMPA分別在2015年和2018年發(fā)布了針對(duì)玻璃容器和彈性體密封件相容性的指導(dǎo)原則�����,并在2015年修訂了直接接觸藥品包裝材料和容器標(biāo)準(zhǔn)��,增加了YBB00142002-2015《藥品包裝材料與藥物相容性試驗(yàn)指導(dǎo)原則》���。這些法規(guī)的發(fā)布有效地幫助國(guó)內(nèi)研究者們明確了方向��,開拓了思路�����。
整體來看��,為鼓勵(lì)企業(yè)開展科學(xué)有效的包裝材料相容性研究�����,各方監(jiān)管機(jī)構(gòu)都陸續(xù)發(fā)布了相關(guān)指南�����,旨在推進(jìn)醫(yī)療器械包裝材料生物學(xué)評(píng)價(jià)�����。在實(shí)用過程中配合好就可以實(shí)現(xiàn)優(yōu)勢(shì)互補(bǔ)��,更高效地指導(dǎo)研究?jī)?nèi)容,為產(chǎn)品申報(bào)及質(zhì)量控制提供科學(xué)全面的資料��。
四���、醫(yī)療器械包裝材料及其審評(píng)關(guān)注點(diǎn)
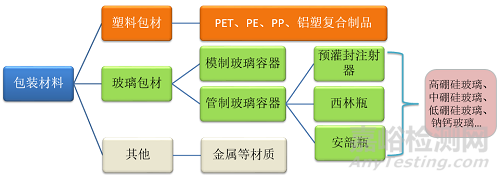
醫(yī)療器械包裝材料與藥包材基本一樣�����,根據(jù)材質(zhì)的不同�����,通?��?煞譃樗芰习?����、玻璃包材等�����。
根據(jù)材質(zhì)的不同��,在相容性評(píng)估過程中的審評(píng)關(guān)注點(diǎn)也是不同的:
玻璃
重點(diǎn)考察玻璃中堿性離子的釋放對(duì)器械pH的影響��、有害金屬元素的釋放��、玻璃的脫片的微觀形貌及重點(diǎn)元素含量��、塑料對(duì)醫(yī)療器械的吸附等作用��、膠塞中的特殊化合物等問題��。
塑料
重點(diǎn)考察醫(yī)療器械酯溶性成分導(dǎo)致塑料中的添加劑加工助劑向醫(yī)療器械的轉(zhuǎn)移��;塑料中添加劑���、加工時(shí)分解產(chǎn)物對(duì)醫(yī)療器械的影響���;塑料對(duì)醫(yī)療器械的吸附等作用。
其它材質(zhì)
結(jié)合產(chǎn)品的材料���、工藝過程等�����,考慮可能存在的風(fēng)險(xiǎn)并評(píng)估���。
五、醫(yī)療器械包材相容性試驗(yàn)指南
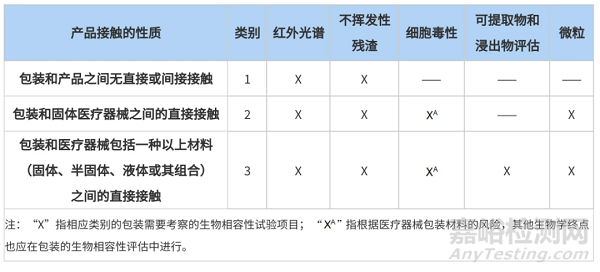
醫(yī)療器械包材相容性時(shí)需要考慮哪些內(nèi)容呢���?根據(jù)接觸情況的不同�����,ASTM F2475-20中給出了答案��。該指南中將器械與包裝材料的接觸情況進(jìn)行了分類�����,不同接觸情況推薦開展不同程度的研究?jī)?nèi)容��,詳情如下表:
表2 生物相容性試驗(yàn)指南
六�����、小結(jié)
本文簡(jiǎn)單梳理了醫(yī)療器械包材相容性研究的歷史來源��、法規(guī)及相關(guān)指導(dǎo)原則��,通過對(duì)相容性研究發(fā)展歷程的回顧�����,提示藥械伙伴及時(shí)跟進(jìn)相關(guān)的研究進(jìn)展��,特別是隨著業(yè)界對(duì)浸出物毒性認(rèn)識(shí)的不斷深入�����,相容性評(píng)估標(biāo)準(zhǔn)及安全閾值相關(guān)要求/標(biāo)準(zhǔn)也在不斷的更新�����。
在開展相容性研究時(shí)��,藥械企業(yè)需要根據(jù)不同的接觸情況評(píng)估需要開展的研究?jī)?nèi)容���。值得注意的是�����,包裝與非固體(如凝膠狀�����、膏狀��、溶液)醫(yī)療器械產(chǎn)生直接接觸時(shí)���,應(yīng)結(jié)合材質(zhì)及器械的風(fēng)險(xiǎn)�����,重點(diǎn)考慮可提取物與浸出物研究�����。建議藥械企業(yè)在研發(fā)階段就先行布局,選擇合適的包材�����,更有利于產(chǎn)品申報(bào)和后續(xù)產(chǎn)品質(zhì)量的控制��。
【參考文獻(xiàn)】
[1] Container Closure Systems for Packaging Human Drugs and Biologics
[2] Guideline On Plastic Immediate Packaging Materials
[3] 《化學(xué)藥品注射劑與塑料包裝材料相容性研究技術(shù)的指導(dǎo)原則(試行)》
[4] YBB00142002-2015《藥品包裝材料與藥物相容性試驗(yàn)指導(dǎo)原則》
[5] USP <1663> Assessment of extractables associated with pharmaceutical packaging/delivery system.
[6] USP <1664> Assessment of drug product leachables associated with pharmaceutical packaging/delivery system
[7] ASTM F2475-20, Standard guide for biocompatibility evaluation of medical device packaging materials
[8] 《化學(xué)藥品注射劑與塑料包裝材料相容性研究技術(shù)的指導(dǎo)原則(試行)》
[9] 《化學(xué)藥品注射劑與藥用玻璃包裝容器相容性研究技術(shù)指導(dǎo)原則(試行)》
[10] 《化學(xué)藥品與彈性體密封件相容性研究技術(shù)指導(dǎo)原則(試行)》
[11] 《化學(xué)藥品注射劑生產(chǎn)所用的塑料組件系統(tǒng)相容性研究技術(shù)指南(試行)》
[12] T/CAMDI 033-2022《醫(yī)療器械包裝材料的生物學(xué)評(píng)價(jià)指南年(征求意見稿)》