指南介紹
當(dāng)?shù)貢r間6月13日��,美國FDA發(fā)布了“器械軟件功能上市前提交內(nèi)容”的最新指南���,該指南取代了2005年發(fā)布的版本�,并更新了FDA推薦申辦方在上市前提交用于對器械軟件功能進行審查的文檔,基于風(fēng)險的方法的想法��。
本指南中的建議旨在促進FDA的上市前審查�。本指南描述了在軟件開發(fā)、驗證和驗證期間通常會生成和記錄的信息��。根據(jù)FDA的經(jīng)驗�����,采用了最少負擔(dān)的方法來確定通常需要的最低信息量�,以支持使用軟件器械的上市前提交。
申辦方在上市前提交的文件中納入FDA對軟件功能器械的安全性和有效性的評估�����。這種想法認可了《21st Century Cures Act (Cures Act)》最近對《FD&C法》所做的修改�,它修訂了FD&C法案的第520條,并將某些軟件功能排除在設(shè)備定義之外���。它還考慮了數(shù)字健康的快速發(fā)展的本質(zhì)�����,以及最近FDA認可的與軟件相關(guān)的共識標(biāo)準(zhǔn)�����。
本指南不適用于評估上市后軟件器械問題時可能需要的軟件相關(guān)文檔�����,包括更正和刪除���。
雖然本指南確定了申辦方應(yīng)在上市前提交中包含的文件����,但本指南并不打算提供關(guān)于如何開發(fā)��、驗證和驗證設(shè)備軟件的建議�。
本指南不建議使用任何特定的軟件生命周期模型或開發(fā)方法���。申辦方應(yīng)建立適合其產(chǎn)品和組織的軟件生命周期模型�����,并滿足適用的監(jiān)管要求�。所選的軟件生命周期模型應(yīng)涵蓋軟件的整個產(chǎn)品生命周期。
一��、文檔級別
Documentation Level
FDA打算采取基于風(fēng)險的方法來幫助確定器械的文件級別���,即Basic or Enhanced�。文檔級別的目的是幫助確定軟件功能器械的上市前提交的最小信息量��。
器械的文件級別是基于其器械軟件功能在設(shè)備的預(yù)期用途中的風(fēng)險��,因此文件級別反映了整個設(shè)備���。
為達到指南目的:
1.如果任何器械軟件功能的故障或缺陷可能會對患者�、設(shè)備用戶或使用環(huán)境中的其他人造成可能導(dǎo)致死亡或嚴重傷害的危險情況�,則應(yīng)對于器械軟件功能在內(nèi)的任何上市前提交,提供Enhanced Documentation(增強文檔)���。
在實施風(fēng)險管路之前�,應(yīng)對這些風(fēng)險進行評估����。申辦方應(yīng)考慮設(shè)備預(yù)期用途方面的風(fēng)險(例如,對安全��、治療和/或診斷的影響),以及其他相關(guān)考慮因素�。
2.對于不適用Enhanced Documentation(增強文檔)的器械軟件功能的上市前提交,應(yīng)提供Basic Documentation(基本文檔)��。
在確定Documentation Level(文檔級別)時����,申辦方應(yīng)在實施風(fēng)險管理之前考慮所有已知或可預(yù)見的軟件危害和與設(shè)備相關(guān)的危險情況,包括那些由合理可預(yù)見的誤用引起的���,無論是有意的還是無意的�。這也包括器械網(wǎng)絡(luò)安全不足而有意或無意損害器械功能的可能性���。
簡而言之���,就是要申辦方風(fēng)險評估中積極�����、全面地考慮風(fēng)險�。
雖然在本指南范圍內(nèi)的設(shè)備應(yīng)單獨評估,以確定適當(dāng)?shù)腄ocumentation Level(文檔級別)�����,但對于某些類別的設(shè)備,F(xiàn)DA建議在上市前提交中提供Enhanced Documentation(增強文檔)���。
如以下器械:用于檢測因輸血傳播感染而獻血的器械�����、用于確定獻血者和受血者相容性的器械��、用于采集供輸血或進一步生產(chǎn)使用的血液和血液成分的自動血細胞分離機器械���,以及血液機構(gòu)的計算機軟件(BECS)。
除以上產(chǎn)品外�,F(xiàn)DA認為,考慮到產(chǎn)品的性質(zhì)及其預(yù)期用途�,以下產(chǎn)品可能有獨特的風(fēng)險,需要進一步的文件�����,以確保FDA能夠評估該器械的安全性和有效性�。
包括組合器械(drug/device, biologic/device, drug/device/biologic)和III類器械。如果申辦方評估Enhanced Documentation(增強文檔)級別不適合自身產(chǎn)品,那申辦方必須提供適當(dāng)?shù)睦碛?����,說明為什么Basic Documentation(基本文檔)適合于上市前提交�。在提交審查過程中,如果需要評估器械的安全性和有效性����,F(xiàn)DA可能會要求提供額外的信息。當(dāng)然申辦方也可以通過預(yù)審核與FDA進行溝通����。
二、推薦文檔
Recommended Documentation
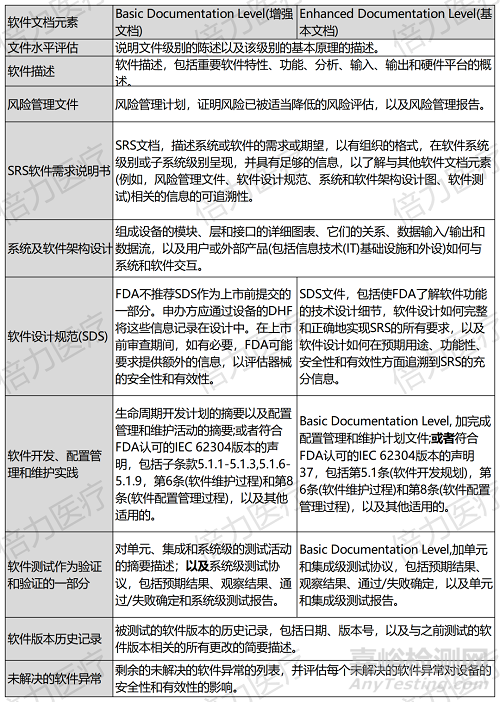
為方便申辦方更好的了解FDA對于Enhanced Documentation和Basic Documentation不同的要求�����,F(xiàn)DA也通過表格的形式進行對照���,方便大家參考了解��。
三、總結(jié)
隨著軟件發(fā)展迭代更新���,F(xiàn)DA繼續(xù)更新自己的監(jiān)管措施��,以順應(yīng)時代的更迭���。對于在2023年8月13日之前收到的提交文件的審查��,通常CDRH工作人員不要求提供本指南中概述的新的建議信息���。然而,如提交了任何該最終指南中的此類信息��,CDRH會進行審核�。近日FDA也將舉辦針對該最終指南的網(wǎng)絡(luò)研討會。