摘 要 / Abstract
目的:分析總結(jié)醫(yī)療器械注冊(cè)技術(shù)審評(píng)溝通交流問題��,探討醫(yī)療器械注冊(cè)技術(shù)審評(píng)機(jī)構(gòu)開展的溝通交流工作方式��。方法:收集2020年4月~2022年4月安徽省藥品審評(píng)查驗(yàn)中心網(wǎng)站技術(shù)咨詢欄目登記的與醫(yī)療器械注冊(cè)技術(shù)審評(píng)相關(guān)的咨詢問題���,按照問題類別進(jìn)行分類統(tǒng)計(jì)分析,歸納溝通交流存在的常見問題��,并提出改進(jìn)建議�����。結(jié)果:共收集191例咨詢問題���,其中政策咨詢類問題52例�����、技術(shù)咨詢類問題139例��。政策咨詢類問題主要涉及醫(yī)療器械法規(guī)解讀等形式性審查環(huán)節(jié)的要求��,技術(shù)咨詢類問題主要涉及注冊(cè)申報(bào)要求和技術(shù)審評(píng)標(biāo)準(zhǔn)等實(shí)質(zhì)性審查環(huán)節(jié)的要求�����。溝通交流中的常見問題包括提交的證據(jù)資料不充分���、溝通交流目的不明確和溝通交流需求不具體等��。結(jié)論:通過完善溝通交流制度���,明確需求,健全機(jī)制��,夯實(shí)能力�����,提升溝通交流針對(duì)性�����,可以確保醫(yī)療器械注冊(cè)技術(shù)審評(píng)溝通交流科學(xué)嚴(yán)謹(jǐn),取得實(shí)效�����,推動(dòng)醫(yī)療器械產(chǎn)業(yè)健康和高質(zhì)量發(fā)展���。
Objective: To analyze and summarize the communication problems of medical device registration technical evaluation, and to explore the communication methods of provincial medical device registration technical evaluation institutions. Methods: The consultation questions related to medical device registration technical evaluation registered in the technical consultation column of the website of Anhui Center for Drug Evaluation and Inspection from April 2020to April 2022 were collected, classified and statistically analyzed according to the category of these questions. Then this paper summarized the common problems in communication, and put forward suggestions for improving communication.Results: A total of 191 cases of consultation questions were collected, including 52 cases of policy consultation and 139cases of technical consultation. Policy consultation mainly involves formal review requirements such as interpretation of medical device regulations, and technical consultation mainly involves substantive review requirements such as registration and application requirements and technical evaluation standards. Common problems in communication include insufficient evidence submitted, unclear communication purpose, and unspecific communication needs. Conclusion: By improving the communication system, clarifying the needs, improving the mechanism, consolidating the ability, and improving the pertinence of communication, we can ensure that the communication of medical device registration technology evaluation is scientific and rigorous, achieving practical results, and promoting healthy and high-quality development of the medical device industry.
關(guān) 鍵 詞 / Key words:醫(yī)療器械���;技術(shù)審評(píng)��;溝通交流���;建議
medical device; technical evaluation; communication; suggestions
技術(shù)審評(píng)是醫(yī)療器械上市前注冊(cè)管理的重要技術(shù)支撐,主要依照法定程序,對(duì)擬上市醫(yī)療器械的安全��、有效和質(zhì)量可控進(jìn)行評(píng)價(jià),提出是否準(zhǔn)予注冊(cè)的建議[1]��。由于醫(yī)療器械涉及技術(shù)領(lǐng)域廣��、專業(yè)性強(qiáng),且技術(shù)審評(píng)工作涉及大量法律法規(guī)���、標(biāo)準(zhǔn)和指導(dǎo)原則等要求,因此對(duì)醫(yī)療器械技術(shù)審評(píng)人員和注冊(cè)申請(qǐng)人提出了較高的能力要求。2017年10月中共中央辦公廳���、國(guó)務(wù)院辦公廳印發(fā)的《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》[2],提出建立完善注冊(cè)申請(qǐng)人與審評(píng)機(jī)構(gòu)的溝通交流機(jī)制��?�!夺t(yī)療器械注冊(cè)與備案管理辦法》[3]第二十二條和《體外診斷試劑注冊(cè)與備案管理辦法》[4]第二十三條均規(guī)定:醫(yī)療器械專業(yè)技術(shù)機(jī)構(gòu)建立健全溝通交流制度,明確溝通交流的形式和內(nèi)容,根據(jù)工作需要組織與申請(qǐng)人進(jìn)行溝通交流�����。安徽省藥品審評(píng)查驗(yàn)中心作為負(fù)責(zé)安徽省醫(yī)療器械注冊(cè)審評(píng)工作的專業(yè)技術(shù)機(jī)構(gòu),根據(jù)審評(píng)審批制度改革精神,于2020年發(fā)布溝通交流(咨詢接待)管理規(guī)定,明確每周設(shè)立專門的現(xiàn)場(chǎng)咨詢接待日,不斷加強(qiáng)技術(shù)審評(píng)人員與注冊(cè)申請(qǐng)人的溝通交流�����。經(jīng)過3年實(shí)踐,常態(tài)化的溝通交流工作有效解決了申請(qǐng)人在醫(yī)療器械設(shè)計(jì)研發(fā)和上市注冊(cè)過程中的諸多困惑,為助推安徽省醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展起到了一定的作用���。
本文收集了2020年4月~2022年4月安徽省藥品審評(píng)查驗(yàn)中心網(wǎng)站技術(shù)咨詢欄目登記的與醫(yī)療器械注冊(cè)技術(shù)審評(píng)相關(guān)的咨詢問題,按照問題類別進(jìn)行分類統(tǒng)計(jì)分析,歸納溝通交流存在的常見問題,并提出改進(jìn)建議,以期為探索醫(yī)療器械技術(shù)審評(píng)機(jī)構(gòu)開展溝通交流工作方式提供參考���。
1、問題分析
1.1 收集的咨詢問題
2020年4月~2022年4月,共收集191例與醫(yī)療器械注冊(cè)技術(shù)審評(píng)相關(guān)的咨詢問題,其中在線咨詢31例��、現(xiàn)場(chǎng)咨詢160例��。在線咨詢形式主要有會(huì)議咨詢�����、視頻咨詢和郵件咨詢等。溝通交流對(duì)象包括注冊(cè)人/備案人��、已獲證的生產(chǎn)企業(yè)���、科研機(jī)構(gòu)�����、臨床機(jī)構(gòu)和技術(shù)咨詢服務(wù)機(jī)構(gòu)等�����。按照問題類別,咨詢問題可分為政策咨詢類問題(52例)和技術(shù)咨詢類問題(139例)。其中,政策咨詢類問題涉及首次注冊(cè)39例�����、變更注冊(cè)10例��、延續(xù)注冊(cè)3例��;技術(shù)咨詢類問題涉及首次注冊(cè)98例�����、變更注冊(cè)36例、延續(xù)注冊(cè)5例���。
1.1.1 政策咨詢類問題
政策咨詢類問題主要涉及法律法規(guī)解讀��、產(chǎn)品注冊(cè)流程��、創(chuàng)新產(chǎn)品申報(bào)��、優(yōu)先審批等醫(yī)療器械注冊(cè)管理制度合法性方面的問題���。例如,注冊(cè)申報(bào)流程和注冊(cè)總時(shí)限;技術(shù)審評(píng)程序和時(shí)限�����;提交醫(yī)療器械產(chǎn)品自檢報(bào)告與提交委托有資質(zhì)的醫(yī)療器械檢驗(yàn)機(jī)構(gòu)出具的檢驗(yàn)報(bào)告的異同��;醫(yī)療器械檢驗(yàn)機(jī)構(gòu)資質(zhì)的判定��;醫(yī)療器械產(chǎn)品分類的界定��;產(chǎn)品類別調(diào)整后如何辦理注冊(cè),分類界定文件內(nèi)容與注冊(cè)申報(bào)資料的關(guān)系��;產(chǎn)品發(fā)生何種變化時(shí)需要申請(qǐng)變更注冊(cè)���;注冊(cè)人制度下醫(yī)療器械產(chǎn)品注冊(cè)與質(zhì)量管理體系核查的關(guān)注點(diǎn)��;優(yōu)先審批產(chǎn)品的申請(qǐng)條件以及如何申報(bào)創(chuàng)新產(chǎn)品等��。
1.1.2 技術(shù)咨詢類問題
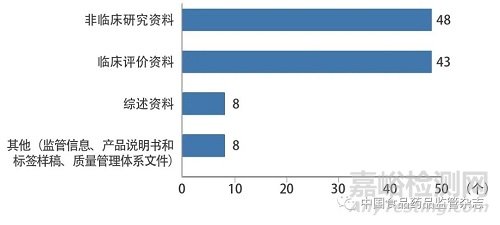
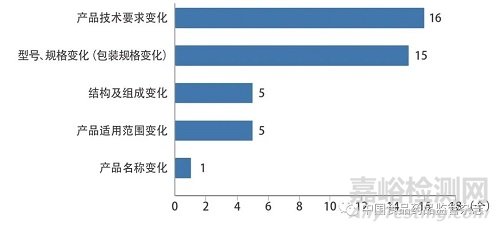
技術(shù)咨詢類問題主要涉及醫(yī)療器械(體外診斷試劑)注冊(cè)申報(bào)資料撰寫要求,注冊(cè)技術(shù)審查指導(dǎo)原則和國(guó)家標(biāo)準(zhǔn)���、行業(yè)標(biāo)準(zhǔn)的適用性等技術(shù)審評(píng)合規(guī)性方面的問題��。本文結(jié)合《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》[5]和《關(guān)于公布體外診斷試劑注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》[6]中注冊(cè)申報(bào)資料內(nèi)容框架,對(duì)咨詢較多的注冊(cè)形式問題(首次注冊(cè)和變更注冊(cè))進(jìn)行了分析,其中98例首次注冊(cè)的技術(shù)咨詢共涉及107個(gè)咨詢問題,36例變更注冊(cè)的技術(shù)咨詢共涉及42個(gè)咨詢問題,如圖1�����、圖2所示���。
圖1 首次注冊(cè)的技術(shù)咨詢類問題分布情況
圖2 變更注冊(cè)的技術(shù)咨詢類問題分布情況
首次注冊(cè)的技術(shù)咨詢類問題主要集中在非臨床研究資料和臨床評(píng)價(jià)資料。非臨床研究資料問題包括產(chǎn)品技術(shù)要求及檢驗(yàn)報(bào)告問題30個(gè),生物學(xué)研究問題7個(gè),穩(wěn)定性研究問題5個(gè),其他問題6個(gè)���。其中,產(chǎn)品技術(shù)要求及檢驗(yàn)報(bào)告問題主要包括產(chǎn)品性能指標(biāo)確定的依據(jù)、產(chǎn)品對(duì)國(guó)家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)的適用性�����、注冊(cè)技術(shù)審查指導(dǎo)原則對(duì)產(chǎn)品性能指標(biāo)的要求���、同一注冊(cè)單元典型產(chǎn)品的檢驗(yàn)報(bào)告能否覆蓋所有申報(bào)產(chǎn)品���、創(chuàng)新產(chǎn)品如何制定產(chǎn)品技術(shù)要求��、企業(yè)自定性能指標(biāo)檢測(cè)方法如何確定���、自檢報(bào)告的格式要求、產(chǎn)品型號(hào)規(guī)格的劃分原則和注意事項(xiàng)��、參照已上市同品種醫(yī)療器械產(chǎn)品性能指標(biāo)編制的產(chǎn)品技術(shù)要求是否科學(xué)等���。生物學(xué)研究問題和穩(wěn)定性研究問題主要集中在研究依據(jù)和研究方法的確定�����。臨床評(píng)價(jià)資料問題包括符合免于臨床評(píng)價(jià)的醫(yī)療器械(體外診斷試劑)的判定標(biāo)準(zhǔn)��、臨床評(píng)價(jià)資料撰寫格式和內(nèi)容���、臨床試驗(yàn)方案的設(shè)計(jì)原則、臨床試驗(yàn)樣本量的確定���、臨床試驗(yàn)對(duì)照(比)產(chǎn)品或診斷金標(biāo)準(zhǔn)的選擇�����、臨床試驗(yàn)研究評(píng)價(jià)終點(diǎn)的選擇以及如何通過已上市同品種醫(yī)療器械比對(duì)開展臨床評(píng)價(jià)���、等同性論證的標(biāo)準(zhǔn)���、臨床評(píng)價(jià)文獻(xiàn)的選取標(biāo)準(zhǔn)等。綜述資料問題和其他相關(guān)申報(bào)資料問題集中在資料撰寫的規(guī)范性要求���。
變更注冊(cè)的技術(shù)咨詢類問題主要集中在產(chǎn)品技術(shù)要求變化和型號(hào)��、規(guī)格變化(包裝規(guī)格變化)��。其中產(chǎn)品技術(shù)要求變化問題(16個(gè))主要包括變更注冊(cè)過程中是否能夠提供自檢報(bào)告��;產(chǎn)品因增加型號(hào)���、規(guī)格引起產(chǎn)品技術(shù)要求變化和如何選取典型產(chǎn)品注冊(cè)送檢;產(chǎn)品貫徹新實(shí)施的國(guó)家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)引起產(chǎn)品技術(shù)要求變化�����;產(chǎn)品性能升級(jí)引起產(chǎn)品技術(shù)要求變化等�����。型號(hào)���、規(guī)格變化(包裝規(guī)格變化)問題(15個(gè))主要集中在不引起產(chǎn)品技術(shù)要求變化是否需要進(jìn)行檢驗(yàn)�����。其他問題(11個(gè))包括產(chǎn)品結(jié)構(gòu)及組成未發(fā)生實(shí)質(zhì)性變化,如原材料供應(yīng)商發(fā)生變化是否需要申請(qǐng)變更注冊(cè)��;產(chǎn)品適用范圍未發(fā)生實(shí)質(zhì)性變化是否需要開展臨床評(píng)價(jià)���;變更產(chǎn)品適用范圍是否可以通過已上市同品種醫(yī)療器械比對(duì)途徑開展臨床評(píng)價(jià)等。
1.2 溝通交流存在的常見問題
經(jīng)統(tǒng)計(jì),溝通交流中的常見問題主要表現(xiàn)在以下兩方面:(1)提交的證據(jù)資料不充分�����。例如,咨詢臨床試驗(yàn)樣本量的確定方法時(shí),缺少樣本量估算參數(shù)的設(shè)定依據(jù)��;咨詢產(chǎn)品性能指標(biāo)確定的科學(xué)性時(shí),未提供充足的性能研究依據(jù)���;咨詢醫(yī)用電氣設(shè)備有效期確定方法時(shí),未提供產(chǎn)品的具體特征信息等���。(2)溝通交流目的不明確,溝通交流需求不具體�����。例如,主題為咨詢臨床評(píng)價(jià)路徑選擇的問題,而實(shí)際則是咨詢何種情形下產(chǎn)品能夠滿足免于臨床評(píng)價(jià)的要求��;籠統(tǒng)咨詢尚未發(fā)布注冊(cè)技術(shù)審查指導(dǎo)原則的產(chǎn)品如何確定性能指標(biāo)�����、臨床試驗(yàn)方案是否完善等���。
2、問題探討
2.1 收集的咨詢問題
2.1.1 政策咨詢類問題
近年來(lái),科技發(fā)展日新月異,醫(yī)療器械產(chǎn)業(yè)加速升級(jí),產(chǎn)品上市進(jìn)度快慢直接影響企業(yè)生存和產(chǎn)業(yè)前景,因此申請(qǐng)人十分關(guān)注上市注冊(cè)申報(bào)各環(huán)節(jié)流程和時(shí)限[7]���。2021年新修訂的醫(yī)療器械注冊(cè)相關(guān)法規(guī)陸續(xù)實(shí)施,注冊(cè)申報(bào)資料允許提交自檢報(bào)告和制定完善的臨床評(píng)價(jià)指導(dǎo)原則體系是本次相關(guān)法規(guī)修訂中涉及上市前注冊(cè)要求的重大變化��。例如,《醫(yī)療器械注冊(cè)與備案管理辦法》第三十二條和《體外診斷試劑注冊(cè)與備案管理辦法》第三十三條規(guī)定:申請(qǐng)注冊(cè)或者進(jìn)行備案提交的醫(yī)療器械產(chǎn)品檢驗(yàn)報(bào)告可以是申請(qǐng)人��、備案人的自檢報(bào)告�����;《醫(yī)療器械注冊(cè)與備案管理辦法》第三十五條和第三十六條規(guī)定進(jìn)一步明確了開展醫(yī)療器械臨床評(píng)價(jià)的原則���、要求和路徑。因此,申請(qǐng)人特別希望了解上述變化帶來(lái)的政策紅利���。此外,產(chǎn)品的類別界定及調(diào)整��、變更注冊(cè)的法規(guī)內(nèi)涵���、注冊(cè)人制度及優(yōu)先審批的政策解讀也是申請(qǐng)人關(guān)注的問題。主要是由于近年來(lái)以移動(dòng)醫(yī)療��、數(shù)字醫(yī)療和健康體檢類產(chǎn)品為代表的有源醫(yī)用電氣設(shè)備和以臨床使用為導(dǎo)向的無(wú)源手術(shù)器械產(chǎn)品申報(bào)數(shù)量逐年增多�����。經(jīng)統(tǒng)計(jì),有源醫(yī)療器械和無(wú)源醫(yī)療器械的咨詢問題為151例,申請(qǐng)人對(duì)涉及這兩類產(chǎn)品的政策背景和審評(píng)審批制度舉措的溝通交流意愿十分迫切���。安徽省藥品審評(píng)查驗(yàn)中心作為技術(shù)審評(píng)機(jī)構(gòu),主要專注于法規(guī)政策執(zhí)行層面的技術(shù)審評(píng)環(huán)節(jié),對(duì)于很多法規(guī)政策問題的解讀可能還需要通過咨詢上級(jí)注冊(cè)管理部門,再將注冊(cè)管理部門對(duì)于法規(guī)條款�����、政策文件的解釋��、意見和建議告知申請(qǐng)人���。如遇到疑難復(fù)雜或不屬于技術(shù)審評(píng)范疇問題,審評(píng)人員會(huì)第一時(shí)間告知申請(qǐng)人如何與注冊(cè)管理部門直接取得溝通聯(lián)系,以確保政策咨詢問題解答及時(shí)準(zhǔn)確���。
2.1.2 技術(shù)咨詢類問題
自2014年版《醫(yī)療器械監(jiān)督管理?xiàng)l例》修訂以來(lái),配套規(guī)章、技術(shù)性文件陸續(xù)出臺(tái),醫(yī)療器械法規(guī)體系日臻完善���。但由于對(duì)醫(yī)療器械法規(guī)和注冊(cè)申報(bào)要求的關(guān)注不及時(shí)或理解不充分,部分申請(qǐng)人在咨詢過程中常會(huì)提出已經(jīng)在法規(guī)中有明確規(guī)定或解釋的問題��。例如,申請(qǐng)人經(jīng)常咨詢注冊(cè)自檢報(bào)告格式要求和臨床評(píng)價(jià)資料的撰寫要求,而國(guó)家已出臺(tái)配套的自檢管理規(guī)定和完備的臨床評(píng)價(jià)指導(dǎo)原則文件���。此外,部分申請(qǐng)人存在對(duì)醫(yī)療健康產(chǎn)業(yè)的特殊性和風(fēng)險(xiǎn)性的認(rèn)識(shí)不足。例如,片面認(rèn)為產(chǎn)品外觀變化不屬于變更注冊(cè)范疇,未充分基于風(fēng)險(xiǎn)評(píng)估產(chǎn)品外觀變化對(duì)醫(yī)療器械安全性和有效性可能產(chǎn)生的風(fēng)險(xiǎn)�����。2021年6月1日新修訂《醫(yī)療器械監(jiān)督管理?xiàng)l例》正式實(shí)施,標(biāo)志著醫(yī)療器械監(jiān)管步入新階段�����。經(jīng)過多年的法規(guī)實(shí)踐和探索,新法規(guī)體系下醫(yī)療器械上市前注冊(cè)管理要求日趨細(xì)化,技術(shù)審評(píng)體系不斷完善��?�?紤]到密集出臺(tái)的新規(guī)定和審評(píng)理念的新變化,例如安全有效基本原則的評(píng)價(jià)標(biāo)準(zhǔn)���、臨床評(píng)價(jià)過程中的產(chǎn)品等同性論證尺度的確立��、注冊(cè)人制度的科學(xué)內(nèi)涵及變更情形的決策依據(jù)等[8],部分申請(qǐng)人很難在短期內(nèi)領(lǐng)會(huì)新法規(guī)的精髓要義和最新的審評(píng)理念,導(dǎo)致其在上市前注冊(cè)過程中存在諸多困惑��。作為技術(shù)審評(píng)機(jī)構(gòu),需要通過提前介入,靠前咨詢,不斷強(qiáng)化上市前的溝通交流力度,解答并糾正申請(qǐng)人對(duì)法規(guī)�����、標(biāo)準(zhǔn)和指導(dǎo)原則的認(rèn)識(shí)盲區(qū)和理解偏差,同時(shí)技術(shù)審評(píng)溝通過程也能強(qiáng)化審評(píng)人員對(duì)法規(guī)實(shí)踐的再認(rèn)識(shí)��。例如,《醫(yī)療器械注冊(cè)自檢管理規(guī)定》[9]明確了自檢報(bào)告的形式和內(nèi)容,從法規(guī)層面要求申請(qǐng)人提交合規(guī)的自檢報(bào)告,從執(zhí)行層面提醒審評(píng)人員要準(zhǔn)確理解《醫(yī)療器械注冊(cè)自檢管理規(guī)定》對(duì)自檢報(bào)告的要求,科學(xué)應(yīng)對(duì)法規(guī)變化,準(zhǔn)確梳理審評(píng)關(guān)注點(diǎn),統(tǒng)一審評(píng)標(biāo)準(zhǔn),確?�!夺t(yī)療器械注冊(cè)自檢管理規(guī)定》實(shí)施后技術(shù)審評(píng)工作有條不紊�����。保障相關(guān)法規(guī)的政策紅利切實(shí)惠及申請(qǐng)人,也讓溝通交流為醫(yī)療器械設(shè)計(jì)研發(fā)和質(zhì)量控制提供技術(shù)服務(wù)�����。
2.2 溝通交流存在的常見問題
醫(yī)療器械技術(shù)審評(píng)溝通交流過程中常存在一些主觀原因?qū)е鲁霈F(xiàn)咨詢無(wú)果或多次咨詢的情況���。這些主觀原因主要包括:(1)申請(qǐng)人在填寫咨詢問題時(shí)未能提供充足的支持性資料;(2)咨詢問題的關(guān)注點(diǎn)不清晰,溝通目的不明確��;(3)咨詢問題沒有關(guān)注點(diǎn),申請(qǐng)人與技術(shù)審評(píng)人員在有限的時(shí)間內(nèi)缺乏溝通交流的基礎(chǔ)。綜上,如果審評(píng)人員與申請(qǐng)人在溝通交流過程中存在信息不對(duì)稱,會(huì)造成溝通交流不能發(fā)揮應(yīng)有的作用,存在一定的局限性,直接影響咨詢效果���。特別對(duì)于優(yōu)先審批的新產(chǎn)品和創(chuàng)新產(chǎn)品,多次重復(fù)咨詢可能會(huì)影響溝通交流質(zhì)量和效率,還可能會(huì)耽誤產(chǎn)品的研發(fā)進(jìn)程���。
3、改進(jìn)建議
針對(duì)醫(yī)療器械注冊(cè)技術(shù)審評(píng)溝通交流存在的局限性和對(duì)本文收集的各類咨詢問題進(jìn)行分析,筆者建議應(yīng)基于溝通交流的針對(duì)性�����、實(shí)效性和科學(xué)性確保溝通交流質(zhì)量和效率,切實(shí)滿足人民群眾對(duì)醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展的需要�����。
3.1 明確溝通需求��,提升溝通交流的針對(duì)性
基于當(dāng)前在預(yù)約溝通交流或提交咨詢問題時(shí),申請(qǐng)人提供與問題相關(guān)的支持性證據(jù)材料準(zhǔn)備不夠充分���、申請(qǐng)人對(duì)部分技術(shù)咨詢類問題的表述過于簡(jiǎn)單籠統(tǒng)等情況,不利于審評(píng)人員及時(shí)了解申請(qǐng)人的溝通交流需求,特別是對(duì)于新研制產(chǎn)品���、創(chuàng)新產(chǎn)品臨床試驗(yàn)方案的統(tǒng)計(jì)學(xué)考量等新穎且復(fù)雜的問題,審評(píng)人員無(wú)法在短時(shí)間內(nèi)進(jìn)行充分思考或快速全面的解答,影響了溝通交流的有效性,降低了溝通交流的效率。為此,筆者建議技術(shù)審評(píng)機(jī)構(gòu)進(jìn)一步完善溝通交流(咨詢接待)制度規(guī)定,細(xì)化咨詢接待欄目的內(nèi)容和形式,適時(shí)提供醫(yī)療器械注冊(cè)技術(shù)審評(píng)咨詢案例(參考樣式),明確咨詢問題內(nèi)容的撰寫要求,確保咨詢問題主題明確���、內(nèi)容翔實(shí)���、證據(jù)充分,以提升溝通交流的針對(duì)性��。
3.2 健全溝通機(jī)制�����,推動(dòng)溝通交流取得實(shí)效
溝通交流是技術(shù)審評(píng)機(jī)構(gòu)提供咨詢服務(wù)的重要手段,完善的溝通交流制度能夠前置解決申請(qǐng)人在產(chǎn)品設(shè)計(jì)研發(fā)�����、體系核查、臨床評(píng)價(jià)和注冊(cè)申報(bào)過程中的諸多問題[10],提升產(chǎn)品上市進(jìn)度�����。建議技術(shù)審評(píng)機(jī)構(gòu)進(jìn)一步健全溝通交流機(jī)制,注重建立與申請(qǐng)人之間的溝通橋梁,特別對(duì)首次注冊(cè)和在研的創(chuàng)新產(chǎn)品,及時(shí)建立溝通咨詢檔案,強(qiáng)化咨詢問題信息反饋并適時(shí)提供跟蹤服務(wù)��。針對(duì)政策問題和疑難技術(shù)問題,建議加強(qiáng)與上級(jí)注冊(cè)管理部門��、技術(shù)專家和臨床專家的溝通,確保法規(guī)政策解讀準(zhǔn)確�����、技術(shù)解決方案符合法規(guī)要求���。此外,針對(duì)申請(qǐng)人對(duì)法規(guī)認(rèn)識(shí)不到位���、風(fēng)險(xiǎn)意識(shí)不足等問題,技術(shù)審評(píng)機(jī)構(gòu)可通過定期匯總咨詢問題�����、共性問題并通過網(wǎng)站專欄公開,引導(dǎo)申請(qǐng)人舉一反三,理解政策要領(lǐng)和審評(píng)要求�����。技術(shù)審評(píng)機(jī)構(gòu)還應(yīng)積極依托咨詢接待平臺(tái)加強(qiáng)政企交流力度,充分運(yùn)用溝通交流手段強(qiáng)化對(duì)申請(qǐng)人的相關(guān)法律法規(guī)宣貫�����。建議以普及法規(guī)精神為目標(biāo)���、以解決關(guān)切問題為導(dǎo)向、以滿足注冊(cè)申請(qǐng)人需求為牽引,持續(xù)提升醫(yī)療器械注冊(cè)技術(shù)審評(píng)咨詢工作質(zhì)量,把務(wù)實(shí)高效的溝通交流作為技術(shù)審評(píng)機(jī)構(gòu)提前介入和靠前服務(wù)的抓手,為深化醫(yī)療器械審評(píng)審批制度改革提供新動(dòng)力���。
3.3 夯實(shí)溝通能力���,確保溝通交流科學(xué)嚴(yán)謹(jǐn)
醫(yī)療器械具有學(xué)科交叉、技術(shù)更新快等特點(diǎn),高新科技的迅猛發(fā)展對(duì)審評(píng)人員的專業(yè)能力提出新挑戰(zhàn)��。但限于科學(xué)認(rèn)知、專業(yè)背景和知識(shí)結(jié)構(gòu)的差異,審評(píng)人員對(duì)同一產(chǎn)品的理解不盡相同��。隨著人工智能��、智慧醫(yī)療���、3D打印��、手術(shù)導(dǎo)航等新技術(shù)���、新療法大量涌現(xiàn),客觀上亟需提升技術(shù)審評(píng)隊(duì)伍的能力水平,打造職業(yè)化、專業(yè)化��、多學(xué)科融合的技術(shù)審評(píng)團(tuán)隊(duì)勢(shì)在必行�����。技術(shù)審評(píng)機(jī)構(gòu)應(yīng)堅(jiān)持以科學(xué)審評(píng)為目標(biāo),強(qiáng)化審評(píng)結(jié)論集體決策,統(tǒng)一審評(píng)尺度,保證技術(shù)審評(píng)和溝通交流的科學(xué)性�����、嚴(yán)謹(jǐn)性[11]��。因此,建議技術(shù)審評(píng)機(jī)構(gòu)持續(xù)優(yōu)化審評(píng)人員結(jié)構(gòu),充實(shí)不同學(xué)科的專業(yè)人才,加強(qiáng)與審批部門�����、標(biāo)準(zhǔn)管理部門���、檢驗(yàn)檢測(cè)部門��、科研院所和臨床試驗(yàn)機(jī)構(gòu)等聯(lián)系會(huì)商�����。通過開展技術(shù)審評(píng)機(jī)構(gòu)內(nèi)部法規(guī)研討,強(qiáng)制性標(biāo)準(zhǔn)���、指導(dǎo)原則解讀和臨床試驗(yàn)案例分享等多角度提升醫(yī)療器械技術(shù)審評(píng)人員的專業(yè)性,確保溝通交流科學(xué)嚴(yán)謹(jǐn),從根本上減少申請(qǐng)人在設(shè)計(jì)開發(fā)和注冊(cè)申報(bào)環(huán)節(jié)可能出現(xiàn)的政策困惑和技術(shù)難題,切實(shí)提高醫(yī)療器械技術(shù)審評(píng)質(zhì)量和效率[12]。
4��、結(jié) 語(yǔ)
本文對(duì)醫(yī)療器械技術(shù)審評(píng)機(jī)構(gòu)溝通交流工作進(jìn)行簡(jiǎn)要介紹,梳理了溝通交流過程中存在的常見問題和遇到的政策類和技術(shù)類咨詢問題,并結(jié)合新修訂醫(yī)療器械相關(guān)法規(guī)對(duì)咨詢數(shù)量較多的問題進(jìn)行了匯總分析��。通過3年咨詢接待工作實(shí)踐,安徽省藥品審評(píng)查驗(yàn)中心溝通交流制度逐步完善,特別是近年來(lái)國(guó)家鼓勵(lì)醫(yī)療器械產(chǎn)業(yè)創(chuàng)新以及企業(yè)對(duì)醫(yī)療器械研發(fā)的投入與關(guān)注,及時(shí)�����、高效�����、科學(xué)的溝通交流能夠提升醫(yī)療器械產(chǎn)品研發(fā)效率,加快醫(yī)療器械上市進(jìn)度���。在推進(jìn)醫(yī)療器械審評(píng)審批制度改革的大背景下,崇尚法治精神,踐行科學(xué)監(jiān)管理念,遵循產(chǎn)業(yè)發(fā)展規(guī)律,建立符合醫(yī)療器械特點(diǎn)的技術(shù)審評(píng)評(píng)價(jià)體系任重道遠(yuǎn)�����。希望通過持續(xù)完善溝通交流制度,改進(jìn)溝通交流方式方法,能夠不斷增進(jìn)申請(qǐng)人與技術(shù)審評(píng)人員的溝通與互信,共同推動(dòng)產(chǎn)業(yè)健康和高質(zhì)量發(fā)展��。