摘要:國家藥品監(jiān)督管理局啟動(dòng)了藥品檢查合作計(jì)劃(PIC/S)預(yù)加入申請��,將有助于完善我國藥品 GMP 標(biāo)準(zhǔn)����。《PIC/S GMP缺陷分級指南》是直接影響藥品 GMP 檢查結(jié)論的關(guān)鍵性文件��,其中許多細(xì)節(jié)要求值得我國藥品檢查機(jī)構(gòu)和檢查員關(guān)注���?��;趯Α禤IC/S GMP 缺陷分級指南》的分析,結(jié)合國內(nèi)外 GMP 缺陷分級標(biāo)準(zhǔn)規(guī)定和具體實(shí)踐���,分析了藥品 GMP 缺陷分級決策流程和風(fēng)險(xiǎn)評估��,并進(jìn)行了藥品 GMP 缺陷分級示例和案例分析�����,以促進(jìn)我國藥品 GMP 檢查進(jìn)一步與國際接軌���。
藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)的檢查是對藥品生產(chǎn)企業(yè)進(jìn)行監(jiān)督管理的重要手段����,國家藥品監(jiān)督管理局已于 2021 年 9 月正式啟動(dòng)藥品檢查合作計(jì) 劃 ( Pharmaceutical Inspection Co-operationScheme����,PIC/S)預(yù)加入申請,通過加入 PIC/S��,借鑒國際管理經(jīng)驗(yàn)����,有助于完善我國藥品GMP標(biāo)準(zhǔn),改進(jìn)我國藥品 GMP 檢查體系���,推動(dòng)藥品檢查員隊(duì)伍建設(shè)����,加強(qiáng)國際檢查交流合作����,促進(jìn)我國藥品監(jiān)管事業(yè)高質(zhì)量發(fā)展[1-2]��。在藥品 GMP 檢查中�����,缺陷的分級屬于檢查中最關(guān)鍵的內(nèi)容之一。世界衛(wèi)生組織(WHO)規(guī)定現(xiàn)場檢查發(fā)現(xiàn)嚴(yán)重缺陷時(shí)該次檢查結(jié)論為不通過��,發(fā)現(xiàn)主要缺陷(6 條以下)時(shí)需要基于整改情況確定該次檢查結(jié)論�,當(dāng)僅發(fā)現(xiàn)一般缺陷時(shí)該次檢查結(jié)論為通過[3]?����!禤IC/S GMP 缺陷分級指南》是直接影響藥品 GMP 檢查結(jié)論的關(guān)鍵性文件���,其中許多細(xì)節(jié)要求值得我國藥品檢查機(jī)構(gòu)和檢查員關(guān)注���。檢查缺陷的分級直接影響檢查的結(jié)論和后續(xù)進(jìn)一步的處理方式,因此對 PIC/S 藥品 GMP檢查缺陷分級指南的研究有助于更好地理解國際上關(guān)于藥品 GMP 缺陷分級的標(biāo)準(zhǔn)和尺度���?����;趯Α禤IC/S GMP 缺陷分級指南》的分析��,結(jié)合國內(nèi)外GMP 缺陷分級標(biāo)準(zhǔn)規(guī)定和具體實(shí)踐��,本文分析了藥品 GMP 缺陷分級決策流程和風(fēng)險(xiǎn)評估�,并進(jìn)行了藥品 GMP 缺陷分級示例和案例分析,以促進(jìn)我國藥品 GMP 檢查進(jìn)一步與國際接軌�����。
一��、《PIC/S GMP 缺陷分級指南》介紹
對藥品 GMP 檢查中發(fā)現(xiàn)的缺陷進(jìn)行分級可以形成一個(gè)關(guān)于被檢查企業(yè)的客觀結(jié)論����。統(tǒng)一、協(xié)調(diào)的缺陷分類系統(tǒng)有助于對不同檢查機(jī)構(gòu)和檢查員的發(fā)現(xiàn)問題結(jié)果的比較���,也有助于不同的檢查機(jī)構(gòu)之間檢查報(bào)告的比較和交流���。WHO、PIC/S�����、歐洲藥品監(jiān)督管局和各國藥品監(jiān)督管理機(jī)構(gòu)均建立了GMP 缺陷分級要求��,并明確了不同級別缺陷的定義,一般包括嚴(yán)重缺陷(critical deficiency)�����、主要缺陷(major deficiency)和一般缺陷(minor deficiency/other deficiency���,也可稱為其他缺陷)。各機(jī)構(gòu)之間關(guān)于不同級別缺陷的定義基本一致�����。嚴(yán)重缺陷通常定義為已經(jīng)產(chǎn)生或可能導(dǎo)致生產(chǎn)中的重大風(fēng)險(xiǎn)(包括偽造數(shù)據(jù)����、多項(xiàng)關(guān)聯(lián)主要缺陷表明某一系統(tǒng)不能有效運(yùn)行等),產(chǎn)品可能會(huì)對使用者造成危害的缺陷���;主要缺陷通常定義為與藥品 GMP 要求有較大偏離�����,在保證產(chǎn)品符合預(yù)定質(zhì)量標(biāo)準(zhǔn)�����、上市放行����、關(guān)鍵人員履職、質(zhì)量管理某一內(nèi)容存在系統(tǒng)性問題等方面的缺陷�;一般缺陷通常定義為偏離藥品 GMP要求,但尚未達(dá)到嚴(yán)重缺陷和主要缺陷程序的缺陷���,或缺少足夠信息分級將其歸類為“嚴(yán)重”或“主要”的缺陷[3-5]��。在缺陷之外�����,PIC/S��、WHO 檢查中還提出了“建議項(xiàng)”(comment/recommendation)的概念���,PIC/S 認(rèn)為個(gè)別單項(xiàng)的微小差異可不被認(rèn)為是正式缺陷,會(huì)作為建議項(xiàng)提醒生產(chǎn)企業(yè)注意�����。但在實(shí)際實(shí)踐中�,由于缺陷合并分組的因素��,明顯違背藥品GMP 規(guī)定的問題一般會(huì)作為缺陷項(xiàng)���,只有藥品GMP 沒有明確規(guī)定,但有助于企業(yè)提升質(zhì)量管理的事項(xiàng)��,或與其他發(fā)現(xiàn)的任何問題均無關(guān)聯(lián)性的特別微小的差異才會(huì)被作為建議項(xiàng)����。
藥品檢查員�、檢查機(jī)構(gòu)均按不同級別缺陷的定義對發(fā)現(xiàn)的缺陷進(jìn)行分級,PIC/S 為了更好地保證缺陷分級的標(biāo)準(zhǔn)和尺度���,發(fā)布了《PIC/S GMP 缺陷分級指南》(PI 040-1)����,進(jìn)一步對基于風(fēng)險(xiǎn)的缺陷分級原則���、缺陷分級決策樹�、缺陷分級風(fēng)險(xiǎn)因素����、缺陷分級示例等進(jìn)行了闡述和說明[6]。指南的主要章節(jié)涵蓋了 8 個(gè)部分:(1)文件歷史,該指南于 2018年 9 月 25 日獲得通過�����,于 2019 年 1 月 1 日開始生效��;(2)簡介����,該指南旨在提供一種基于風(fēng)險(xiǎn)對GMP 缺陷進(jìn)行分級的支持工具,提高缺陷分級的一致性�����,但由于缺陷分級同時(shí)需要考慮缺陷具體情形以及該場地的質(zhì)量歷史���,該指南并不具有法律約束力�����,且并不會(huì)減免企業(yè)評估該缺陷對已上市產(chǎn)品和/或其質(zhì)量體系所產(chǎn)生影響的任何責(zé)任�;(3)目的與范圍�����,旨在統(tǒng)一 GMP 缺陷的分級,促進(jìn)不同檢查機(jī)構(gòu)之間 GMP 缺陷的一致性����,同時(shí)對檢查機(jī)構(gòu)提出針對發(fā)現(xiàn)嚴(yán)重缺陷和主要缺陷時(shí)需采取的措施,以及加強(qiáng)溝通���、信息共享和科學(xué)交流��;(4)定義�,對嚴(yán)重缺陷�、主要缺陷���、一般缺陷和建議項(xiàng)進(jìn)行了解釋說明���;(5)基于風(fēng)險(xiǎn)管理原則支持對 GMP 缺陷進(jìn)行一致且客觀分級的管理工具,該部分對指南附件的使用進(jìn)行了介紹��;(6)檢查機(jī)構(gòu)針對嚴(yán)重缺陷和主要缺陷的報(bào)告應(yīng)采取的措施�,其中強(qiáng)調(diào)基于缺陷的嚴(yán)重程度應(yīng)采取適當(dāng)?shù)臋z查或監(jiān)管措施;(7)加強(qiáng)溝通�����、信息共享和科學(xué)交流,以促進(jìn)監(jiān)管評估和決策的一致性��、可預(yù)測性���,以及有關(guān)生產(chǎn)企業(yè)的安全和質(zhì)量信息的快速交流����;(8)修訂歷史����,指南還包括 3 個(gè)指導(dǎo)性附件:附件 1“基于風(fēng)險(xiǎn)管理原則,支持GMP缺陷一致性與目標(biāo)分級的管理工具”中基于嚴(yán)重缺陷�����、主要缺陷�����、一般缺陷的定義描述了 GMP 缺陷分級的決策樹與決策流程����,附件 2“關(guān)于風(fēng)險(xiǎn)增加或減少因素的解釋性指南”對常見風(fēng)險(xiǎn)增加因素和降低因素進(jìn)行了概述,附件 3“分級示例”對嚴(yán)重缺陷和主要缺陷進(jìn)行說明性(非約束性)舉例���。
二��、藥品 GMP 缺陷分級決策流程和風(fēng)險(xiǎn)評估
2.1 藥品 GMP 缺陷分級決策流程
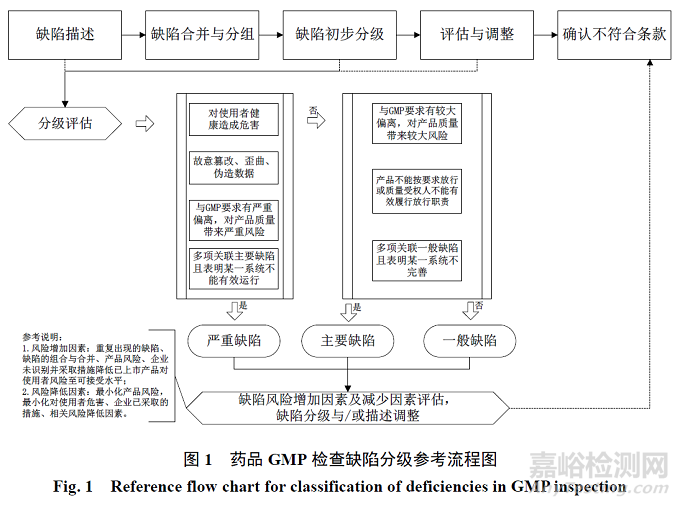
《PIC/S GMP 缺陷分級指南》發(fā)布后已成為PIC/S 成員監(jiān)管機(jī)構(gòu)和 WHO 開展藥品 GMP 檢查的重要參考標(biāo)準(zhǔn)�。PIC/S 在其 2021 年度報(bào)告中提到由于《PIC/S GMP 缺陷分級指南》已生效,其正在組織修訂對應(yīng)的檢查報(bào)告格式(PI 013-3)���,保證 PIC/S指南之間的一致性�。根據(jù)《PIC/S GMP 缺陷分級指南》規(guī)定���,結(jié)合各國關(guān)于藥品 GMP 缺陷分級的定義�����、相關(guān)要求和檢查實(shí)踐,對藥品 GMP 檢查缺陷分級決策流程進(jìn)行概述����,見圖 1。
2.1.1 缺陷描述
檢查缺陷的描述應(yīng)客觀���、準(zhǔn)確���、清晰����,可參照 WHO 關(guān)于藥品檢查不符合描述的要求�,包括標(biāo)準(zhǔn)要求(requirement)、檢查證據(jù)(evidence)和問題缺陷(deficiency)3 個(gè)部分[3]���。同時(shí)需要注意明確區(qū)分該問題是程序規(guī)定本身的缺陷�,還是未遵循程序規(guī)定產(chǎn)生的缺陷�����。當(dāng)有 1 項(xiàng)以上的缺陷涉及質(zhì)量體系同一項(xiàng)基礎(chǔ)性工作(如變更控制��、偏差處理�����、文件管理�����、設(shè)備確認(rèn)����、環(huán)境監(jiān)測等)�����,通常應(yīng)將此類缺陷進(jìn)行合并和分組�����,并作為 1 個(gè)缺陷項(xiàng)進(jìn)行缺陷分級���。在實(shí)際檢查中,通常最終完成缺陷合并��、分組和分級后確認(rèn)不符合條款(即標(biāo)準(zhǔn)要求)���。
2.1.2 缺陷分級
缺陷分級可以分為缺陷初步分級�����、評估與調(diào)整兩個(gè)環(huán)節(jié)。缺陷初步分級是基于不同級別缺陷的定義對首次缺陷項(xiàng)進(jìn)行的劃分�。存在以下任何情況的,均屬于嚴(yán)重缺陷:(1)可能對使用者健康造成危害�;(2)故意篡改、歪曲����、偽造數(shù)據(jù)的行為�����;(3)與 GMP 要求有嚴(yán)重偏離���,對產(chǎn)品質(zhì)量帶來嚴(yán)重風(fēng)險(xiǎn);(4)多項(xiàng)關(guān)聯(lián)主要缺陷總體表明某一系統(tǒng)不能有效運(yùn)行的��。其中嚴(yán)重偏離給產(chǎn)品質(zhì)量帶來嚴(yán)重風(fēng)險(xiǎn)一般包括:污染風(fēng)險(xiǎn)(特別是無菌生產(chǎn)相關(guān)的重大風(fēng)險(xiǎn))�����,交叉污染風(fēng)險(xiǎn)�����,關(guān)鍵設(shè)備�、關(guān)鍵性人員、質(zhì)量體系的重大風(fēng)險(xiǎn)�,即此項(xiàng)缺陷單獨(dú)就可能對使用者造成危害。對于數(shù)據(jù)可靠性問題����,嚴(yán)重缺陷分級考慮時(shí)需要評估該問題是否可能導(dǎo)致產(chǎn)品在其效期內(nèi)質(zhì)量不符合標(biāo)準(zhǔn)規(guī)定�����;是否存在于產(chǎn)品關(guān)鍵生產(chǎn)和檢測記錄中(如成品檢測超標(biāo)結(jié)果僅報(bào)告期望結(jié)果�,而非實(shí)際結(jié)果)�;需要重點(diǎn)分析企業(yè)相關(guān)數(shù)據(jù)管理整體情況,評估數(shù)據(jù)可靠性問題的范圍和影響�。若評估認(rèn)為不屬于嚴(yán)重缺陷,則進(jìn)行主要缺陷的評估���,存在以下任何情況的�,均屬于主要缺陷:(1)與 GMP 要求有較大偏離�����,對產(chǎn)品質(zhì)量帶來較大風(fēng)險(xiǎn)����;(2)產(chǎn)品不能按要求放行或質(zhì)量受權(quán)人不能有效履行放行職責(zé);(3)多項(xiàng)關(guān)聯(lián)一般缺陷表明某一系統(tǒng)不完善����。其中較大偏離給產(chǎn)品質(zhì)量帶來較大風(fēng)險(xiǎn)一般包括嚴(yán)重缺陷以外的,可能導(dǎo)致產(chǎn)品不符合質(zhì)量標(biāo)準(zhǔn)的缺陷��、不能確保GMP 控制措施的有效實(shí)施的缺陷��、影響產(chǎn)品質(zhì)量屬性或關(guān)鍵操作與參數(shù)或工藝設(shè)備的缺陷���、關(guān)鍵人員(如質(zhì)量控制負(fù)責(zé)人和質(zhì)量保證負(fù)責(zé)人)履職不足導(dǎo)致放行符合上市許可產(chǎn)品等較大問題的缺陷���。主要缺陷中,產(chǎn)品放行的問題通常包括不屬于嚴(yán)重缺陷的產(chǎn)品放行程序和產(chǎn)品放行實(shí)際結(jié)果方面的問題���。對于數(shù)據(jù)可靠性問題�����,主要缺陷分級考慮時(shí)需要評估確認(rèn):對產(chǎn)品有影響時(shí)��,是否屬于對使用者健康沒有風(fēng)險(xiǎn)的缺陷����;當(dāng)對產(chǎn)品沒有影響時(shí)�����,是否屬于廣泛或普遍性缺陷。需要重點(diǎn)分析企業(yè)相關(guān)數(shù)據(jù)管理整體情況����,評估數(shù)據(jù)可靠性問題的范圍和影響。若評估認(rèn)為不屬于主要缺陷��,則評級為一般缺陷��。對于數(shù)據(jù)可靠性方面的問題���,當(dāng)其對產(chǎn)品質(zhì)量沒有影響或證據(jù)有限時(shí)���,可以將其評級為一般缺陷。
缺陷初步分級后��,需要結(jié)合缺陷風(fēng)險(xiǎn)增加因素和缺陷風(fēng)險(xiǎn)減少因素開展進(jìn)一步的評估���。風(fēng)險(xiǎn)增加因素包括:(1)重復(fù)出現(xiàn)的缺陷�����,即之前檢查中發(fā)現(xiàn)的缺陷缺少適宜的糾正和預(yù)防措施�。特別是發(fā)現(xiàn)企業(yè)在對缺陷問題整改中存在隨意應(yīng)付的情況時(shí)��,通常需進(jìn)行缺陷升級。包括:未能有效識(shí)別缺陷產(chǎn)生的根本原因���、在沒有其他降低風(fēng)險(xiǎn)因素的情況下未能充分解決產(chǎn)生問題的原因、糾正措施不合理的延期等���。(2)缺陷的組合和合并���,正如缺陷分級定義所描述的,對多項(xiàng)缺陷涉及質(zhì)量體系的同一項(xiàng)基礎(chǔ)性工作時(shí)�����,通常應(yīng)將此類缺陷進(jìn)行合并和分組��,組合或合并為一個(gè)缺陷����。在缺陷初步分級后,基于缺陷的組合與合并原則��,結(jié)合缺陷的分級情況��,需要基于實(shí)際缺陷描述進(jìn)行必要的再次合并與分組���,確保缺陷分級與對應(yīng)缺陷的定義的一致性����。(3)產(chǎn)品風(fēng)險(xiǎn),指一些產(chǎn)品及其生產(chǎn)過程風(fēng)險(xiǎn)高于其余產(chǎn)品的情況��,高風(fēng)險(xiǎn)產(chǎn)品通常指在效期內(nèi)極易在生產(chǎn)工藝中受到污染的產(chǎn)品(如非最終滅菌的無菌藥品)��,低風(fēng)險(xiǎn)產(chǎn)品指在其效期內(nèi)經(jīng)由生產(chǎn)工藝污染概率很低的產(chǎn)品�����。對于一些高風(fēng)險(xiǎn)產(chǎn)品��,某些一般缺陷或主要缺陷需要升級為主要缺陷或嚴(yán)重缺陷���;對于一些低風(fēng)險(xiǎn)產(chǎn)品��,某些主要缺陷或嚴(yán)重缺陷需要降為一般缺陷或主要缺陷�����。風(fēng)險(xiǎn)減少因素包括產(chǎn)品風(fēng)險(xiǎn)因素和其他風(fēng)險(xiǎn)降低因素兩類���,其中產(chǎn)品風(fēng)險(xiǎn)因素在風(fēng)險(xiǎn)增加因素部分已描述如何進(jìn)行風(fēng)險(xiǎn)降低評級���,其他風(fēng)險(xiǎn)因素降低因素通常只有在已經(jīng)建立了可以降低相關(guān)缺陷風(fēng)險(xiǎn)的輔助或相關(guān)系統(tǒng)時(shí)考慮。
基于缺陷分級的進(jìn)一步的評估后��,每項(xiàng)缺陷的內(nèi)容已基本確定�����,最后需要對應(yīng)完善每條缺陷的法規(guī)標(biāo)準(zhǔn)依據(jù)��。
2.2藥品 GMP 缺陷分級風(fēng)險(xiǎn)評估
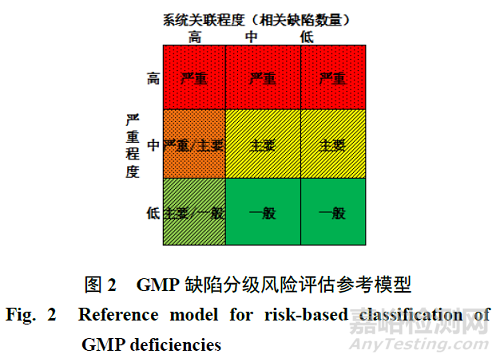
目前��,全球藥品檢查均強(qiáng)調(diào)基于風(fēng)險(xiǎn)的檢查�,但在藥品 GMP 缺陷分級方面尚未見正式的質(zhì)量風(fēng)險(xiǎn)評估工具和模型��。由于缺陷是在檢查中已被發(fā)現(xiàn)的問題����,故不適用于質(zhì)量風(fēng)險(xiǎn)管理中“可發(fā)現(xiàn)性”指標(biāo)。本研究基于藥品 GMP 缺陷分級的特殊性��,結(jié)合質(zhì)量風(fēng)險(xiǎn)管理中“嚴(yán)重性”和“發(fā)生頻次”(即涉及質(zhì)量體系的同一項(xiàng)基礎(chǔ)性工作的缺陷數(shù)����,可稱為“系統(tǒng)關(guān)聯(lián)程度”)兩個(gè)指標(biāo)構(gòu)建了藥品 GMP檢查缺陷分級風(fēng)險(xiǎn)評估參考模型(圖 2)�����。
針對嚴(yán)重程度的風(fēng)險(xiǎn)評估����,圖1 中已進(jìn)行了具體說明��,根據(jù)嚴(yán)重缺陷和主要缺陷的評定標(biāo)準(zhǔn)���,分別對應(yīng)于嚴(yán)重程度“高”和“中”風(fēng)險(xiǎn)��,此外即為“低”風(fēng)險(xiǎn)�����。針對系統(tǒng)關(guān)聯(lián)性的風(fēng)險(xiǎn)評估�����,該指標(biāo)源自對同一項(xiàng)基礎(chǔ)性工作的缺陷數(shù)�����,體現(xiàn)了此缺陷的發(fā)生頻次�,核心內(nèi)容即缺陷的合并與分組,結(jié)合當(dāng)前國內(nèi)外藥品檢查實(shí)踐�,可以考慮將涉及同一事項(xiàng)的缺陷小于等于3 條的評估為“低”,在3~5條的評估為“中”�����,5 條以上評估為“高”���。
此模型中���,對嚴(yán)重程度在理解上可能會(huì)存在差異�,以“假藥與劣藥”作為示例對嚴(yán)重程度進(jìn)行說明將有助于對缺陷分級原則的理解,任何可能或已經(jīng)導(dǎo)致上市產(chǎn)品被認(rèn)定為“假藥”(如藥品所含成分與國家藥品標(biāo)準(zhǔn)規(guī)定的成分不符)或“劣藥”(如藥品成分的含量不符合國家藥品標(biāo)準(zhǔn)����、被污染的藥品、未標(biāo)明或更改有效期的藥品等)的缺陷�,嚴(yán)重程度通常均認(rèn)定為“高”,缺陷分級一般屬于嚴(yán)重缺陷��。進(jìn)一步從注冊角度對該缺陷風(fēng)險(xiǎn)分級模型進(jìn)行舉例�����,上市后藥品的變更分為重大變更(要求進(jìn)行補(bǔ)充申請)、中等變更(要求進(jìn)行備案)和微小變更(要求進(jìn)行報(bào)告)���,如生產(chǎn)現(xiàn)場檢查發(fā)現(xiàn)企業(yè)實(shí)際已進(jìn)行了變更但未按上市后藥品的變更注冊法規(guī)規(guī)定執(zhí)行時(shí)�,對應(yīng)重大變更事項(xiàng)一般認(rèn)為屬于“高”風(fēng)險(xiǎn)(如放寬或刪除已批準(zhǔn)的質(zhì)控標(biāo)準(zhǔn))���、中等變更一般認(rèn)為屬于“中���、低”風(fēng)險(xiǎn)(如變更注射劑的包裝材料和容器的供應(yīng)商、新增檢驗(yàn)項(xiàng)目)��、微小變更一般認(rèn)為屬于“低”風(fēng)險(xiǎn)�,其中同時(shí)需要綜合考慮針對此項(xiàng)變更企業(yè)已進(jìn)行的研究工作及對產(chǎn)品質(zhì)量的影響情況。注意需要理解缺陷分級作為藥品 GMP 檢查工作的一部分���,應(yīng)當(dāng)基于檢查發(fā)現(xiàn)企業(yè)在藥品生產(chǎn)質(zhì)量管理中與 GMP 規(guī)定不符的客觀事實(shí)����,以及與產(chǎn)品質(zhì)量問題的關(guān)聯(lián)性進(jìn)行基于事實(shí)的綜合評估和分析��,如未能發(fā)現(xiàn)缺陷事實(shí)與產(chǎn)品質(zhì)量問題或注冊工作的關(guān)聯(lián)性時(shí)(缺少因果關(guān)系)�����,不應(yīng)作為檢查缺陷定級的依據(jù),但需要按有關(guān)法律法規(guī)進(jìn)行處罰��,即缺陷分級并不影響其他應(yīng)依法應(yīng)當(dāng)采取的行政處罰措施�。
三、藥品 GMP 缺陷分級示例和案例分析
3.1藥品 GMP 缺陷分級示例
缺陷分級需要基于藥品本身生產(chǎn)工藝的風(fēng)險(xiǎn)程度評估確定�����,如同一項(xiàng)缺陷內(nèi)容針對不同的產(chǎn)品風(fēng)險(xiǎn)情況可能被評估為主要缺陷或一般缺陷�����。在PIC/S 及其他國家頒布的 GMP 缺陷分級指南中�,為了讓檢查員更直觀地理解缺陷分級,均列舉了嚴(yán)重缺陷和主要缺陷的說明性示例��。在對藥品生產(chǎn)企業(yè)的檢查中���,基于藥品生產(chǎn)質(zhì)量管理 6 大系統(tǒng)的檢查是較為常見且廣受認(rèn)可的[7]。因此從 6 大系統(tǒng)角度��,對 PIC/S 指南中的缺陷示例進(jìn)行了分類��,同時(shí)參考了部分藥品監(jiān)管機(jī)構(gòu)發(fā)布的典型示例,總結(jié)了個(gè)別實(shí)際檢查中的缺陷案例���,形成了基于藥品生產(chǎn)質(zhì)量管理 6 大系統(tǒng)的嚴(yán)重和主要缺陷示例����,見表 1�����。



從6大系統(tǒng)角度對不同級別缺陷的舉例�,有助于在實(shí)際檢查中指導(dǎo)檢查員根據(jù)檢查分工與缺陷內(nèi)容對缺陷的分組和分級。在藥品檢查的實(shí)踐中��,需要基于現(xiàn)場實(shí)際情況客觀準(zhǔn)確地描述缺陷問題��,并進(jìn)行合理的合并與分組�,需要注意實(shí)際缺陷描述時(shí)在的缺陷示例基礎(chǔ)上往往還包括多項(xiàng)證明性的客觀事件描述,上述示例未考慮企業(yè)實(shí)際情況�����,僅作為說明性舉例��,并不具有約束性���。
3.2藥品 GMP 缺陷案例分析
基于關(guān)于藥品 GMP 檢查缺陷分級和描述的研究和分類示例���,從部分藥品監(jiān)管/檢查機(jī)構(gòu)的缺陷中挑選了一些典型性缺陷進(jìn)行案例分析��,通過對這些案例的分析將有助于更深入的了解缺陷的描述和分級方式��,特別是在缺陷的合并與組合方面��。
案例 1(檢查機(jī)構(gòu):WHO�����,缺陷級別:主要缺陷):生產(chǎn)工藝中關(guān)于除菌濾過發(fā)現(xiàn)的缺陷如下:A產(chǎn)品生產(chǎn)中唯一的無菌過濾點(diǎn)位于原液配制工序�,原液配制后可在塑料袋中保存最長 12 個(gè)月�����,保存期間可進(jìn)行無菌配制分裝�。(1)在 A 產(chǎn)品的配制分裝工序中缺少任何無菌過濾點(diǎn)。(2)用于原液除菌濾過后的過濾器完整性檢測程序(擴(kuò)散流)在驗(yàn)證期間未等得到正確的測試(泡點(diǎn)測試)����。使用后的完整性檢測在驗(yàn)證中對泡點(diǎn)法進(jìn)行了確認(rèn)���,但日常生產(chǎn)中確依據(jù)過濾器廠家報(bào)告標(biāo)準(zhǔn)使用了擴(kuò)散流法�����。在案例 1 中����,包括 2 項(xiàng)與除菌濾過相關(guān)的問題,結(jié)合產(chǎn)品實(shí)際生產(chǎn)工藝情況和產(chǎn)品特性分析��,其中問題 1 單獨(dú)已可作為主要缺陷��,但基于相同問題合并原則����,缺陷描述中將問題 1 與問題 2 合并后作為一條缺陷。即當(dāng)檢查發(fā)現(xiàn)某一項(xiàng)問題單獨(dú)即可作為嚴(yán)重缺陷或主要缺陷時(shí)����,仍需將檢查發(fā)現(xiàn)的與其相關(guān)的其他問題合并作為一條缺陷,且需要注意在缺陷內(nèi)部排序方面應(yīng)當(dāng)根據(jù)問題嚴(yán)重程度按序排列����。
案例 2(檢查機(jī)構(gòu):美國 FDA,缺陷級別:嚴(yán)重缺陷):未遵循實(shí)驗(yàn)室控制程序:企業(yè)在高效液相色譜(HPLC)和氣相色譜(GC)的電子數(shù)據(jù)方面存在嚴(yán)重偏離實(shí)驗(yàn)室控制程序規(guī)定和藥品生產(chǎn)質(zhì)量管理規(guī)范的情況��。在銷售 X 的中間產(chǎn)品和原料藥產(chǎn)品中發(fā)現(xiàn)了以下類型的數(shù)據(jù)篡改行為:(1)20XX 年 X 月 X 日或之后,企業(yè)的檢驗(yàn)員將 GC 電腦時(shí)間修改至 201X 年進(jìn)行檢測�����,偽造了至少 6 個(gè)穩(wěn)定性試驗(yàn)樣品(時(shí)間點(diǎn))殘留溶劑的檢測結(jié)果�����。涉及 4 批銷售至 XX 的原料藥��。此外���,企業(yè)的檢驗(yàn)員為了獲得報(bào)告中合格的結(jié)果進(jìn)行了多次進(jìn)樣�����,并永久的刪除了其中不符合預(yù)期或不合格的結(jié)果��。如批號為#JP00X 原料藥 A 長期穩(wěn)定性試驗(yàn)����,在 12 個(gè)月時(shí)間點(diǎn)時(shí)的殘留溶劑 GC 檢測中檢驗(yàn)員將 GC 的電腦時(shí)間調(diào)回到 201X 年 X 月 X 日���,偽造穩(wěn)定性試驗(yàn)結(jié)果���。還使用上述方法偽造了其他穩(wěn)定性結(jié)果,包括批號#JP00A�����、#JP00B�����、#JP00C�、#JP00D、#JP00E原料藥 A 長期穩(wěn)定性試驗(yàn)(25 ℃/65%相對濕度)在 6�����、12�、36、24�����、18 個(gè)月時(shí)間點(diǎn)時(shí)的殘留溶劑GC 檢測���。(2)樣品檢測過程中發(fā)現(xiàn)將要出現(xiàn)不符合預(yù)期或不合格的結(jié)果時(shí)即中止檢測�����,造成無法創(chuàng)建永久性數(shù)據(jù)文件��,而臨時(shí)儲(chǔ)存器中數(shù)據(jù)被刪除�����。檢驗(yàn)員修改 HPLC 計(jì)算機(jī)的時(shí)間��,并重復(fù)檢測�����,直至獲得預(yù)期結(jié)果����。當(dāng)檢驗(yàn)員中止檢測時(shí),企業(yè)的軟件未設(shè)置自動(dòng)創(chuàng)建結(jié)果文件����。在檢查 A 原料藥粗品雜質(zhì)檢測(HPLC)的審計(jì)追蹤時(shí)發(fā)現(xiàn),檢驗(yàn)員在完成樣品進(jìn)樣檢測前經(jīng)常中止進(jìn)行中的檢測���。檢驗(yàn)人員多次修改控制 HPLC 的計(jì)算機(jī)時(shí)間重復(fù)檢測���,直至獲得可接受或符合的結(jié)果����。如在批號為#CP00A原料藥粗品18個(gè)月室溫穩(wěn)定性試驗(yàn)的雜質(zhì)HPLC 檢測中�����,201X 年 X 月 X 日 10:04 進(jìn)行第 1針進(jìn)樣檢測�,29 min 后 10:33 時(shí)中止了該檢測(運(yùn)行時(shí)間=30 min)���,未創(chuàng)建結(jié)果文件����,將 HPLC 的電腦時(shí)間改為 10:05�,進(jìn)行第 2 針進(jìn)樣檢測,并報(bào)告這次檢測結(jié)果����。3.所有 A 原料藥 HPLC 的電子檢測數(shù)據(jù)(含量和雜質(zhì))均無法檢查。質(zhì)量部門解釋其“丟失”了每半年一次備份的所有備份件(DVD 光盤)�����。這導(dǎo)致無法判斷銷售至 X 的 A 原料藥質(zhì)量檢測結(jié)果。案例 2 是典型的嚴(yán)重?cái)?shù)據(jù)可靠性缺陷����,通過對質(zhì)量控制實(shí)驗(yàn)室深入檢查,將企業(yè)存在的所有涉及操縱數(shù)據(jù)的問題進(jìn)行客觀事實(shí)描述與合并的基礎(chǔ)上�,對問題的行為也進(jìn)行了總結(jié)概括。對于數(shù)據(jù)可靠性問題的檢查及其缺陷分析已包括在之前的研究中[10-11]��。需要注意的是此類缺陷中對具體發(fā)現(xiàn)問題詳細(xì)��、客觀的描述��,以及必要的總結(jié)概括�����,重點(diǎn)區(qū)別真實(shí)性與規(guī)范性差異��,結(jié)合缺陷對產(chǎn)品質(zhì)量的影響程度和范圍進(jìn)行綜合分析�����。針對本實(shí)例��,需要注意美國 FDA 的缺陷表(483 表格)中通常不包括缺陷分級[8],ECA 有關(guān)報(bào)道中也提及美國 FDA不對缺陷進(jìn)行分級[9]����,但美國 FDA 工作人員曾表示其內(nèi)部工作程序中包括缺陷的分級,上述缺陷的分級為作筆者依據(jù)缺陷分級原則進(jìn)行的劃分��。
案例 3(檢查機(jī)構(gòu):日本 PMDA����,缺陷級別:一般缺陷):在原材料倉庫發(fā)現(xiàn)企業(yè)在蟲害控制方面存在以下問題:(1)墻與門之間存在縫隙���,飛蟲與爬蟲可以輕易進(jìn)入倉庫���。且由于蟲害控制設(shè)施靠門安裝,其產(chǎn)生的燈光通過門與墻之間的縫隙照射到倉庫外部�����,可能吸引倉庫外部的昆蟲進(jìn)入倉庫���。(2)在倉庫內(nèi)使用的木質(zhì)托盤上發(fā)現(xiàn)了蜘蛛網(wǎng)���。(3)盡管對捕獲到的昆蟲進(jìn)行了監(jiān)測�,但未建立行動(dòng)限度�����。該缺陷案例中�,針對原材料倉庫發(fā)現(xiàn)在蟲害控制方面發(fā)現(xiàn)了所有問題進(jìn)行了合并,其中包括現(xiàn)場檢查發(fā)現(xiàn)的不符合現(xiàn)象�����,也包括程序文件規(guī)定內(nèi)容�����。
案例 4(檢查機(jī)構(gòu):歐洲 EDQM���,缺陷級別:主要缺陷):變更控制管理方面發(fā)現(xiàn)了以下觀察項(xiàng):(1)關(guān)于某項(xiàng)分析方法的變更控制(CC-XXX)中:(a)在 1.2 節(jié)“提出變更”部分未清晰描述具體需要實(shí)施的變更����。該部分描述到對 A 品種的中間體和產(chǎn)品將有多個(gè)與分析方法相關(guān)的變更�,但有大量變更未描述���,如在有關(guān)物質(zhì) HPLC 分析方法中取消樣品溶液稀釋操作。(b)在 2.3 節(jié)“變更行動(dòng)計(jì)劃”部分未識(shí)別到需要進(jìn)行的分析方法驗(yàn)證���,進(jìn)而導(dǎo)致未開展分析方法驗(yàn)證��。唯一能提供的文件是使用 2種方法對穩(wěn)定性樣品進(jìn)行測試的“等效性報(bào)告”���。(c)變更控制文件與相關(guān)文件“A 品種有關(guān)物質(zhì)分析方法變更證明”之間未進(jìn)行交叉索引。(2)關(guān)于產(chǎn)品 C 的生產(chǎn)中:(a)發(fā)現(xiàn)變更控制(CC-001 和CC-002)中未能提供充分的信息說明決定采用更高容量的設(shè)備仍適用于其預(yù)期用途��。如缺少關(guān)于鏈接���、物料、功能�����、溶劑與媒介等信息�����。此外��,缺少變更設(shè)備的對比信息表。(b)由于干燥設(shè)備容量較小���,導(dǎo)致濕物料必須分為 2 個(gè)部分���,并分別進(jìn)行干燥。變更控制文件中沒有強(qiáng)調(diào)這部分內(nèi)容及其任何潛在的風(fēng)險(xiǎn)��。(3)關(guān)于變更控制程序(編號:QA-XXX):(a)范圍未包括涉及計(jì)算機(jī)化系統(tǒng)的變更(如軟件升級等)�����;(b)文件中未能提供當(dāng)引入新產(chǎn)品時(shí)需要進(jìn)行哪些風(fēng)險(xiǎn)評估的充分說明�。此問題也在20XX 年引入新產(chǎn)品 A 的變更控制(CC-003)中觀察到。在案例 4 中�����,將檢查在變更控制方面發(fā)現(xiàn)的程序規(guī)定和多個(gè)變更控制事件中存在的多項(xiàng)問題進(jìn)行了合并與分組���,進(jìn)而認(rèn)為該企業(yè)變更控制系統(tǒng)不完善���,與 GMP 要求有較大偏離,最終分級為主要缺陷���。對于變更控制��、偏差處理����、超標(biāo)與超常結(jié)果處理、糾正與預(yù)防措施�����、投訴管理等質(zhì)量管理系統(tǒng)的各要素均可參照此缺陷描述方式����,將企業(yè)在對于程序文件規(guī)定、具體處理事例和記錄中存在的不足進(jìn)行合并����,并分組作為一條缺陷提出���。根據(jù)實(shí)際情況�����,也可考慮從質(zhì)量保證系統(tǒng)角度將發(fā)現(xiàn)的缺陷進(jìn)行合并��,針對質(zhì)量保證系統(tǒng)提出一條缺陷����。
從上述缺陷實(shí)例可以發(fā)現(xiàn),缺陷的合并與組合在國際藥品監(jiān)管/檢查機(jī)構(gòu)開展的檢查中已廣泛使用���,隨著我國藥品檢查與國際藥品檢查進(jìn)一步接軌�,此方面的內(nèi)容在 GMP 符合性等生產(chǎn)企業(yè)相關(guān)檢查中將持續(xù)得到加強(qiáng)��。其中需注意在缺陷的合并與組合中���,當(dāng)同一缺陷問題與多個(gè)方面相關(guān)時(shí)��,應(yīng)基于實(shí)際缺陷分級情況進(jìn)行適宜的分組��,既突出問題的嚴(yán)重程度�����,又能保證缺陷分級的科學(xué)性和客觀性���。
四、結(jié)語
缺陷分級是藥品 GMP 檢查工作中最重要的環(huán)節(jié)之一��,為了保證該項(xiàng)工作的科學(xué)、合理����,多數(shù)國家藥品檢查機(jī)構(gòu)都具有 GMP 缺陷的最終決定權(quán),現(xiàn)場檢查組在末次會(huì)上將會(huì)明確告知企業(yè)現(xiàn)場檢查期間的缺陷分級僅是檢查組的初步判斷�����,最終缺陷情況將由藥品檢查機(jī)構(gòu)最終決定�����。GMP 缺陷的分級往往決定了檢查的結(jié)果��,統(tǒng)一的分級標(biāo)準(zhǔn)和原則是保證不同藥品檢查機(jī)構(gòu)及檢查員缺陷分級一致性的前提和基礎(chǔ)�。本文以 PIC/S GMP 缺陷分級指南為基礎(chǔ),結(jié)合國內(nèi)外法規(guī)規(guī)定和具體實(shí)踐�����,對基于風(fēng)險(xiǎn)的 GMP 缺陷分級方法�����、流程和原則進(jìn)行了分析和探討����,以期為我國制藥行業(yè)和藥品檢查機(jī)構(gòu)更好地理解國際藥品 GMP 檢查缺陷分級標(biāo)準(zhǔn)提供參考,為促進(jìn)與國際藥品檢查工作的進(jìn)一步接軌提供基礎(chǔ)信息���。