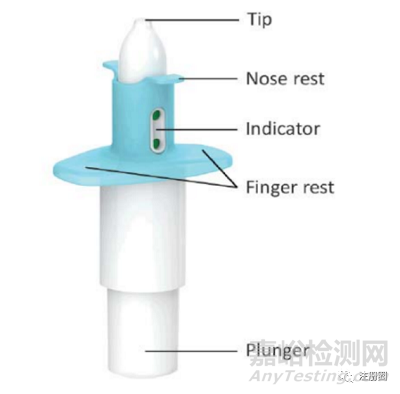
近日J(rèn)ANSSEN PHARMS宣布,旗下的鹽酸艾司氯胺酮鼻噴霧劑(速開朗�,SPRAVATO®���,英文通用名:Esketamine Hydrochloride Nasal Spray)獲得國家藥品監(jiān)督管理局(CDE)上市許可批準(zhǔn),用于與口服抗抑郁藥聯(lián)合���,緩解伴有急性自殺意念或行為的成人抑郁癥患者的抑郁癥狀�����。
吸入制劑
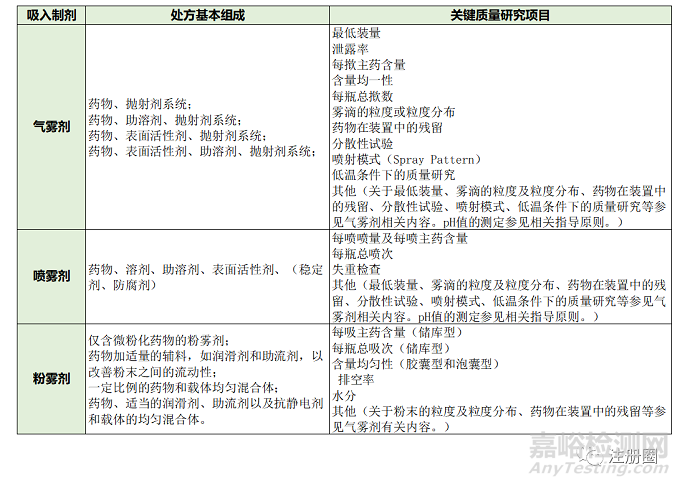
系指原料藥物溶解或分散于適宜介質(zhì)中�����,以氣溶膠或蒸氣形式遞送至肺部發(fā)揮局部或全身作用的液體或固體制劑���。吸入制劑需要借助吸入給藥裝置實(shí)現(xiàn)藥物遞送,大多屬于藥械組合產(chǎn)品���,也屬于復(fù)雜制劑�,目前上市產(chǎn)品主要有吸入氣霧劑、吸入粉霧劑�����、吸入噴霧劑及吸入用液體制劑4類�。吸入制劑在制劑處方、給藥裝置�����、制劑工藝、質(zhì)量研究�����、穩(wěn)定性研究等方面均有其特殊關(guān)注點(diǎn),可對(duì)吸入制劑的質(zhì)量可控性�����、安全性與有效性產(chǎn)生至關(guān)重要的影響�����,因此質(zhì)量控制研究部分是吸入制劑的臨床前乃至臨床研究重點(diǎn)之一�����。
法規(guī)要求
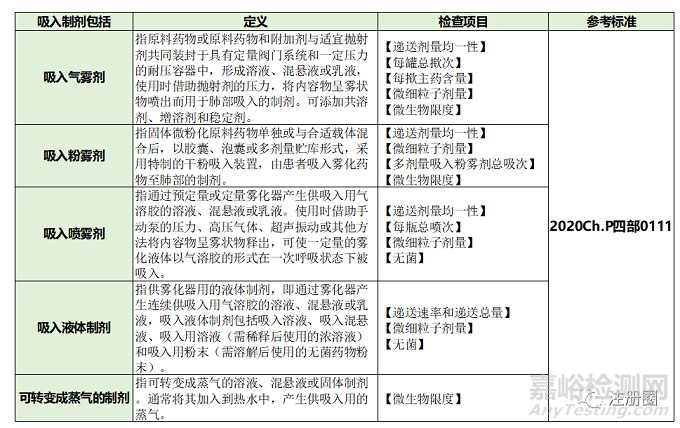
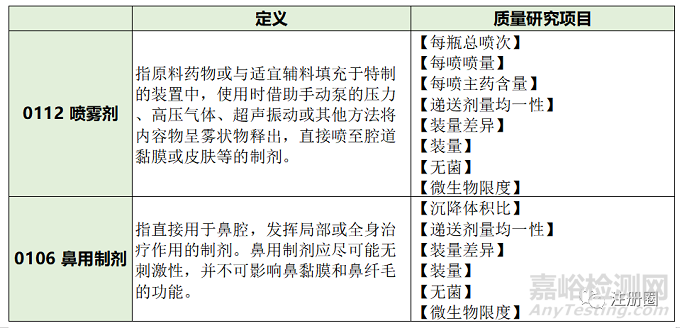
1. 在2020年版《中國藥典》里將吸入制劑作為一個(gè)單獨(dú)劑型收載,吸入制劑包括吸入氣霧劑�����、吸入粉霧劑���、吸入噴霧劑���、吸入液體制劑和可轉(zhuǎn)變成蒸氣的制劑。2020年版《中國藥典》四部0111還對(duì)吸入制劑的檢測指標(biāo)和檢測方法進(jìn)行了詳細(xì)的敘述(見表1)�。而鹽酸艾司氯胺酮鼻噴霧劑屬于吸入噴霧劑,除了需要進(jìn)行表1的質(zhì)量研究工作之外�,還需要滿足2020年版《中國藥典》四部中0112 噴霧劑、0106 鼻用制劑的質(zhì)量研究要求�����,見表2�����。
▲ 表1-2020年版《中國藥典》四部0111 吸入制劑
▲ 表2-2020年版《中國藥典》四部中0112 噴霧劑�����、0106 鼻用制劑
2. 中國(CDE)在參考國內(nèi)外相關(guān)指導(dǎo)原則和文獻(xiàn)的基礎(chǔ)上�,結(jié)合我國吸入制劑研發(fā)的現(xiàn)狀�����,通過分析質(zhì)量控制研究與安全有效性和質(zhì)量可控性之間的內(nèi)在關(guān)系制定了《吸入制劑質(zhì)量控制研究技術(shù)指導(dǎo)原則》�,并于2007年頒布。該指導(dǎo)原則僅討論了經(jīng)口腔吸入制劑在質(zhì)量控制研究工作方面的特殊研究內(nèi)容�,經(jīng)鼻吸入制劑暫不納入該指導(dǎo)原則(見表3)。
▲ 表3-《吸入制劑質(zhì)量控制研究技術(shù)指導(dǎo)原則》
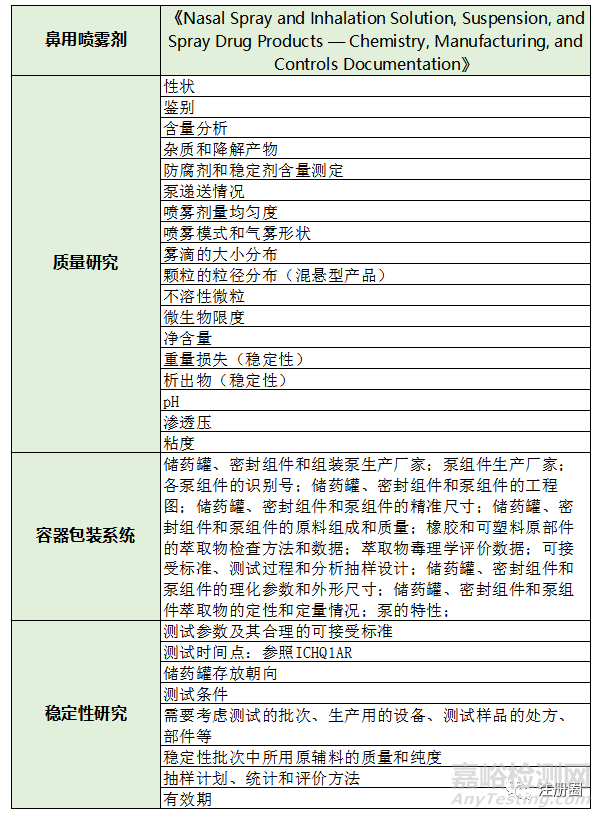
3. FDA于2022年頒布的指南草案《Nasal Spray and Inhalation Solution, Suspension, and Spray Drug Products — Chemistry, Manufacturing, and Controls Documentation》中除了詳細(xì)介紹了鼻腔噴霧劑�、吸入溶液、混懸液和局部或全身性治療用噴霧藥品的新藥申請(qǐng)(NDAs)或新藥簡略申請(qǐng)(ANDAs)所需的質(zhì)量研究和特性穩(wěn)定的內(nèi)容和資料�,還額外指出了產(chǎn)品的容器包裝系統(tǒng)需要進(jìn)行的研究和應(yīng)提交的資料:
儲(chǔ)藥罐、密封組件和組裝泵生產(chǎn)廠家�����;
泵組件生產(chǎn)廠家�����;
各泵組件的識(shí)別號(hào)���;
儲(chǔ)藥罐���、密封組件和泵組件的工程圖�;
儲(chǔ)藥罐���、密封組件和泵組件的精準(zhǔn)尺寸�����;
儲(chǔ)藥罐�����、密封組件和泵組件的原料組成和質(zhì)量���;
橡膠和可塑料原部件的萃取物檢查方法和數(shù)據(jù)���;
萃取物毒理學(xué)評(píng)價(jià)數(shù)據(jù)���;
可接受標(biāo)準(zhǔn)�����、測試過程和分析抽樣設(shè)計(jì);
儲(chǔ)藥罐�、密封組件和泵組件的理化參數(shù)和外形尺寸;
儲(chǔ)藥罐�、密封組件和泵組件萃取物的定性和定量情況�����;
泵的特性�;
指南中還指出,對(duì)于存貯在半滲透性容器/密閉系統(tǒng)(如低密度聚乙烯�,LDPE)中的吸入藥品使用保護(hù)性包裝(如鋁箔袋),保護(hù)性包裝可降低外源性污染、溶劑損失和有氧暴露�����。此外�,這些藥品的標(biāo)簽推薦使用壓紋和擊凹的形式,以避免其它類型標(biāo)簽(揮發(fā)性有機(jī)化合物油墨�、紙張、黏合劑成分)潛在的滲入�����。應(yīng)確定間接來自標(biāo)簽或相關(guān)材料暴露的可浸出物含量�,使用經(jīng)驗(yàn)證的方法(滿足檢測和定量限度)對(duì)各析出物進(jìn)行測定,析出化合物的水平應(yīng)經(jīng)過確證和記錄���,建立相應(yīng)可接受的標(biāo)準(zhǔn)�。
鼻用噴霧劑
1. 中國關(guān)于鼻用噴霧劑的藥學(xué)研究法規(guī)僅在《中國藥典》中有所描述�����,在2020年版《中國藥典》中�,鼻用噴霧劑的質(zhì)量除符合氣霧劑項(xiàng)下要求外���,還要符合鼻用制劑相關(guān)項(xiàng)下的要求�����。傳統(tǒng)鼻腔噴霧劑的開發(fā)始終圍繞著藥典規(guī)定鼻用制劑質(zhì)量控制的關(guān)鍵屬性而展開: 為水性介質(zhì)的鼻用制劑應(yīng)調(diào)節(jié)pH值與滲透壓�;還有黏度、沉降體積比及再分散性( 混懸型) 和不溶性微粒( 混懸型) �����。同時(shí)對(duì)鼻用噴霧劑具體的質(zhì)量要求又做了細(xì)化規(guī)定: 要求對(duì)鼻用噴霧劑噴出后的霧滴粒子應(yīng)大于 10 μm�����,以防止霧滴粒子進(jìn)入肺部而被吸收,規(guī)定采用微細(xì)粒子空氣動(dòng)力學(xué)檢查法���,檢查其微細(xì)粒子的劑量( 對(duì)乳液型霧滴進(jìn)行霧滴粒子大小及均一性的檢查) ; 對(duì)常用的多劑量型定量噴霧劑要求檢查凈含量�����、每瓶總噴次、每瓶噴量及每噴的主藥含量; 對(duì)定量吸入型噴霧劑�����、混懸型及乳液型定量鼻用噴霧劑還應(yīng)檢查遞送劑量均一性,以保證每次給藥能夠劑量均一; 藥典附錄規(guī)定的微細(xì)粒子空氣動(dòng)力學(xué)檢查法�����,對(duì)分級(jí)測定微粒的粒徑大小及預(yù)測體內(nèi)分布有一定的意義。
2. usp<5>Inhalation and nasal drug products-general information and product quality tests中介紹了鼻用噴霧劑需要進(jìn)行的質(zhì)量研究測試�����,還提出需要進(jìn)行usp<601>Inhalation and nasal drug products: aerosols, sprays, and powders-performance quality tests中的性能測試見表4。
▲ 表4-usp<5>���、usp<601>
此外在FDA的指南草案中《Nasal Spray and Inhalation Solution, Suspension, and Spray Drug Products — Chemistry, Manufacturing, and Controls Documentation》對(duì)鼻用噴霧制劑的藥學(xué)研究進(jìn)行了詳細(xì)的介紹,從原料藥、處方組成�、輔料到質(zhì)量研究、穩(wěn)定性研究�,還有容器包裝系統(tǒng)都一一進(jìn)行了描述(見表5)�。該指南草案除了提到《中國藥典》里需要進(jìn)行的質(zhì)量研究項(xiàng)目外,還提出了鼻用噴霧制劑的關(guān)鍵部件——泵�����,需要對(duì)其性能進(jìn)行研究�����,因?yàn)楸怯脟婌F制劑產(chǎn)品的劑量直接取決于泵的設(shè)計(jì)�����,此外泵與儲(chǔ)藥罐、密封部件和處方成分的相容性都應(yīng)該徹底地調(diào)查和研究。
▲ 表5-《Nasal Spray and Inhalation Solution, Suspension, and Spray Drug Products — Chemistry, Manufacturing, and Controls Documentation》
吸入制劑的中美考量
通過上述對(duì)中美關(guān)于吸入制劑法規(guī)的介紹,可以看出FDA除了關(guān)注吸入制劑的質(zhì)量研究之外�����,同樣關(guān)注吸入制劑使用到的裝置���、包裝系統(tǒng),中國對(duì)于這塊的法規(guī)還是有所缺失的���。此外FDA還明確給出了吸入制劑的穩(wěn)定性研究需要考察的因素�����,不僅限于ICHQ1中的穩(wěn)定性研究項(xiàng)目���,還額外提出了針對(duì)吸入制劑特性的穩(wěn)定性測試�����。由于吸入制劑大多需要匹配給藥裝置來進(jìn)行給藥���,迄今為止���,中國研發(fā)的各類吸入制劑均按藥品申報(bào)注冊(cè)�;而FDA對(duì)于部分吸入制劑是按新劑型(new dosage form)和新組合(new combination)批準(zhǔn)上市�,比如上文介紹到的鹽酸艾司氯胺酮鼻噴霧劑,在中國以化學(xué)藥品第5類申報(bào)上市�����,而在FDA(2019)是作為新劑型(new dosage form)和新組合(new combination)申報(bào)上市���。總體來看�����,中國藥企對(duì)于吸入制劑的藥學(xué)研究要點(diǎn)可以參考FDA出臺(tái)的相關(guān)法規(guī)和指南草案�����,再結(jié)合中國的法規(guī)要求來進(jìn)行注冊(cè)申報(bào)�。
小結(jié)
正因吸入制劑可將藥物直接遞送到呼吸道和肺部�,無首過效應(yīng),生物利用度高���,可明顯提高患者的依從性�����,而在藥物治療中正發(fā)揮著越來越重要的作用���,并成為治療支氣管哮喘(Asthma)和慢性阻塞性肺疾病(COPD)的首選給藥途徑���。通過吸入制劑的藥學(xué)法規(guī)來看���,吸入制劑的研發(fā)應(yīng)聚焦于關(guān)鍵輔料、給藥裝置���、包裝材料以及特性分析檢測等方面�����,確保最終藥品的安全性和有效性�����。