摘要
系統(tǒng)性回顧分析 2005—2021 年中藥有效成分新藥(new Chinese herbal active ingredient drugs,NCHAIDs)的臨床試驗申請��、上市申請和臨床試驗登記情況��,結(jié)果顯示:(1)2005—2021 年申請臨床試驗的 39 個 NCHAIDs 中����,19 個品種獲批,批準(zhǔn)率為 48.7%����,其中 16 個品種已進(jìn)行臨床試驗登記��。2005—2021 年申請生產(chǎn)的 5 個 NCHAIDs 中�����,有 1 個獲得批準(zhǔn)。(2)16 個已完成臨床試驗登記新藥的平均臨床試驗所用時間為 7 年��,有 1 個品種完成了 II 期臨床試驗�����,5 個品種完成了 I 期臨床試驗�����。(3)NCHAIDs 的適應(yīng)證相對集中在神經(jīng)精神�����、心血管����、腫瘤等;對于臨床定位與藥材功能主治相關(guān)性較好的NCHAIDs��,臨床試驗申請獲得批準(zhǔn)的幾率相對較高����;有效成分的結(jié)構(gòu)類型較多,其中黃酮�����、皂苷、內(nèi)酯等的比例相對較高��。建議加強(qiáng) NCHAIDs 的成藥性研究����,控制研發(fā)風(fēng)險;加強(qiáng) NCHAIDs 的基礎(chǔ)研究����;關(guān)注 NCHAIDs 的藥動學(xué)特性;注重知識產(chǎn)權(quán)保護(hù)����;關(guān)注藥材資源及制造成本等問題,為今后 NCHAIDs 的研發(fā)提供有益借鑒����。
中藥有效成分新藥(new Chinese herbal active ingredient drugs,NCHAIDs)在原《藥品注冊管理辦法》(2002����、2005�����、2007 年)中是中藥注冊分類的一個單獨類別。2020 年�����,國家市場監(jiān)管總局頒布的新《藥品注冊管理辦法》(國家市場監(jiān)督管理總局令第27 號)將中藥注冊分類調(diào)整為中藥創(chuàng)新藥�����、中藥改良型新藥����、古代經(jīng)典名方中藥復(fù)方制劑、同名同方藥 4 類[1]����。同年國家藥品監(jiān)督管理局發(fā)布《中藥注冊分類及申報資料要求》,將中藥有效成分及其制劑歸入中藥創(chuàng)新藥 1.2 類“從單一植物����、動物、礦物中提取得到的提取物及其制劑”��,不再將有效成分及其制劑單獨作為一類[2]�����。NCHAIDs 有著不同于中藥復(fù)方新藥的特點,是最容易講清楚��、說明白中藥作用機(jī)制和走向世界的中藥創(chuàng)新藥����。本文通過對2005—2021 年 NCHAIDs 的注冊申請及審評情況進(jìn)行系統(tǒng)的回顧分析,并就其研發(fā)策略進(jìn)行探討����,供同行參考。
一��、數(shù)據(jù)來源與方法
1.1 數(shù)據(jù)來源
NCHAIDs 相關(guān)信息源自國家藥品監(jiān)督管理局藥品審評中心網(wǎng)站的公開信息��、國家知識產(chǎn)權(quán)局中國專利全文庫(China Patent Full-Text Database����,CNTXT)、藥智網(wǎng)和米內(nèi)網(wǎng)等商業(yè)數(shù)據(jù)庫����。
1.2 數(shù)據(jù)范圍及數(shù)據(jù)處理
本文以同時符合以下條件的中藥新藥為分析對象:(1)2005 年 5 月 1 日—2021 年 12 月 30 日受理;(2)審評已完成,有明確審評結(jié)論��;(3)境內(nèi)申請人提出的新藥臨床試驗申請(investigational new drug ����, IND ) 及新藥上市申請( new drug application�����,NDA)�����;(4)注冊分類為中藥 1 類新藥(2020 年 7 月 1 日前受理并進(jìn)入藥審中心)����,或中藥創(chuàng)新藥 1.2 類(2020 年 7 月 1 日—2021 年 12 月 31日受理),即新的中藥有效成分及其制劑����;(5)相同結(jié)構(gòu)中藥有效成分及其制劑由不同申請人背對背研究后各自分別申請的,分別按不同品種計算��;(6)同一品種同時申請多個規(guī)格的��,按 1 個品種計。采用 Excel 2016 進(jìn)行統(tǒng)計��。
二�����、數(shù)據(jù)統(tǒng)計結(jié)果
2.1 申請人地區(qū)分布
NCHAIDs 申請人(藥品上市許可人)所在地區(qū)的申請品種數(shù)如下:江蘇省 9 個�����、解放軍總后勤部衛(wèi)生部 7 個�����、北京市 7 個�����、上海市 4 個��、云南省 3個�����、山東省 3 個�����、四川省和貴州省各 2 個以及浙江省、廣東省�����、重慶市��、安徽省����、河北省��、吉林省�����、青海省各 1 個(合計 44 個)��。
2.2 劑型分布
2005—2021 年 IND 中藥有效成分制劑的劑型分布如下:注射劑 18 個(批準(zhǔn) 8 個)��、膠囊劑 10 個(批準(zhǔn) 6 個)�����、片劑 9 個(批準(zhǔn) 4 個)、滴丸劑 2 個(批準(zhǔn) 1 個)����,合計 39 個。IND 中藥有效成分制劑涉及的劑型較為集中����,注射劑占比最高。18 個注射劑中有 12 個為 2008 年以前申請 IND 的品種��。國家食品藥品監(jiān)督管理局頒布《中藥��、天然藥物注射劑基本技術(shù)要求》(國食藥監(jiān)注 [2007] 743 號)后����,再次對注射給藥途徑的合理性提出明確要求,此后��,中藥注射劑的申請數(shù)量明顯減少[3]�����。此外����,5 個 NDA的 NCHAIDs 中 4 個為注射劑�����,未獲準(zhǔn)上市生產(chǎn)��,另一個膠囊劑獲得上市許可�����。
2.3 功能主治及適應(yīng)證分布
2005—2021 年受理且已審結(jié)的 44 個中藥有效成分制劑(包括 IND 和 NDA)申請的功能主治(同時涉及多個適應(yīng)證的,按主要適應(yīng)證計)相對集中在精神神經(jīng)����、腫瘤、心血管疾病����,分別為 14、9����、8個,3 者合計占比約 70%��。申請 NDA 的 5 個NCHAIDs 中�����,3 個用于腦梗死、1 個用于冠心病心絞痛����、1 個用于腫瘤。
申請 IND 的 39 個 NCHAIDs 中����,腫瘤 8 個,冠心病心絞痛 7 個�����,中風(fēng)����、腦梗死 6 個,肺炎����、流感發(fā)熱 3 個,血管性癡呆 3 個��,糖尿病 2 個����,急性腎衰 2 個�����,乙肝急性發(fā)作 1 個�����,其他適應(yīng)證(包括創(chuàng)傷性休克����、肺纖維化��、高尿酸血癥����、絕經(jīng)后骨質(zhì)疏松��、類風(fēng)濕性關(guān)節(jié)炎��、抑郁癥等)7 個��。獲準(zhǔn)進(jìn)行臨床試驗的 19 個品種中��,腫瘤 3 個、冠心病心絞痛4 個�����,中風(fēng)��、腦梗死 3 個��,肺炎����、流感發(fā)熱 2 個��,血管性癡呆 2 個����,糖尿病 12 個,乙肝急性發(fā)作 1個����,其他適應(yīng)證 3 個。
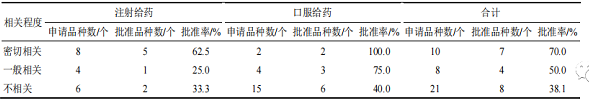
本文對 39 個 IND 的 NCHAIDs 功能主治與所用藥材(以提取物為原料的�����,按制備提取物所用藥材計)的功能主治進(jìn)行比較,按照二者的相關(guān)程度分為密切相關(guān)����、一般相關(guān)�����、不相關(guān) 3 類。密切相關(guān):新藥制劑的功能主治與藥材功能主治存在相同表述����;一般相關(guān):制劑功能主治與藥材功能主治表述相似,根據(jù)中醫(yī)藥理論推測有相關(guān)性����;不相關(guān):制劑功能主治與藥材功能主治無相似表述,二者無相關(guān)性��。從表 1 可知�����,IND 的 NCHAIDs 中��,功能主治與藥材的相關(guān)性越高�����,其批準(zhǔn)率越高��。
2.4 有效成分用藥材情況
2005—2021 年申請 IND 及 NDA 的 44 個NCHAIDs 共涉及藥材 30 種(以提取物為原料的�����,按制備提取物所用藥材計)����。其中,大多為有效成分明確的常用中藥��,出現(xiàn)頻率較高的藥材有丹參����、黃芪、銀杏葉����、人參、連翹等����。NCHAIDs 涉及的 30 種藥材中�����,能實現(xiàn)規(guī)?���;N植的有 18 種����。其他為未能實現(xiàn)規(guī)模化種植的野生藥材����。其中,列入《國家重點保護(hù)野生植物名錄》的有 3 種��?����?紤]到 NCHAIDs 的生產(chǎn)需要消耗大量藥材資源��,應(yīng)開展野生藥材資源評估工作��,關(guān)注瀕危藥材及野生藥材的資源可持續(xù)利用問題�����。NCHAIDs 原則上不應(yīng)以國家重點保護(hù)野生動植物為原料�����,上市生產(chǎn)應(yīng)以人工栽培藥材入藥����。
2.5有效成分的結(jié)構(gòu)類型
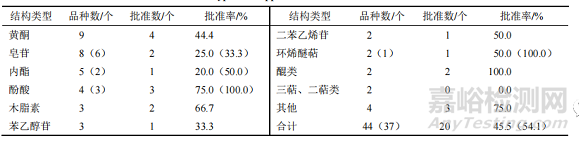
44 個 NCHAIDs(IND 及 NDA)涉及 36 種不同的化合物結(jié)構(gòu),具體見表 2�����。表 2 中其他結(jié)構(gòu)類型包括生物堿����、聯(lián)芐、酚苷等��。此外����,NDA 有皂苷、黃酮各 2 個、內(nèi)酯 1 個�����。
▲ 表 1 2005—2021 年 IND 的 NCHAIDs 的批準(zhǔn)率與藥材功能主治間的相關(guān)性
▲ 表 2 2005—2021 年中藥 NCHAIDs 的結(jié)構(gòu)類型及批準(zhǔn)情況
表中括號內(nèi)的數(shù)據(jù)為去除相同結(jié)構(gòu)有效成分后的品種數(shù)或相應(yīng)批準(zhǔn)率
2.6 生物利用度
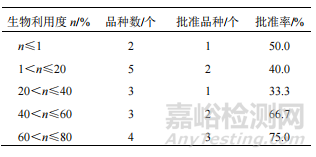
生物利用度是 NCHAIDs 給藥途徑和劑型選擇的重要依據(jù)��。21 個制備成口服固體制劑的 NCHAIDs中��,除 4 個未能獲得公開數(shù)據(jù)外,其余 17 個有效成分口服固體制劑的生物利用度見表 3(大鼠�����、犬的生物利用度不同時����,按生物利用度高的數(shù)據(jù)計)��。其中,生物利用度小于 1%獲批 IND 的新藥結(jié)構(gòu)為苯乙醇苷類�����;生物利用度為 1%~20%的 2 個獲批新藥中�����,分別為皂苷和醌類成分(生物利用度為 9.7%)。苷類成分原型的吸收利用往往較差��,而代謝產(chǎn)物相對較好��。如某黃酮苷類 NCHAIDs 原型成分的生物利
▲ 表 3 2005—2021 年申請 IND 中藥 NCHAIDs 口服固體制劑的生物利用度情況
用度小于 1%��,但加上代謝產(chǎn)物后的生物利用度提高為 28%�����。除未考察代謝產(chǎn)物的苷類成分外�����,生物利用度相對較高的品種與生物利用度較低的品種相比,批準(zhǔn)率有增加的趨勢����。
此外�����,部分有效成分制劑的生物利用度在 2 種動物(大鼠、犬或猴)間�����,或不同性別動物間的差異較大��。如某生物堿的生物利用度為犬 6.8%、大鼠57.0%�����。某萜類成分的生物利用度為雌性大鼠 30%����、雄性大鼠小于 2%�����。提示某些有效成分的吸收利用存在明顯的種屬或性別差異��。這些品種及生物利用度較低的品種如獲準(zhǔn)開展臨床試驗,應(yīng)結(jié)合動物藥動學(xué)研究結(jié)果有針對性地加強(qiáng)人體藥動學(xué)研究����。
2.7 日用劑量分布
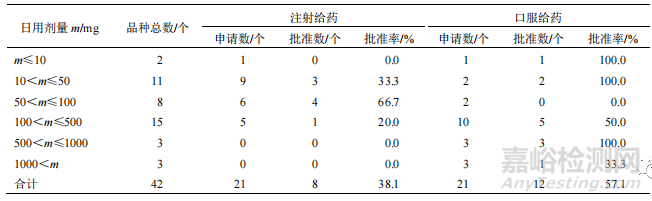
44 個 NCHAIDs 中����,有 42 個根據(jù)前期研究初步提出了臨床擬用劑量�����,見表 4。從有效成分的日用劑量與給藥途徑的關(guān)聯(lián)看�����,有效成分口服給藥的日用劑量較大�����,注射給藥的日用劑量相對較低�����。日用劑量超過 500 mg 的品種均為口服制劑。
▲ 表 4 2005—2021 年 NCHAIDs 的日用劑量情況
2.8 開展臨床試驗情況
2005—2021 年已審結(jié)的 39 個 IND 有效成分制劑中有 19 個品種獲批��。假設(shè)中藥 NCHAIDs 自IND 獲批至申請 NDA 的時間段為臨床試驗所用時間(T):T≤3 年的有 3 個品種(2 個已登記臨床)�����;3 年<T≤5 年的有 9 個(均登記臨床);5 年<T≤10 年有 3 個(均登記臨床)��;T>10 年有 4 個(2 個登記臨床)��。有 3 個尚未進(jìn)行臨床試驗登記(其中2 個品種已超過 3 年����,1 個品種雖未登記但已完成上市申請)�����。
國家藥品監(jiān)督管理局藥品審評中心網(wǎng)站“藥物臨床試驗登記與信息公示平臺”[6]顯示(截至 2022年 6 月 30 日):已登記臨床試驗的 16 個品種中��,I期臨床試驗已完成 5 個����,招募中 5 個��;II 期臨床試驗已完成 1 個����,招募中 3 個����;臨床試驗階段不明招募中的 2 個�����。
16 個已登記臨床試驗品種的平均臨床試驗所用時間(T 平均)約 7 年�����,且均未開展 III 期臨床試驗�����。而同期 NDA 獲批中藥復(fù)方新藥的 T 平均為 4.3年,約 87%的臨床試驗用時在 6 年以內(nèi)�����。中藥NCHAIDs 臨床試驗用時相對較長�����。5 個已完成 I 期臨床試驗的有效成分的 T 平均約為 7 年,其中��,2 個品種已用約 10 年�����,3 個已用約 5 年;未完成 I 期臨床試驗的 5 個品種 T 平均約 4 年。此外��,有 1 個品種已完成 II 期臨床試驗����,已用時 12 年�����;3 個 II 期臨床試驗正在進(jìn)行中品種的 T 平均約 9 年。
2.9 知識產(chǎn)權(quán)情況
CNTXT 收錄了全部公開的中國專利文獻(xiàn)��。本文采用申請人結(jié)合關(guān)鍵詞(中藥有效成分)進(jìn)行檢索��,檢索文獻(xiàn)始于 CNTXT 最早收錄的文獻(xiàn)����,止于2022 年 10 月 14 日公開的專利文獻(xiàn)��,NCHAIDs 的有效專利數(shù)量(專利申請被授權(quán)后仍處于有效狀態(tài)的專利)見表 5�����。
▲ 表 5 2005—2021 年 NCHAIDs 的有效專利數(shù)量
“*”-新藥申請人擁有的目前仍處于有效狀態(tài)的專利
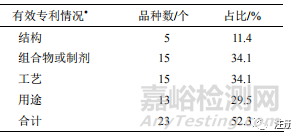
從中藥 NCHAIDs 擁有的有效專利數(shù)量來看�����,44 個 NCHAIDs 中����,僅 23 個新藥品種擁有有效專利,占比約 52.3%(其中以個人作為申請人的藥品專利不在統(tǒng)計范圍)����。其中結(jié)構(gòu)專利占比最低,僅11.4%��。用途專利占 29.5%����。主要原因是大部分中藥有效成分為已知成分且用途也被公眾所熟悉,無法滿足現(xiàn)有專利法關(guān)于新穎性和創(chuàng)造性的要求�����,因此難以獲得專利保護(hù)��。其中也有專利工作較好����,如某新藥,有效專利總數(shù) 16 個�����,其中��,結(jié)構(gòu)專利 3 個��,用途專利 7 個��,工藝��、組合物或制劑專利各 3 個����。
三、討論
3.1 NCHAIDs 研發(fā)應(yīng)加強(qiáng)基礎(chǔ)研究
目前申請注冊的 NCHAIDs 的基礎(chǔ)研究普遍較為薄弱�����,尤其是藥物發(fā)現(xiàn)階段的基礎(chǔ)研究不夠充分����。盡管相應(yīng)藥材有長期人用歷史,與天然產(chǎn)物相比��,從藥材中發(fā)現(xiàn)有效成分的幾率可能相對較高����,但一種藥材往往含有幾百或更多的成分�����,從中找出最適合開發(fā)成 NCHAIDs的某一種成分是非常具有挑戰(zhàn)性的科學(xué)研究��。NCHAIDs 的研發(fā)規(guī)律與天然藥物及小分子化學(xué)藥更為相近,不能完全根據(jù)藥材的臨床經(jīng)驗來推測其有效性��。如何實現(xiàn)藥材中的微量成分的高效分離�����、快速識別及高效活性篩選,都是需要解決的問題�����。新藥發(fā)現(xiàn)階段的研究非常重要,有效成分一旦確定����,在很大程度上決定了今后新藥的安全性����、有效性。應(yīng)加強(qiáng)基礎(chǔ)研究�����,充分利用現(xiàn)代科學(xué)技術(shù)進(jìn)步帶來的新手段、新技術(shù)�����、新方法����,如基于靶點的高通量篩選[7]、高內(nèi)涵篩選[8]��、釣靶技術(shù)[9]、分子對接技術(shù)[10]�����、網(wǎng)絡(luò)藥理學(xué)[11-12]��、細(xì)胞膜色譜[13]、人工智能[14]����、微流控芯片[15]�����、基因芯片[16]等����。
3.2 NCHAIDs 研發(fā)應(yīng)重視成藥性研究
有些 NCHAIDs 在研發(fā)中缺少成藥性研究��。僅從藥材中發(fā)現(xiàn)活性成分后就匆匆立項,未考慮到有效成分雖有活性但未必適合開發(fā)成新藥����。從技術(shù)要求看����,NCHAIDs 與小分子化學(xué)藥已基本趨同����。盡管從藥材中發(fā)現(xiàn)的多數(shù)活性成分具有一定藥效�����,但很多情況下藥效作用強(qiáng)度較弱��,或藥代性質(zhì)����、安全性等方面存在缺陷�����,臨床應(yīng)用價值不大[17]��。尤其是常用中藥材����,其中含量較高的成分早已被反復(fù)研究��,成藥性往往較差�����,不宜盲目開發(fā)��。新藥研發(fā)的投資大、周期長����、風(fēng)險高����,應(yīng)在研發(fā)立項及關(guān)鍵節(jié)點就成藥性進(jìn)行綜合評估,合理控制研發(fā)風(fēng)險��。
3.3 NCHAIDs 研發(fā)應(yīng)關(guān)注藥物吸收利用
較強(qiáng)的生物活性與良好的藥代性質(zhì)是NCHAIDs 應(yīng)具備的特征。NCHAIDs 是最有希望成功使用新劑型��、新輔料��、新技術(shù)的中藥注冊分類��。應(yīng)加強(qiáng) NCHAIDs 的藥動學(xué)研究,鼓勵采用現(xiàn)代制劑技術(shù)和合適輔料改善其生物利用度。應(yīng)根據(jù)有效成分特點��、生物藥劑學(xué)分類及藥代行為合理選擇制劑技術(shù)及輔料��。已有相關(guān)研究可為 NCHAIDs 的研究提供思路和借鑒����。Ma 等[18]采用高相對分子質(zhì)量羥丙基甲基纖維素等輔料制備穿心蓮內(nèi)酯的固體分散體��,其最大血藥濃度(Cmax)��、藥-時曲線下面積(area under curve����,AUC)分別提高了 6.0�����、4.7倍。Gera 等[19]以聚乙烯吡咯烷酮為穩(wěn)定劑制備了柚皮素納米混懸劑�����,其 Cmax 及 AUC 分別提高 2.0����、1.8 倍,改善了溶出度和口服生物利用度�����。Aboutaleb等[20]將長春新堿硫酸鹽與聚陰離子右旋糖酐硫酸鈉結(jié)合到棕櫚酸脂質(zhì)納米粒中制成長春新堿的固體脂質(zhì)納米粒�����,與藥物溶液相比��,其血漿及組織中藥物濃度提高�����,停留時間延長��。Zhang 等[21]以聚乙二醇及二硬脂酰磷脂酰乙醇胺制成硫酸長春新堿納米制劑,顯著延長其半衰期�����、增大 AUC����。Wei等[22]以羥丙基甲基纖維素為沉淀抑制劑制備了過飽和水飛薊賓自乳化給藥系統(tǒng),在給藥劑量為 533mg/kg 時����,水飛薊賓過飽和自乳化給藥系統(tǒng)比不含羥丙基甲基纖維素的自乳化給藥系統(tǒng)相比,AUC增加約 3 倍�����。
3.4 NCHAIDs 研發(fā)應(yīng)關(guān)注資源與成本
以藥材為起始原料且得率及用法用量明確的34 個 NCHAIDs 中�����,口服制劑每日消耗的飲片量最高約 2000 g,注射劑每日消耗的飲片量最高為 740g����。以野生藥材為原料的 NCHAIDs 應(yīng)特別關(guān)注藥材資源能否可持續(xù)利用及對生態(tài)環(huán)境的影響��。根據(jù)“中藥材天地網(wǎng)”2022 年 1 月不同藥材產(chǎn)地��、不同藥材市場的平均價格計算,日服飲片量最多的 NCHAIDs每日給藥劑量所需的藥材平均成本約為 180 元�����。定向培育有效成分含量高的藥用植物品種����、改進(jìn)工藝提高有效成分的提取得率����,或采用合成生物學(xué)技術(shù)獲得有效成分,或以有效成分為先導(dǎo)化合物,進(jìn)行結(jié)構(gòu)改造��,研發(fā)新的化學(xué)藥等��,都可能是解決資源或成本問題的方法。
3.5 NCHAIDs 研發(fā)應(yīng)重視知識產(chǎn)權(quán)保護(hù)
隨著知識產(chǎn)權(quán)在保證研發(fā)投入回報及創(chuàng)新發(fā)展中作用的日益凸顯����,NCHAIDs 研發(fā)應(yīng)建立知識產(chǎn)權(quán)保護(hù)的“護(hù)城河”,對于產(chǎn)品的有效專利予以充分重視。對于新研發(fā)的中藥有效成分結(jié)構(gòu)��,可先爭取獲得結(jié)構(gòu)專利作為基礎(chǔ)專利��,然后再從制劑、組合物����、制備工藝��、用途等方面進(jìn)行全方位專利布局����,獲得多維度保護(hù)。對于已知有效成分的中藥新藥�����,即便不能獲得結(jié)構(gòu)專利,也可以進(jìn)一步研究劑型�����、組合物、用途等專利����,建立多重外圍專利保護(hù)網(wǎng)����。
四、結(jié)語
本文通過對 2005—2021 年中藥有效成分 IND��、NDA 的審評審批情況和臨床試驗登記情況進(jìn)行分析和研究�����,結(jié)果顯示:(1)據(jù)不完全統(tǒng)計��,2005—2021 年 NCHAIDs 申請臨床試驗的 39 個品種中有19 個獲得批準(zhǔn)��,批準(zhǔn)率為 48.7%��。IND 獲批品種中有 16 個已進(jìn)行臨床試驗登記����。5 個 NDA 品種中��,4 個注射劑未獲批準(zhǔn),另 1 個膠囊劑獲準(zhǔn)上市生產(chǎn)��。(2)NCHAIDs 申請的適應(yīng)證相對集中在精神神經(jīng)、心血管�����、腫瘤;臨床定位與藥材相關(guān)的有效成分獲得 IND 批準(zhǔn)的比例相對較高����。(3)有效成分的結(jié)構(gòu)類型較多�����,黃酮�����、皂苷�����、內(nèi)酯等的占比較高�����。(4)NCHAIDs 臨床試驗用時較長��。16 個已完成臨床試驗登記品種的 T 平均約為 7 年,有 1 個品種完成了 II期臨床試驗����,5個完成了I期臨床試驗。(5)NCHAIDs擁有有效專利數(shù)量較少�����。44 個 NCHAIDs 中����,僅 23個新藥品種擁有有效專利����,占比約 52.3%。其中結(jié)構(gòu)專利僅占 11.4%�����。用途專利占 29.5%��。
中藥新藥的研究與評價應(yīng)以患者為中心��,以臨床價值為導(dǎo)向��。NCHAIDs 研發(fā)應(yīng)加強(qiáng)基礎(chǔ)研究��,重點加強(qiáng)新藥的成藥性研究����,控制研發(fā)風(fēng)險。重視有效成分的藥動學(xué)研究�����,采用新劑型��、新技術(shù)增加藥物吸收利用�����。關(guān)注 NCHAIDs 用藥材資源與制造成本等問題��。本文對以往 NCHAIDs 注冊申請及審評情況的回顧分析�����,為今后 NCHAIDs 的科學(xué)審評積累經(jīng)驗����,為 NCHAIDs 的研發(fā)提供有益參考����。
參考文獻(xiàn)
[1] 國家市場監(jiān)督管理總局. 《藥品注冊管理辦法》(國家市場監(jiān)督管理總局令第 27 號) [EB/OL].[2020-03-20].
http://gkml.samr.gov.cn/nsjg/fgs/202003/t20200330_313670.html.
[2] 國家藥品監(jiān)督管理局. 國家藥監(jiān)局關(guān)于發(fā)布《中藥注冊分類及申報資料要求》的通告 (2020 年第 68 號)[EB/OL]. [2020-09-28].
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20200928164311143.html.
[3] 國家食品藥品監(jiān)督管理局. 關(guān)于印發(fā)中藥、天然藥物注射劑基本技術(shù)要求的通知 (國食藥監(jiān)注 [2007] 743 號)[EB/OL]. [2007-12-06].
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20071206120001186.html.
[4] 王玲玲, 胡流芳, 張曉東, 等. 2005—2020 年申請臨床試驗中藥新藥的審評審批情況分析 [J]. 中草藥, 2021,52(12): 3765-3774.
[5] 國家食品藥品監(jiān)督管理總局. 關(guān)于開展藥物臨床試驗數(shù)據(jù)自查核查工作的公告 (2015 年第 117 號) [EB/OL].[2015-07-22].
https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20150722173601172.html.
[6] 藥物臨床試驗登記與信息公示平臺 [EB/OL]. [2022-12-24].
http://www.chinadrugtrials.org.cn/index.html.
[7] 權(quán)寧海, 康英錦, 李東浩, 等. 中草藥活性成分的高通量篩選技術(shù)研究進(jìn)展 [J]. 分析科學(xué)學(xué)報, 2017, 33(5):741-746.
[8] 王石峰. 抑制 3T3-L1 細(xì)胞脂形成的中藥活成分高內(nèi)涵篩選 [D]. 北京: 北京中醫(yī)藥大學(xué), 2014.
[9] 劉翠翠, 王奇升, 田永奇, 等. 配體垂釣: 一種從生物提取物中快速篩選活性化合物的方法 [J]. 藥學(xué)學(xué)報,2021, 56(4): 996-1005.
[10] 羅菁漢, 吳成軍, 孫鐵民. 采用分子對接技術(shù)發(fā)現(xiàn)抗冠狀病毒肺炎藥物的研究 [A] // 第十七屆沈陽科學(xué)學(xué)術(shù)年會論文集 [C]. 沈陽: 沈陽市科學(xué)技術(shù)協(xié)會, 2020:262-269.
[11] 王海霞, 康顯杰, 朱燕, 等. 基于網(wǎng)絡(luò)藥理學(xué)和分子對接技術(shù)探討白術(shù)治療潰瘍性結(jié)腸炎的潛在分子機(jī)制[J]. 浙江中醫(yī)藥大學(xué)學(xué)報, 2020, 44(9): 916-923.
[12] 周珊珊, 李偉男, 艾中柱, 等. 基于網(wǎng)絡(luò)藥理學(xué)和分子對接探討清肺達(dá)原顆粒治療新型冠狀病毒肺炎(COVID-19) 的作用機(jī)制 [J]. 中草藥, 2020, 51(7):1804-1813.
[13] 王曉宇, 陳嘯飛, 顧妍秋, 等. 細(xì)胞膜色譜研究進(jìn)展及其在中藥活性成分篩選中的應(yīng)用 [J]. 分析化學(xué), 2018,46(11): 1695-1702.
[14] 吳昊, 林銘, 孫懿, 等. 新一代人工智能技術(shù)驅(qū)動下的新藥研發(fā) [J]. 中國藥理學(xué)通報, 2019, 35(7): 889-893.
[15] 高巖. 微流控芯片用于篩選博落回種子中抗腫瘤活性成分研究 [D]. 廣州: 廣東藥科大學(xué), 2021.
[16] 劉玉峰, 許肈初, 馬海燕. 基因芯片技術(shù)在中藥現(xiàn)代化研究中的應(yīng)用進(jìn)展 [J]. 遼寧大學(xué)學(xué)報: 自然科學(xué)版,2021, 48(3): 254-262.
[17] 姜勇, 李軍, 屠鵬飛. 再議新形勢下中藥創(chuàng)新藥物的發(fā)現(xiàn)與研發(fā)思路 [J]. 世界科學(xué)技術(shù)—中醫(yī)藥現(xiàn)代化,2017, 19(6): 892-899.
[18] Ma Y Q, Yang Y, Xie J, et al. Novel nanocrystal-based solid dispersion with high drug loading, enhanced dissolution, and bioavailability of andrographolide [J]. Int J Nanomed,2018, 13: 3763-3779.
[19] Gera S, Talluri S, Rangaraj N, et al. Formulation and evaluation of naringenin nanosuspensions for bioavailability enhancement [J]. AAPS PharmSciTech,2017, 18(8): 3151-3162.
[20] Aboutaleb E, Atyabi F, Khoshayand M R, et al. Improved brain delivery of vincristine using dextran sulfate complex solid lipid nanoparticles: Optimization and in vivo evaluation [J]. J Biomed Mater Res A, 2014, 102(7): 2125-2136.
[21] Zhang J, Chen Y C, Li X, et al. The influence of different long-circulating materials on the pharmacokinetics of liposomal vincristine sulfate [J]. Int J Nanomed, 2016, 11:4187-4197.
[22] Wei Y H, Ye X L, Shang X G, et al. Enhanced oral bioavailability of silybin by a supersaturatable self emulsifying drug delivery system (S-SEDDS) [J]. Colloids Surf A Physicochem Eng Aspects, 2012, 396: 22-28.