前情簡述
近年來��,有一個名詞頻頻出現(xiàn)在人們視野——PM2.5(英文名稱:FineParticular matter),系指環(huán)境空氣中空氣動力學(xué)直徑小于或等于2.5微米的顆粒物��。由于其較高的表面活性使其表面容易附積更小的有害物質(zhì)與此同時較小的粒徑可以使其長期懸浮于空氣當(dāng)中���。自然界以及人類的一系列活動都會產(chǎn)生PM2.5顆粒���,我國的一些區(qū)域深受其影響,給當(dāng)?shù)厝说纳钯|(zhì)量帶來嚴(yán)重的挑戰(zhàn)��。當(dāng)其在空氣中的濃度越高時所代表的空氣質(zhì)量就會越差�����,為何會有如此論斷�����,系基于對人體呼吸系統(tǒng)的理解發(fā)現(xiàn)�����,當(dāng)細(xì)顆粒的空氣動力學(xué)粒徑小于2.5微米時這類細(xì)顆粒容易伴隨著人的吸氣過程進(jìn)入肺內(nèi)進(jìn)而沉積在肺部引發(fā)一系列病變��。下文則是將上述PM2.5更換為藥物顆粒�����,從設(shè)計目的���、體內(nèi)吸收過程��、產(chǎn)品開發(fā)重點以及國內(nèi)外法規(guī)等方面來簡要闡述以肺部為主要吸收環(huán)境的藥物遞送系統(tǒng)���。
干粉吸入劑(DryPowder Inhaler有名吸入粉霧劑,是將一種或多種微粉化藥物與載體組成粉體混合物灌裝儲存于膠囊或泡囊當(dāng)中���,經(jīng)特殊給藥裝置處置之后伴隨著吸氣過程產(chǎn)生的氣溶膠實現(xiàn)藥物的肺內(nèi)沉積進(jìn)而發(fā)揮藥物治療作用的一類新型制劑���;干粉吸入劑設(shè)計初期主要應(yīng)用于哮喘、慢性肺阻塞��、肺部感染等肺部疾病的靶向治療���,經(jīng)臨床使用價值的不斷肯定該技術(shù)已經(jīng)發(fā)展成為以肺部為給藥環(huán)境實現(xiàn)全身治療作用的藥物傳遞系統(tǒng)�����。
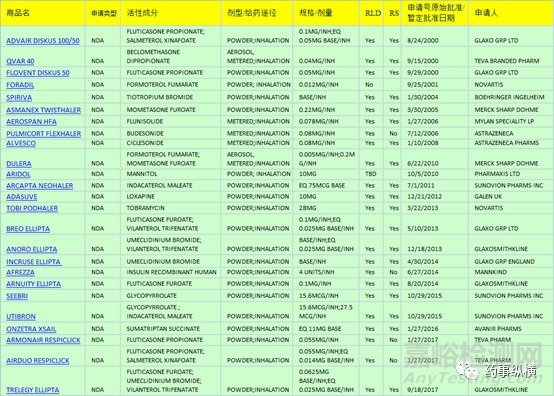
下圖即為近年來FDA批準(zhǔn)的部分干粉吸入制劑��。
基礎(chǔ)知識——呼吸系統(tǒng)
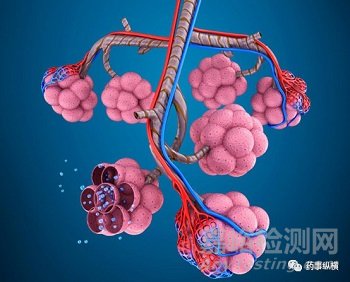
DPI是基于口腔吸入的給藥劑型�����,只有從呼吸的生理機(jī)理上理解藥物的吸入過程才能實現(xiàn)對產(chǎn)品的深刻理解�����。人體呼吸系統(tǒng)如下(節(jié)選氣管到肺泡部分):
呼吸過程簡述:吸氣時�����,伴隨著的胸腔張肺內(nèi)壓強(qiáng)減小���,基于此壓差空氣被吸入肺部���,對于DPI而言在此壓差下形成氣溶膠實現(xiàn)藥物的肺內(nèi)沉積(一般情況下���,該壓差大約為4kPa)��;呼氣時��,胸腔收縮��、肺內(nèi)壓強(qiáng)增大��,大于外部壓強(qiáng)進(jìn)而使肺內(nèi)氣體排出�����,對于空氣動力學(xué)粒徑較小的顆粒在吸氣過程中不易沉降在肺內(nèi)故而伴隨著呼氣過程外出體外���。
基于對呼吸過程的理解以及成像技術(shù)的支持���,確定了空氣動力學(xué)粒徑與體內(nèi)沉降部位的一系列關(guān)系。
|
呼吸系統(tǒng) |
沉降粒度范圍 |
|
咽喉部位及其以上 |
約≥5μm |
|
氣管(主支氣管) |
約3~5μm |
|
次級支氣管 |
約2~3μm |
|
支氣管末端 |
約1~2μm |
|
肺泡 |
約0.5~1μm |
空氣動力學(xué)粒徑小于0.5μm的細(xì)顆粒一般會伴隨著呼氣過程排出�����。
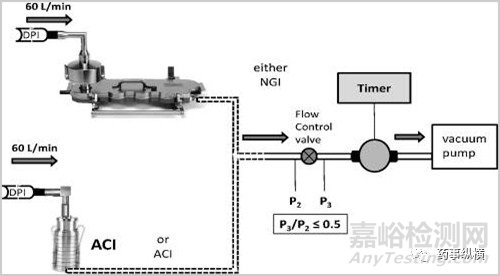
基于對上述過程的理解���,開發(fā)出了ACI��、NGI�����、MSLI等一系列模擬體內(nèi)DPI沉降的儀器��。
該類設(shè)備的工作原理簡述為在一定流速以及壓差條件下氣溶膠在不同孔徑的級段內(nèi)發(fā)生撞擊并產(chǎn)生沉降進(jìn)而區(qū)分出不同的空氣動力學(xué)粒度顆粒進(jìn)而關(guān)聯(lián)體內(nèi)吸收部位的沉降���;基于設(shè)備的設(shè)計機(jī)理只能近似的模擬體內(nèi)的吸入過程(例如制劑體內(nèi)的吸入過程是一個在一定潮氣環(huán)境中的壓差遞減的吸入過程而上述設(shè)備常提供一個均衡的壓差)���;然而對于仿制制劑的開發(fā)而言該類設(shè)備提供了非常好的體外評價基礎(chǔ)。
DPI開發(fā)
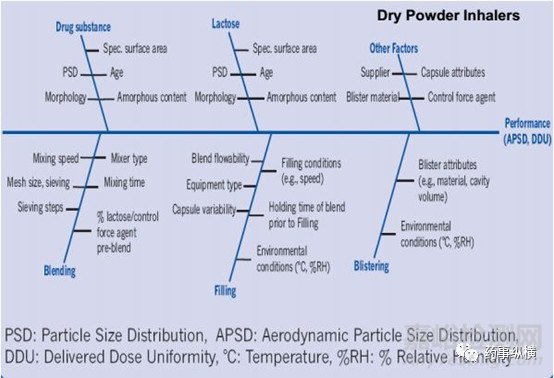
基于對上述體內(nèi)吸入過程的理解�����,吸入制劑的開發(fā)的重中之重則為如何實現(xiàn)適量藥物在肺內(nèi)的沉積進(jìn)而實現(xiàn)治療作用�����,而對于吸入仿制制劑的開發(fā)而言實現(xiàn)藥物在呼吸系統(tǒng)各部位的等量沉積是保證治療等效的重要基礎(chǔ)���。顯然��,吸入制劑的關(guān)鍵質(zhì)量屬性除了常規(guī)制劑含量���、有關(guān)物質(zhì)等之外還包括APSD(AerodynamicParticle size Distribution)以及DDU(Delivered DoseUniformity)等其特有的質(zhì)量屬性���。吸入制劑終產(chǎn)品的獲得是一系列開發(fā)項目綜合作用的結(jié)果�����。主要影響因素包括配方��、生產(chǎn)工藝�����、吸入裝置以及包裝密封系統(tǒng)��,具體研究細(xì)節(jié)方面問題希望同行多多交流���。
吸入制劑的開發(fā)涉及產(chǎn)品的多個維度�����,然最核心的維度此處筆者可簡述為:吸入制劑的開發(fā)的核心是對藥物分散���、再吸附、再分散的過程理解��;是對一系列力學(xué)平衡的過程的理解(主要包括原料與原料之間的內(nèi)聚力以及原料與載體之間的粘附力的平衡��,基于此平衡的達(dá)成會引入靜電力、范德華力��、表面張力以及毛細(xì)管力等影響因素��,故而任何配方開發(fā)�����、工藝開發(fā)�����、裝置開發(fā)以及包裝系統(tǒng)的開發(fā)都需以此為指導(dǎo))���。
本文多次提到空氣動力學(xué)粒度這一概念���,眾所周知此概念并非指激光衍射法或顯微鏡方法測定的物理尺寸,實質(zhì)上該粒度與物理尺寸和物理密度兩者綜合相關(guān)���,故而在實際研發(fā)當(dāng)中出現(xiàn)D90內(nèi)控需在很小粒度之下時切勿大驚小怪��。
國內(nèi)外法規(guī)對比
我國15版藥典較10版藥典在吸入制劑的相關(guān)檢測方面有了較大的提高�����,然而與EP以及USP在相關(guān)項目的檢測方法和可接受標(biāo)準(zhǔn)上依然存在一定差異���。主要對比如下:
中國藥典

歐洲藥典
美國藥典
生物等效性研究的要求
我國尚未頒布關(guān)于吸入制劑生物等效性方面的評價方法,下文簡要敘述EMA以及FDA對吸入制劑生物等效性方面的主要要求細(xì)則���。EMA和FDA關(guān)于吸入制劑生物等效性研究方面各自持有不同的審評理念��,這種差異主要體現(xiàn)為EMA認(rèn)為體外評價的靈敏度高于體內(nèi)評價故而當(dāng)仿制產(chǎn)品達(dá)到體外APSD等的一致即可滿足等效性要求��,F(xiàn)DA依然本著最科學(xué)的審評態(tài)度���,生物等效必須建立在生物等效的研究之上。
EMA體外一致即可滿足生物等效性的具體要求:
1. 藥學(xué)一致(劑型�����、劑量��、非活性組分)
2. 目標(biāo)遞送劑量一致(T/R,±15%)
3. 對于DPI裝置吸入氣流阻力一致(T/R,±15%)
4. 吸入足夠量體積時確?����;钚晕镔|(zhì)肺內(nèi)沉積量一致(T/R,±15%)
5. 每組或每級中的APSD分布一致(T/R,±15%)
若上述等效性不能建立則可進(jìn)行肺內(nèi)沉積相似性研究��,沉積相似則等效性建立;若肺內(nèi)沉積相似性不能建立則可進(jìn)行臨床以及藥效學(xué)相似性研究��,若建立則相似�����,若不能建立則“放棄治療”�����。
FDA生物等效性要求:
要求仿制藥需要證明與參比制劑具有相似的有效性和安全性��,包括:裝置等效���、體外等效��、PK等效以及PD/TE等效���。
筆者雜談
如本文圖一所示,近年來FDA所批準(zhǔn)DPIs大多是基于NDA進(jìn)行批準(zhǔn)��,對于該類制劑的仿制開發(fā)已然成了眾多藥企的掘金之處���。吸入制劑由于其較低的劑量以及對生產(chǎn)環(huán)境的高要求使得該類制劑開發(fā)具有較高的硬件要求���,國內(nèi)已有眾多企業(yè)在該劑型仿制領(lǐng)域內(nèi)取得了一定的成績��,筆者看來在該類劑型的仿制藥開發(fā)方面國內(nèi)依然處于摸石頭過河階段�����,對于以創(chuàng)新型制劑開發(fā)的企業(yè)而言吸入制劑或可是一個較好的選擇。
參考資料
1.Regulatory Perspetives on Implementing QbD for MDIs and DPIs
2.Guidance for Industry Metered Dose Inhaler (MDI) and Dry Powder Inhaler (DPI) Drug Product document
3.CPMP points to consider on the requirements for clinical Documentation for orally Inhaled Product(OIP) CPMP/EWP/4151/00