引言
《化學(xué)藥品注射劑滅菌和無菌工藝研究及驗證指導(dǎo)原則(試行)》中明確指出了“應(yīng)通過研究確定藥液配制后至過濾前的存放時間�����、藥液過濾操作的時間���、過濾后至灌裝前放置的時間等工藝時限來降低除菌過濾的風(fēng)險。”
國內(nèi)制藥企業(yè)對此指導(dǎo)原則的解讀大相徑庭�,導(dǎo)致了注射劑項目關(guān)于藥液存放時限的考察在實際研發(fā)生產(chǎn)過程中的做法不一�,本文章�����,以凍干粉針劑為例,參考CDE���、EU及PDA相關(guān)指導(dǎo)原則并結(jié)合作者的研發(fā)生產(chǎn)經(jīng)驗,對注射劑項目研發(fā)生產(chǎn)過程中關(guān)于藥液存放時限進行了系統(tǒng)性的考量���,不足之處,還請業(yè)內(nèi)同仁指出�����,共同學(xué)習(xí)�。
一�、國內(nèi)外相關(guān)指導(dǎo)原則
1���、國外相關(guān)指導(dǎo)原則
(1)EU GMP Annex 1 : Manufacture of Sterile Products(2020).
EU于2020-02-20發(fā)布GMP Annex 1 : Manufacture of Sterile Products(2020)修訂草案關(guān)于藥液存放時限的考量,如下:
從產(chǎn)品開始制備到通過除菌過濾器(如果適用)進行除菌或過濾直到無菌灌裝過程結(jié)束之間的時間�。考慮到產(chǎn)品的成分和規(guī)定的存儲方法�����,每種產(chǎn)品應(yīng)有最大允許時間�。
灌裝前無菌產(chǎn)品的保持時間�����。
無菌處理時間�����。
灌裝時間�����。
滅菌容器和封閉容器在關(guān)鍵加工區(qū)域(包括灌裝)密封前的最大暴露時間���。
解讀:
EU的GMP對生產(chǎn)過程中的產(chǎn)品保持時間明確的進行了分階段系統(tǒng)性的考察���,從而保證產(chǎn)品的質(zhì)量���。
(2)PDA Process Simulation Testing for Aseptically Filled Products echnical Report No. 22 (2011 Revision) of PDA.
PDA于2011年發(fā)布的《Process Simulation Testing for Aseptically Filled Products echnical Report No. 22》關(guān)于無菌灌裝產(chǎn)品的工藝模擬實驗的考量���,如下:
2.2Worst Case最差條件
在制藥工藝驗證中最常采用的技術(shù)之一是采用“最差條件”。采用“最差條件”是有意對工藝、系統(tǒng)���、設(shè)備在更高的挑戰(zhàn)條件下進行驗證。如果在“最差條件”的挑戰(zhàn)下�,仍能夠達到預(yù)期的可接受標準,那么在正常條件下�,對系統(tǒng)的可靠性將有更高的信心。工藝模擬實驗很容易進行“最差條件”的挑戰(zhàn)���。下面提供了類型的挑戰(zhàn):
使用的原料���、組件和密封在無菌工藝區(qū)域保留時間超出范圍;
解讀:
PDA對無菌灌裝產(chǎn)品的工藝模擬實驗有著詳盡的規(guī)定�,工藝模擬實驗證明了無菌生產(chǎn)工藝生產(chǎn)無菌產(chǎn)品的能力,可以根據(jù)此指導(dǎo)原則的出發(fā)點并結(jié)合產(chǎn)品在實際生產(chǎn)過程中物理及化學(xué)變化的考量�,從而對藥液存放時限進行思考。
2�����、國內(nèi)相關(guān)指導(dǎo)原則
(1)CDE:《化學(xué)藥品注射劑滅菌和無菌工藝研究及驗證指導(dǎo)原則(試行)》
國家藥品監(jiān)督管理局藥品審評中心(CDE)于2020-12-31發(fā)布的《化學(xué)藥品注射劑滅菌和無菌工藝研究及驗證指導(dǎo)原則(試行)》中對藥液存放時限有明確規(guī)定���。如下:
研究確定藥液配制后至過濾前的存放時間�、藥液過濾操作的時間�、過濾后至灌裝前放置的時間等工藝時限,降低除菌過濾的風(fēng)險�。
解讀:
CDE參考了EU、FDA�、PDA等相關(guān)指導(dǎo)原則并結(jié)合實際生產(chǎn)���,關(guān)注到了無菌工藝生產(chǎn)過程中關(guān)鍵工序的風(fēng)險點(工序?qū)Ξa(chǎn)品物理、化學(xué)�����、生物學(xué)及微生物學(xué)的影響)�,從而對藥液存放時限的考察制定了科學(xué)合理的規(guī)定。
二�、藥液存放時限的系統(tǒng)性考量
藥液存放時限的系統(tǒng)性考量需要依據(jù)車間實際生產(chǎn)步驟(生產(chǎn)系統(tǒng)���、設(shè)備參數(shù)及生產(chǎn)組件)指導(dǎo)小試開發(fā)�����,再根據(jù)小試開發(fā)結(jié)果進行放大生產(chǎn)驗證���,從而形成可持續(xù)生產(chǎn)出符合質(zhì)量要求的產(chǎn)品工藝�����。
1、藥液存放時限的開發(fā)
(1)評估生產(chǎn)工序?qū)λ幰捍娣艜r限的風(fēng)險���;
(2)根據(jù)可能影響藥液存放時限的工藝參數(shù),進行小試開發(fā)�����;
(3)根據(jù)小試開發(fā)結(jié)果進行放大生產(chǎn)驗證���;
(4)根據(jù)放大生產(chǎn)驗證的結(jié)果指導(dǎo)工藝驗證�����;
(5)形成科學(xué)合理的藥液存放時限�;
2、生產(chǎn)工序?qū)λ幰捍娣艜r限的風(fēng)險評估
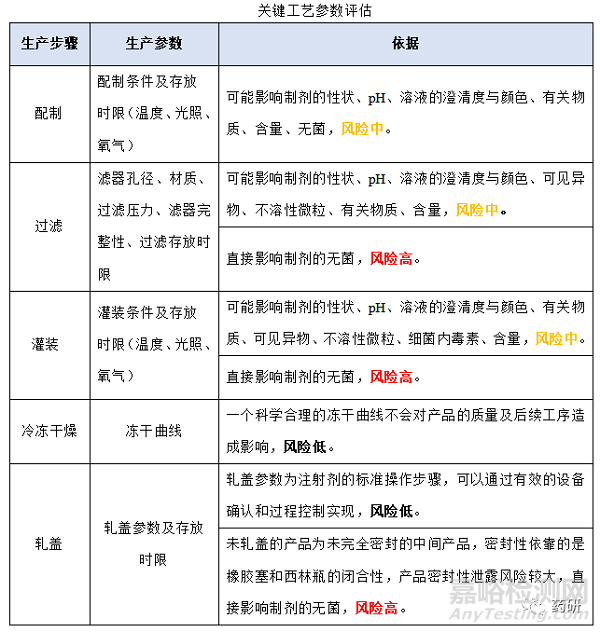
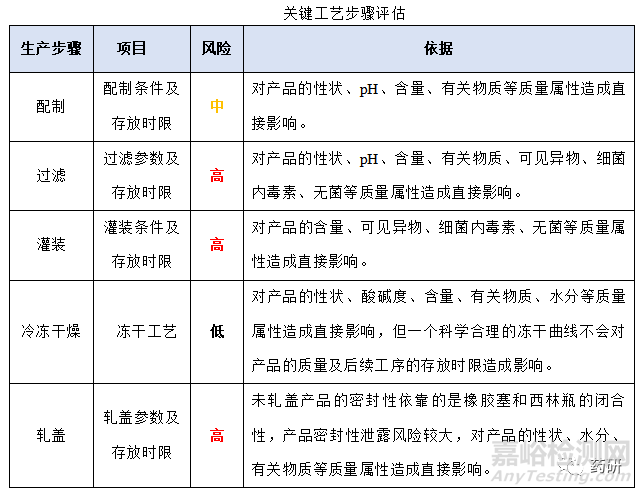
(1)關(guān)鍵工藝步驟評估
(2)關(guān)鍵工藝參數(shù)評估
(3)生產(chǎn)過程中的存放時限
(4)確定生產(chǎn)過程中的存放時限
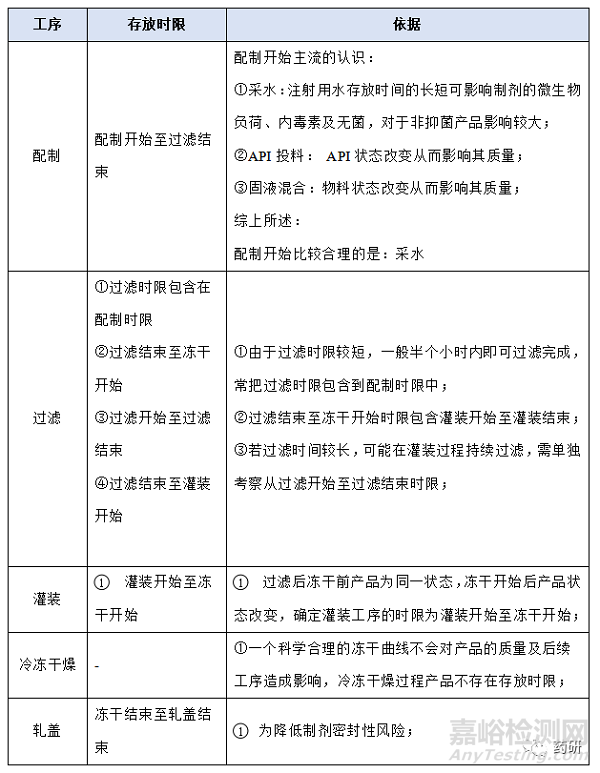
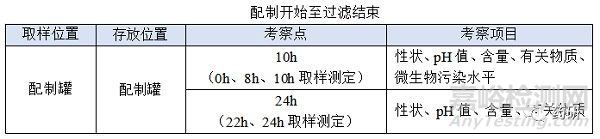
① 配制開始至過濾結(jié)束�;
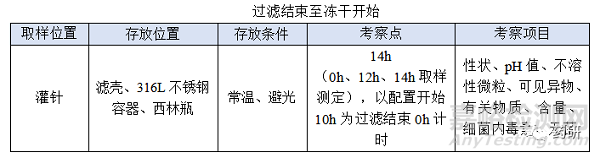
② 過濾結(jié)束至凍干開始���;
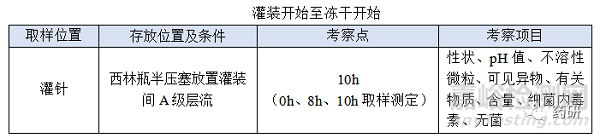
③ 灌裝開始至凍干開始���;
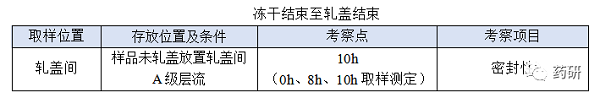
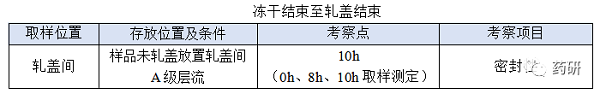
④ 凍干結(jié)束至軋蓋結(jié)束���;
3、藥液存放時限的小試開發(fā)
3.1 配制�����、過濾及灌裝
注意事項:
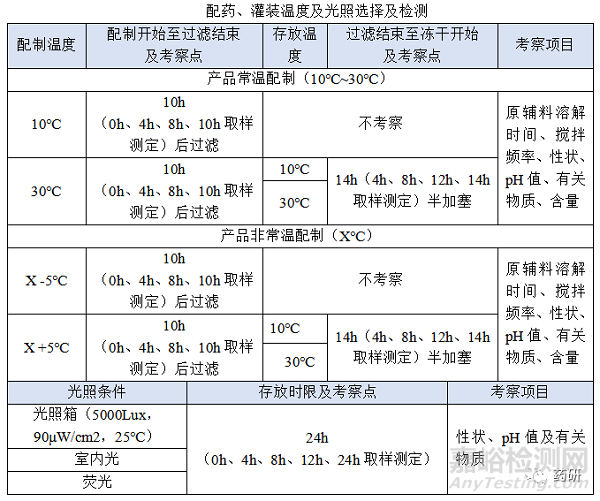
(1)配制開始至過濾結(jié)束�,溫度:常溫配制的產(chǎn)品一般考察10℃~30℃,高溫X℃配制的產(chǎn)品一般考察X-5℃~X+5℃���,特殊品種另外考慮�;
(2)配制開始至過濾結(jié)束���,時間:對于普通凍干粉針劑從配制開始到配置結(jié)束一般不超過4h,中間產(chǎn)品檢測一般不超過2h���,過濾一般不超過0.5h,考察10h是為了應(yīng)對生產(chǎn)異常���,特殊品種另外考慮���;
(3)過濾結(jié)束至凍干開始,溫度:無論是常溫配制還是高溫配制一般都在配制結(jié)束降至常溫過濾灌裝�,低溫配制灌裝產(chǎn)品、降溫后改變藥液狀態(tài)(如黏度)產(chǎn)品等特殊品種另外考慮�����;
(4)過濾結(jié)束至凍干開始���,時間:對于普通凍干粉針劑從灌裝開始至凍干開始一般不超過8h���,過濾結(jié)束至凍干開始考察14h是為了應(yīng)對生產(chǎn)異常�����,特殊品種另外考慮;
(5)通過對生產(chǎn)過程分析,產(chǎn)品與光照接觸的位置有:
① 投料時短暫接觸�;
② 灌裝時短暫接觸���;
③ 灌裝機停機時接觸;
④ 灌裝完成轉(zhuǎn)移至凍干機短暫接觸�;
⑤ 凍干機等待開始凍干時接觸�;
制藥生產(chǎn)車間一般采用熒光燈(照度為300lx)�����,小試考察光照箱(5000Lux�����,90μW/cm2���,25℃)���、室內(nèi)光、熒光可覆蓋正常生產(chǎn)時的光源�����,考察時間24h可覆蓋產(chǎn)品與光照最長接觸時間�����,特殊品種另外考慮�����;
3.2 冷凍干燥
不考察
3.3 軋蓋
注意事項:
(1)凍干結(jié)束至軋蓋結(jié)束�,時間:對于普通凍干粉針劑從凍干結(jié)束至軋蓋結(jié)束一般不超過8h�,考察10h是為了應(yīng)對生產(chǎn)異常�����,特殊品種另外考慮;
4�����、放大生產(chǎn)過程中考察藥液存放時限
依據(jù)小試開發(fā)結(jié)果設(shè)計放大生產(chǎn)中關(guān)于藥液存放時限的考察,若小試開發(fā)上述考察結(jié)果皆不影響產(chǎn)品質(zhì)量�,可依據(jù)小試開發(fā)結(jié)果設(shè)計放大生產(chǎn),若小試開發(fā)上述考察結(jié)果影響產(chǎn)品質(zhì)量���,則重新設(shè)計小試工藝���。
4.1 模擬存放
4.1.1 配制
注意事項:
(1)存放容器盡量選擇和配制罐材質(zhì)一致,頂空氣體與配制罐一致�;
(2)存放條件(溫度、光照)與在配制罐一致���;
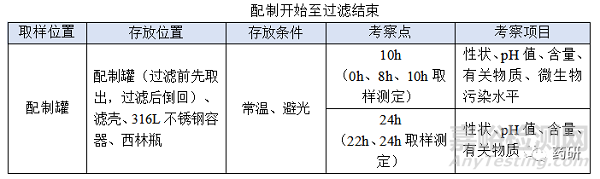
(3)配制開始至過濾結(jié)束時限目標定為8h�,考察10h留有冗余���;
(4)使用經(jīng)驗證的濾器不會改變產(chǎn)品的理化性質(zhì),考察22h包含過濾結(jié)束至凍干開始12h�,考察24h留有冗余;
4.1.2 過濾
注意事項:
(1)時間點的選擇需以配置開始10h為過濾結(jié)束0h計時���;
(2)過濾結(jié)束至凍干開始目標定為12h�,考察14h留有冗余�;
4.1.3 灌裝
注意事項:
(1)過濾結(jié)束至凍干開始時限包含灌裝開始至凍干開始時限;
(2)存放條件與正常生產(chǎn)一致(A級層流)�����;
(3)根據(jù)灌裝開始的含量確定排液體積;
(4)灌裝開始至凍干開始時限目標定為8h�,考察10h留有冗余;
4.1.4 冷凍干燥
不考慮時限�����;
4.1.5 軋蓋
注意事項:
(1)存放條件與正常生產(chǎn)一致(A級層流)�����;
(2)凍干結(jié)束至軋蓋結(jié)束時限目標定為8h�����,考察10h留有冗余���;
4.2 真實存放
4.2.1 配制
注意事項:
(1)配制開始后10h過濾���;
(2)過濾前將用于22h、24h取樣檢測的藥液取出�,待過濾完成倒回配制罐;
4.2.2 過濾
注意事項:
(1)過濾結(jié)束14h再開始凍干;
4.2.3 灌裝
注意事項:
(1)灌裝開始10h再開始凍干�����;
(2)在凍干結(jié)束后取灌裝在8h~10h之間的樣品用于影響因素或穩(wěn)定性考察�;
4.2.4 冷凍干燥
不考慮時限;
4.2.5 軋蓋
注意事項:
(1)軋蓋工序時限模擬存放與真實持續(xù)相應(yīng)時間存放無明顯差別�,可模擬存放;
5 工藝驗證過程中考察藥液存放時限
依據(jù)放大生產(chǎn)過程中藥液存放時限考察的結(jié)果設(shè)計工藝驗證藥液存放時限�����,若放大生產(chǎn)上述考察結(jié)果皆不影響產(chǎn)品質(zhì)量���,可依據(jù)放大生產(chǎn)結(jié)果設(shè)計工藝驗證存放時限�,若放大生產(chǎn)上述考察結(jié)果影響產(chǎn)品質(zhì)量�,則重新設(shè)計放大生產(chǎn)工藝或依據(jù)相應(yīng)數(shù)據(jù)設(shè)計工藝驗證藥液存放時限。
三�、參考資料
1、化學(xué)藥品注射劑滅菌和無菌工藝研究及驗證指導(dǎo)原則(試行)
2���、《中國藥典》( 2020年版)中國醫(yī)藥科技出版社, 2020.
3�、國家藥品監(jiān)督管理局.關(guān)于發(fā)布除菌過濾技術(shù)及應(yīng)用指南等3個指南的通告(2018年第85號)
4、EU.GMP Annex 1 : Manufacture of Sterile Products(2020).
5���、EMA. Guideline on the sterilisation of the medicinal product, active substance, excipient and primary container(2019).
6�、PDA Process Simulation Testing for Aseptically Filled Products echnical Report No. 22 (2011 Revision) of PDA.