今日頭條
豪森長效EPO激動劑獲批上市��。豪森藥業(yè)自研創(chuàng)新藥培莫沙肽(商品名:圣羅萊)獲國家藥監(jiān)局批準上市��,用于未接受紅細胞生成刺激劑(ESA)治療的成人非透析患者��,及正在接受短效促紅細胞生成素(EPO)治療的成人透析患者(該產(chǎn)品不適用于在需要立即糾正貧血的患者中替代紅細胞輸注)��。培莫沙肽是一種長效的新型多肽類EPO受體激動劑��。該新藥的第2項適應癥上市申請已在去年5月獲得CDE受理��,適應癥為慢性腎臟病(CKD)非透析患者貧血��。
國內(nèi)藥訊
1.再鼎引進FcRn拮抗劑獲批上市��。再鼎醫(yī)藥從argenx公司引進的FcRn拮抗劑艾加莫德α注射液(efgartigimod)獲國家藥監(jiān)局批準上市��,與常規(guī)治療藥物聯(lián)合,用于治療乙酰膽堿受體(AChR)抗體陽性的成人全身型重癥肌無力(gMG)患者��。艾加莫德α注射液旨在減少致病性IgG抗體��,阻斷IgG再循環(huán)過程��。2021年12月��,F(xiàn)DA批準efgartigimod上市��,成為全球首款獲批上市的FcRn拮抗劑��。
2.馴鹿/信達BCMA靶向CAR-T獲批上市��。馴鹿生物與信達生物聯(lián)合開發(fā)的靶向BCMA的CAR-T產(chǎn)品伊基奧侖賽注射液(曾用名:伊基侖賽注射液)獲國家藥監(jiān)局批準上市��,用于治療至少3線治療后進展的復發(fā)或難治性多發(fā)性骨髓瘤(MM)成人患者��。2023ASCO年會上更新的Ⅰ/Ⅱ期臨床數(shù)據(jù)顯示��,中位隨訪為13.8個月時��,總體緩解率(ORR)為 96.0%��,12個月PFS率為78.8%(95% CI: 68.6–85.97)。
3.億騰引進新一代TPO激動劑獲批上市��。億騰醫(yī)藥從鹽野義制藥引進的新一代口服小分子血小板生成素(TPO)受體激動劑蘆曲泊帕片獲國家藥監(jiān)局批準上市��,用于計劃接受手術的慢性肝病(CLD)伴血小板減少癥的成人患者��。在Ⅲ期臨床中��,與安慰劑相比��,蘆曲泊帕顯著提高患者第8天的有效應答(達到PLT≥50×109/L且較基線升高≥20×109/L��,并且未接受過為出血采取的急救治療的受試者)比例(43.2%vs4.5%)��。
4.基石PD-L1單抗食管鱗癌Ⅲ期臨床積極��。基石藥業(yè)PD-L1單抗舒格利單抗注射液聯(lián)合化療一線治療無法手術切除的局部晚期��、復發(fā)或轉移性食管鱗癌的Ⅲ期GEMSTONE-304研究成果公布于ESMO GI 2023年會上��。與安慰劑聯(lián)合化療相比��,舒格利單抗聯(lián)合化療顯著改善BICR評估的無進展生存期(中位PFS:6.2個月vs5.4個月)和總生存期(中位OS:15.3個月vs11.5個月)��,達到預設雙終點。此外��,藥物總體安全性良好��。
5.信達BCMA靶向CAR-T獲批臨床��。信達細胞1類生物制品IBI346獲國家藥監(jiān)局臨床許可��,擬開發(fā)治療復發(fā)/難治多發(fā)性骨髓瘤(MM)��。IBI346是一款靶向BCMA的CAR-T療法��,由P329G BCMA抗體和P329G CAR-T細胞兩個部分組成��。據(jù)悉��,信達生物正在華中科技大學同濟醫(yī)學院附屬同濟醫(yī)院開展一項評價輸注IBI346治療復發(fā)/難治MM的安全性和有效性的開放��、單臂臨床研究��。
6.杭州尚健CD38抗體獲批自免病臨床��。杭州尚健生物自研1類生物制品SG301 SC注射液獲國家藥監(jiān)局臨床許可��,適應癥為系統(tǒng)性紅斑狼瘡��。SG301 SC是在SG301注射液(靜脈輸注)的基礎上開發(fā)的一款皮下注射給藥制劑��,可通過多種機制殺傷或者誘導CD38高表達漿細胞/漿母細胞的凋亡��,抑制自身抗體的產(chǎn)生��。此前��,尚健生物開發(fā)的SG301注射液(靜脈輸注)臨床適應癥為多發(fā)性骨髓瘤��。
國際藥訊
1.A型血友病基因療法獲批上市��。BioMarin公司基因療法Roctavian(valoctocogene roxaparvovec)獲FDA批準上市��,用以治療經(jīng)檢測��、確認不帶有抗腺相關病毒5(AAV5)的抗體的嚴重血友病A患者(凝血因子VIII [FVIII]活性< 1 IU/dL)��。在Ⅲ期試驗GENEr8-1中��,中位隨訪時間為3年時��,Roctavian治療組患者年化出血率(ABR)為2.6次年��,與其接受常規(guī)FVIII預防性治療時的基線ABR(5.4次出血/年)相比��,平均ABR下降了52%。
2.THR-β激動劑NASH適應癥報NDA��。Madrigal公司潛在“first-in-class”口服選擇性甲狀腺激素受體(THR)-β激動劑resmetirom已向FDA滾動提交新藥申請��,用于治療伴有肝纖維化的非酒精性脂肪性肝炎 (NASH) 患者��。在Ⅲ期臨床(MAESTRO-NASH)中��,與安慰劑相比��,resmetirom(80mg和100mg)治療達到非酒精性脂肪肝活動評分(NAS)降低≥2分��,且肝纖維化無惡化的患者比例更多(26%和30%��,vs10%)��;達到肝纖維化至少改善一個階段��,且NAS無惡化的患者比例更高(24%和26%��,vs14%)��。
3.阿斯利康CTLA-4單抗肝癌Ⅲ期臨床積極��。阿斯利康CTLA-4抗體Imjudo(tremelimumab)聯(lián)合PD-L1抗體Imfinzi(durvalumab)一線治療不可切除肝癌患者的Ⅲ期臨床HIMALAYA最新結果將公布于ESMO World GI 2023年會中��。四年隨訪數(shù)據(jù)顯示��,與sorafenib相比��,Imjudo聯(lián)合治療使患者的死亡風險下降22%(HR:0.78��,95% CI:0.67-0.92��,數(shù)據(jù)成熟度為78%)��;患者四年生存率預估達到25.2%(vs15.1%)��。在長期隨訪中未觀察到新的安全信號��。
4.CD20/3雙抗濾泡性淋巴瘤早期臨床積極��。艾伯維與Genmab聯(lián)合開發(fā)的皮下給藥CD20/CD3雙抗epcoritamab��,在治療復發(fā)或難治性濾泡性淋巴瘤(FL)的Ⅰ/Ⅱ期臨床中獲積極結果��。獨立審查委員會評估的總緩解率達到82%��,超過預先設定的療效閾值��。詳細結果將在醫(yī)學會議上公布��。今年5月,該新藥已獲得FDA批準上市��,用于治療復發(fā)或難治性彌漫性大B細胞淋巴瘤(DLBCL)��。
5.諾華25億美元出售眼科資產(chǎn)給博士倫��。諾華宣布已與博士倫達成協(xié)議��,將其部分眼科資產(chǎn)剝離給博士倫��,交易總額高達25億美元��,預計2023年下半年完成��。本次剝離的資產(chǎn)包括已上市的干眼癥藥物Xiidra��、慢性眼表疼痛在研藥物SAF312 (libvatrep)��、AcuStream給藥裝置使用權利以及處于臨床前開發(fā)階段的第二代TRPV1拮抗劑OJL332等��。根據(jù)協(xié)議��,諾華將獲得與Xiidra��、SAF312和OJL332的未來銷售相關里程碑付款��,金額高達7.5億美元��。
6.禮來收購糖尿病細胞療法公司Sigilon��。禮來宣布以總金額約為3.096億美元收購細胞療法公司Sigilon��。該公司利用其專有Afibromer™生物材料基質(zhì)包裹技術開發(fā)的封裝細胞療法��,能夠保護細胞免受免疫排斥��,在植入體內(nèi)后也不會引發(fā)組織纖維化��,用于治療糖尿病��、內(nèi)分泌異常等疾病��。2018年��,禮來與Sigilon公司達成合作協(xié)議��,共同開發(fā)用于1型糖尿病治療的封裝細胞療法��,包括SIG-002��。
醫(yī)藥熱點
1.“十四五”全國規(guī)劃配置大型醫(yī)用設備3645臺��。近日,國家衛(wèi)健委印發(fā)《關于發(fā)布“十四五”大型醫(yī)用設備配置規(guī)劃的通知》��,明確“十四五”期間��,全國規(guī)劃配置大型醫(yī)用設備3645臺��,其中甲類117臺��、乙類3528臺��?�!锻ㄖ芬?�,各地要嚴格執(zhí)行規(guī)劃數(shù)量布局��,科學把握配置標準��;為社會辦醫(yī)配置預留合理空間��;認真履行行政許可程序��,嚴格評審要求��,規(guī)范審批行為��。
2.北京協(xié)和醫(yī)學院天津醫(yī)院(一期)項目交付��。近日��,位于天津健康產(chǎn)業(yè)國際合作示范區(qū)內(nèi)的北京協(xié)和醫(yī)學院天津醫(yī)院(一期)項目正式交付��。協(xié)和天津醫(yī)院項目總投資約50億元��,規(guī)劃總床位數(shù)不低于1800張��,總建筑面積36萬平方米��。其中項目一期設置床位1000張��,建筑面積16.4萬平方米��。項目建成后��,將與天津健康研究院��、細胞生態(tài)海河實驗室等進行全維度強強聯(lián)合��,打造形成“協(xié)和天津”的品牌和聲譽��。
3.廣西實行全區(qū)異地就醫(yī)結算“免備案”��。廣西壯族自治區(qū)醫(yī)保局近日召開新聞發(fā)布會,宣布從7月1日起��,廣西職工基本醫(yī)保(含生育保險)和城鄉(xiāng)居民基本醫(yī)保參保人員在參保統(tǒng)籌地區(qū)外��、自治區(qū)內(nèi)定點醫(yī)藥機構異地就醫(yī)��,將實行“免備案”管理服務��。參保人員可自主選擇在自治區(qū)內(nèi)所有定點醫(yī)藥機構就醫(yī)購藥��,相關醫(yī)療費用按參保地就醫(yī)報銷比例執(zhí)行��。參保民眾不用承擔因未辦理備案而降低報銷比例的費用��,由醫(yī)?�;疬M行支付��。
評審動態(tài)
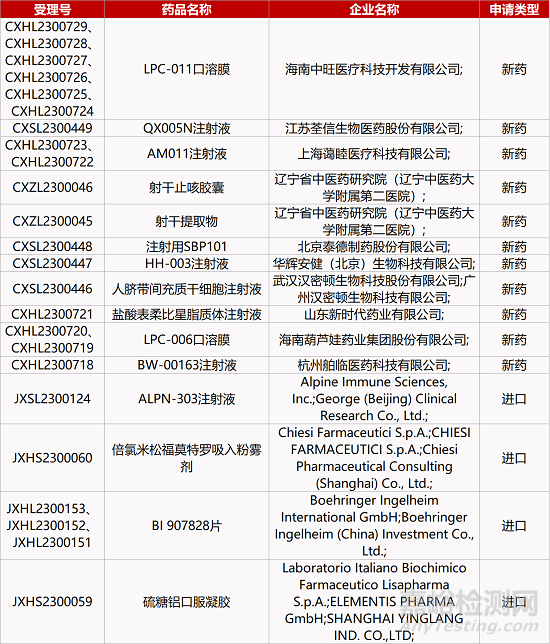
1. CDE新藥受理情況(07月02日)
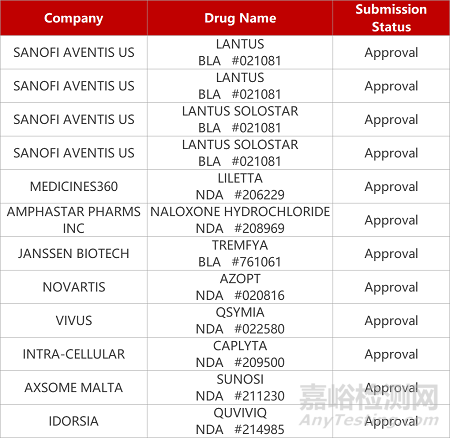
2. FDA新藥獲批情況(北美06月29日)