今日頭條
海思科長效DPP-4抑制劑降糖臨床積極���。海思科二肽基肽酶-4(DPP-4)超長效抑制劑HSK7653片在ADA年會上公布單藥治療2型糖尿病(T2DM)的Ⅲ期臨床積極結(jié)果����。與安慰劑相比,HSK7653(10mg和25mg)組用藥24周后患者HbA1c較基線降幅顯著更大���,有更多的患者HbA1c控制在<7.0%或<6.5%�;兩組不良事件發(fā)生率相似����。此外,海思科也在會議上公布了治療糖尿病周圍神經(jīng)痛(DPNP)的“思美寧HSK16149”膠囊的Ⅲ期臨床積極結(jié)果�。
國內(nèi)藥訊
1.艾伯維IL-23抑制劑中國報產(chǎn)。艾伯維IL-23抑制劑利生奇珠單抗(risankizumab�,曾用名瑞莎珠單抗)注射液及其皮下注射劑型的上市申請獲國家藥監(jiān)局受理。Rrisankizumab旨在通過與IL-23 p19亞基結(jié)合來選擇性阻斷IL-23����,以治療多種慢性免疫介導(dǎo)疾病����。艾伯維已在國內(nèi)登記7項臨床研究,分別用于治療活動性銀屑病關(guān)節(jié)炎�,中重度潰瘍性結(jié)腸炎����、克羅恩病���。其中���,用于治療克羅恩病的兩項III期研究已完成。
2.諾和諾德啟動減肥復(fù)方中國III期研究����。諾和諾德雙重作用機制復(fù)方CagriSema登記啟動一項III期臨床(CTR20232030),擬評估在中國超重或肥胖受試者中Cagrilintide s.c. 2.4 mg聯(lián)合Semaglutide s.c. 2.4 mg(CagriSema s.c.2.4 mg/2.4 mg)每周一次給藥的有效性和安全性���。該項試驗的主要研究者由中國人民解放軍總醫(yī)院母義明博士擔(dān)任�。CagriSema由長效胰淀素類似物cagrilintide和GLP-1受體激動劑司美格魯肽組成���。
3.諾潔貝眼科AAV基因療法報IND����。蘇州諾潔貝生物1類生物制品“NGGT001注射液”的臨床試驗申請獲CDE受理�。NGGT001是一款基于rAAV2的基因療法,通過表達(dá)密碼子優(yōu)化的人CYP4V2�,用于治療罕見的結(jié)晶樣視網(wǎng)膜變性(BCD)���。在BCD相關(guān)細(xì)胞模型中,由NGGT001介導(dǎo)的CYP4V2表達(dá)有效地挽救了由CYP4V2突變引起的表型缺陷�,顯示出恢復(fù)自噬流活性,減少脂質(zhì)積累和保持細(xì)胞活力的治療潛力�。
4.同源康EGFR/HER2抑制劑國內(nèi)獲批臨床。同源康醫(yī)藥自主研發(fā)的新一代口服小分子EGFR/HER2酪氨酸激酶抑制劑(TKI) TY-4028獲國家藥監(jiān)局臨床許可���,擬開發(fā)用于治療攜帶EGFR或HER2 20號外顯子插入突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌����。TY-4028旨在通過抑制跨膜受體蛋白及其下游信號分子的磷酸化來調(diào)節(jié)腫瘤細(xì)胞的增殖和凋亡�。今年4月,該新藥已在美國獲得臨床批件���。同源康醫(yī)藥計劃在中美同步TY-4028的臨床開發(fā)�。
5.美德納(中國)公司落戶上海�。Moderna在中國新注冊的美德納(中國)生物科技有限公司在上海與閔行區(qū)政府舉行投資協(xié)議簽約儀式。未來���,Moderna將會在中國建廠并進(jìn)行生產(chǎn),生產(chǎn)的任何藥物都將專門針對中國患者,而不會出口�;在中國率先落地的產(chǎn)品將包括Moderna的呼吸道疫苗產(chǎn)品�,例如呼吸道合胞病毒(RSV)疫苗和流感疫苗���。根據(jù)協(xié)議���,Moderna總投資規(guī)模有望達(dá)到10億美元量級。
6.中生制藥與武田達(dá)成合作許可協(xié)議����。武田與中國生物制藥全資附屬公司invoX Pharma旗下F-star Therapeutics達(dá)成合作許可協(xié)議,利用后者專有的全人Fcab及四價mAb²平臺�,針對未披露的免疫腫瘤學(xué)靶點的新型Fcab結(jié)構(gòu)域,合作開發(fā)新一代多特異性免疫候選療法���。根據(jù)協(xié)議���,武田將支付一筆未披露金額的預(yù)付款,約10億美元里程碑金額�,以及一定比例的銷售分成。F-star公司將保留研究�、開發(fā)及商業(yè)化包含若干其他Fcab結(jié)構(gòu)的抗體的權(quán)利。
國際藥訊
1.莫德納RSV疫苗遞交全球監(jiān)管申請�。Moderna公司編碼RSV融合前F糖蛋白的mRNA疫苗mRNA-1345已向歐洲藥品管理局(EMA)、瑞士Swissmedic以及澳大利亞TGA提交了上市申請�,用于60歲以上成人預(yù)防RSV相關(guān)的下呼吸道疾病(RSV-LRTD)和急性呼吸疾?��。ˋRD)。在Ⅲ期臨床ConquerRSV中�,mRNA-1345預(yù)防出現(xiàn)兩種或兩種以上RSV-LRTD癥狀的效力達(dá)到83.7%。在美國����,該疫苗已向FDA提交滾動BLA上市申請。
2.諾華CD20單抗治療RMS長期療效積極����。諾華在EAN2023年會上公布其每月一次皮下注射給藥的CD20單抗Kesimpta(奧法妥木單抗)治療復(fù)發(fā)型多發(fā)性硬化癥(RMS)的擴展研究(ALITHIOS)長期結(jié)果。數(shù)據(jù)顯示���,Kesimpta連續(xù)治療長達(dá)5年����,在降低復(fù)發(fā)率和顯著抑制MRI病變活動方面均顯示出持續(xù)的療效���,NEDA-3(無疾病活動證據(jù))達(dá)標(biāo)率逐年升高�;從特立氟胺轉(zhuǎn)換為使用奧法妥木單抗的患者�,在五年治療期間內(nèi)年復(fù)發(fā)率顯著降低。
3.安斯泰來Claudin 18.2抗體獲優(yōu)先審評資格�。安斯泰來CLDN18.2單抗zolbetuximab的生物制品許可申請(BLA)獲FDA受理,用于一線治療CLDN18.2陽性局部晚期不可切除或轉(zhuǎn)移性HER2陰性胃或胃食管結(jié)合部(GEJ)腺癌患者���。FDA同時授予其優(yōu)先審評資格���,PDUFA日期為明年1月12日。在Ⅲ期試驗(GLOW)中���,與安慰劑聯(lián)合CAPOX化療相比���,zolbetuximab與CAPOX聯(lián)合治療顯著改善無進(jìn)展生存期(8.21個月vs6.80個月)和總生存期(中位OS:14.39個月vs12.16個月)。
4.禮來啟動2項三靶點激動劑III期臨床�。禮來在Clinicaltrials.gov網(wǎng)站上登記注冊GLP-1R/GIPR/GCGR三靶點激動劑Retatrutide用于治療肥胖/超重患者的兩項國際III期臨床(TRIUMPH-1和TRIUMPH-2)。TRIUMPH-1預(yù)計納入2100例肥胖癥/超重患者���,患者亞組包括膝關(guān)節(jié)炎(OA)����、睡眠呼吸阻塞(OSA)亞組�;TRIUMPH-2針對合并肥胖/超重的2型糖尿病患者,預(yù)計納入1000例患者���,同樣包含OSA亞組���。兩項研究開展地區(qū)都包含中國����。
5.IL-36R單抗預(yù)防GPP的IIb期臨床積極���。勃林格殷格翰在WCD大會上公布IL-36R單抗spesolimab(佩索利單抗)用于預(yù)防泛發(fā)性膿皰型銀屑病(GPP)急性發(fā)作的EFFISAYIL™ 2臨床試驗的最新數(shù)據(jù)�。與安慰劑相比���,佩索利單抗能顯著降低GPP發(fā)作風(fēng)險84%長達(dá)48周���。臨床中,佩索利單抗和安慰劑治療的患者不良事件發(fā)生率相似�。此前,佩索利單抗已分別獲得FDA和NMPA授予的突破性療法認(rèn)定���。
6.TAC-T細(xì)胞療法早期臨床積極����。Triumvira公司在ESMO2023和ASCO2023大會上公布其TAC-T細(xì)胞療法TAC01-HER2治療HER2陽性實體腫瘤的I/II期臨床最新結(jié)果���。數(shù)據(jù)顯示����,TAC01-HER2在經(jīng)DL 2-4化藥預(yù)處理的胃癌/胃食管交界性腺癌/食道癌患者中,ORR為33%�,DCR為83%�。在最高劑量水平下觀察到1例3級肺炎的DLT(劑量限制性毒性)和1例3級CRS,均通過標(biāo)準(zhǔn)護理措施解決���;所有隊列均未報告神經(jīng)毒性�。
醫(yī)藥熱點
1.國自然放寬女性科研人員“杰青”年齡限制�。近日,國家自然科學(xué)基金委員會黨組召開會議���,聽取國家自然科學(xué)基金對女性科研人員支持情況匯報����,審議通過進(jìn)一步加強對女性科研人員支持的建議���。會議明確���,從2024年起�,將女性科研人員申請國家杰出青年科學(xué)基金項目的年齡限制由45周歲放寬到48周歲���。
2.全國疾控電話流調(diào)專用號碼啟用�。6月26日����,“95120”全國電話流調(diào)系統(tǒng)在全國各級疾控機構(gòu)正式啟用。該系統(tǒng)具有統(tǒng)一外呼號碼����、AI智能外呼、來電提醒和掛機短信�、多終端應(yīng)用等功能,可實現(xiàn)全時段���、多場景開展電話流調(diào)���,有效降低被流調(diào)人員拒接率和漏接率,減輕基層流調(diào)人員工作壓力和強度�,提升工作效率。
3.國家醫(yī)保局就藥品續(xù)約競價征求意見����。7月4日���,國家醫(yī)保局發(fā)布《談判藥品續(xù)約規(guī)則(2023年版征求意見稿)》《非獨家藥品競價規(guī)則(征求意見稿)》。與2022年談判藥品續(xù)約規(guī)則相比���,《談判藥品續(xù)約規(guī)則(2023年版征求意見稿)》明確納入常規(guī)目錄管理的條件有所增加����,新增條件為:談判進(jìn)入目錄且連續(xù)納入目錄“協(xié)議期內(nèi)談判藥品部分”超過8年的藥品(2017年版目錄談判藥品自2018年起計算�,2018年版目錄談判藥品自2019年起計算�,2019年及以后按目錄執(zhí)行年份計算)。
評審動態(tài)
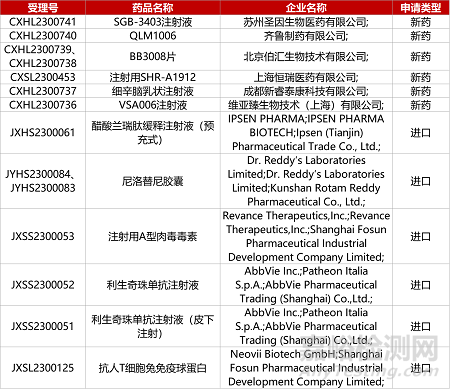
1. CDE新藥受理情況(07月06日)
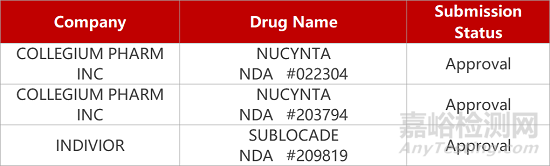
2. FDA新藥獲批情況(北美07月03日)