摘要
目的:總結(jié)我國兒童用藥臨床試驗期間藥物警戒監(jiān)管體系現(xiàn)狀與不足�,以期為進一步提升我國兒童用藥臨床試驗期間藥物警戒監(jiān)管工作能力提供參考。
方法:采用理論研究與比較分析法�,闡述了我國臨床試驗期間藥物警戒法規(guī)現(xiàn)狀,總結(jié)了針對兒童用藥臨床試驗期間藥物警戒法規(guī)制定的必要性���,對比了兒童用藥與成人用藥安全性報告審核思維的差異�����,對監(jiān)管機構(gòu)提出建議�。
結(jié)果:我國現(xiàn)有臨床試驗期間藥物警戒法規(guī)多為針對整體人群�,缺乏兒童用藥相關(guān)法規(guī)。兒童用藥臨床試驗期間安全性報告審核思維與成人報告差異較大�����,應(yīng)當(dāng)在制定審核標(biāo)準(zhǔn)時予以考慮���。結(jié)論 我國現(xiàn)有兒童用藥臨床試驗期間藥物警戒監(jiān)管工作需進一步加強�。
兒童用藥品種短缺���、劑量不明確是常見的共性問題�,很重要的原因在于兒童用藥研發(fā)技術(shù)要求高、臨床試驗風(fēng)險大�、收益率低等,造成企業(yè)研發(fā)積極性較差[1]�。我國新藥研發(fā)起步晚、基礎(chǔ)薄弱�����,更加劇了這一問題�����。為了破解這一難題�����,我國出臺了一系列鼓勵兒童用研發(fā)措施�����,持續(xù)推進藥品審評審批制度改革�,完善藥品審評審批體系[2]。改革成效顯著�,據(jù)統(tǒng)計���,2022 年共有 66 個兒童用藥獲批上市,比 2021 年增加了 40.4%[3]�。中國新藥注冊臨床試驗進展年度報告顯示���,2021 年登記的含兒童受試者的臨床試驗 168 項���,比 2020 年增加了30.2%[4-5]。越來越多的兒童用藥加速進入臨床試驗���,如何能有效地保障兒童受試者的安全�����,是目前面臨的一個重要問題�。雖然在開展臨床試驗前�,已獲得了非臨床試驗數(shù)據(jù)、成人數(shù)據(jù)等支持開展臨床試驗的證據(jù)���,但是兒童尚處于生長發(fā)育時期�����,肝腎功能�、血腦屏障、神經(jīng)系統(tǒng)等與成人差異較大���,對藥物的反應(yīng)和成人可能會不同�����,簡單地用成人數(shù)據(jù)外推可能會造成嚴(yán)重后果���,比如氯霉素早期根據(jù)成人數(shù)據(jù)直接用于新生兒的感染,造成了患兒發(fā)生灰嬰綜合征死亡等[6]�����。所以加強兒童用藥臨床試驗期間藥物警戒監(jiān)管工作顯得尤為重要�����。
一�����、我國臨床試驗期間藥物警戒法規(guī)
1.1 法規(guī)現(xiàn)狀
我國加入人用藥品技術(shù)要求國際協(xié)調(diào)理事會(ICH)后�,臨床試驗期間藥物警戒得到了快速發(fā)展�����,從 2018 年 5 月 ICH 臨床安全數(shù)據(jù)管理指南(E2A)���、個例安全性報告規(guī)范(E2B)的全面實施開始,到《藥物警戒質(zhì)量管理規(guī)范》(GVP)的發(fā)布�����,法規(guī)在不斷完善[7]?����,F(xiàn)有臨床試驗期間藥物警戒法規(guī)體系主要由 4 層框架構(gòu)成:①法律層面���,2019 年修訂版《中華人民共和國藥品管理法》《中華人民共和國疫苗管理法》[8-9]中,對申辦者在臨床試驗期間安全性風(fēng)險控制的責(zé)任進行了規(guī)定�����,并賦予了國家藥品監(jiān)管部門對臨床試驗安全性進行監(jiān)督管理權(quán)限�����,從法律層面保證了研發(fā)期間藥物警戒工作的開展;②行政法規(guī)方面�,2022 年發(fā)布的《藥品管理法實施條例》(修訂草案征求意見稿)中[10],明確了申辦者臨床試驗期間對藥物安全性信息收集評估處置與報告等責(zé)任�;③部門規(guī)章方面,2020 年 7 月 1 日起施行的《藥品注冊管理辦法》中對申辦者在臨床試驗期間發(fā)生的非預(yù)期嚴(yán)重不良反應(yīng)和其他潛的嚴(yán)重2安全性風(fēng)險信息的收集上報做了詳細(xì)規(guī)定[11]�,國家藥品監(jiān)管部門可根據(jù)申辦者提供的信息,評估臨床試驗安全性風(fēng)險�,采取必要措施,同時實施的配套文件《藥物臨床試驗期安全信息評估與管理規(guī)范(試行)》中���,從申請人的風(fēng)險評估���、藥品監(jiān)督管理部門風(fēng)險評估與管理、工作程序���、溝通交流等多方面���,對藥物臨床試驗期間安全信息評估與管理進行了全面闡述,具有非常強的可操作性�;④規(guī)范方面,2020 年 7 月 1 日起施行的《藥物臨床試驗質(zhì)量管理規(guī)范》以及 2021 年 12 月 1 日起實施的《藥物警戒質(zhì)量管理規(guī)范》中[12-13]�,對申辦者及臨床試驗機構(gòu)、倫理委員會等各方在臨床試驗安全性評估管理中所承擔(dān)的責(zé)任義務(wù)進行了詳細(xì)規(guī)定,關(guān)注點由之前的嚴(yán)重不良事件轉(zhuǎn)變?yōu)榭梢汕曳穷A(yù)期嚴(yán)重不良反應(yīng)���,與 ICH E2A 相關(guān)要求一致���,與國際接軌。
1.2 兒童用藥臨床試驗期間藥物警戒現(xiàn)狀
根據(jù)前文所述�,雖然目前我國對臨床試驗整體人群形成了以《中華人民共和國藥品管理法》為主干,行政法規(guī)���、部門規(guī)章相結(jié)合的多層次的監(jiān)管法規(guī)體系���,但缺乏針對特殊人群���,尤其是兒童用藥臨床試驗期間安全性監(jiān)管法規(guī)�����,存在兒童用藥藥物警戒未能得到有效監(jiān)管的隱患�。我國 2018 年已充分實施 E2A���,要求申請人按時限評估上報可疑且非預(yù)期重不良反應(yīng)�,但 E2A 僅僅是對行業(yè)的基本要求,是受試者保護的最后一道防線�。兒童用藥臨床試驗期間藥物警戒是否僅參考整體人群即可,亦或是有哪些不同之處�����,亟需相關(guān)指導(dǎo)原則���。
1.3 制定兒童用藥臨床試驗期間藥物警戒相關(guān)指導(dǎo)原則的必要性
兒童用藥問題具有非常高的社會關(guān)注度�,國家藥品監(jiān)督管理局藥品審評中心(簡稱“藥審中心”)采取了多項措施:①對于兒童用藥采用優(yōu)先審評審批政策���,縮短審評用時���,加快上市;②成立了兒童用藥專項小組�����,負(fù)責(zé)兒科藥物審評標(biāo)準(zhǔn)的建立���,提高審評效率���;③發(fā)布相關(guān)兒童用藥指導(dǎo)原則,截至 2022 年底共發(fā)布了 13 項兒童用藥指導(dǎo)原則,并在中心官網(wǎng)開通了“兒童用藥專欄”�����,便于業(yè)界對兒童用藥法規(guī)���、動態(tài)的查詢[14]�。藥審中心對兒童用藥研發(fā)從政策到人力資源給予了充分的支持�,也獲得了非常好的效果,2022 年 60 余個兒童用藥獲批上市���。但另外一方面���,臨床試驗期間的藥物警戒作為藥物研發(fā)中的非常關(guān)鍵一環(huán),承擔(dān)著保護兒童受試者安全的重要作用�����,卻在兒童用藥指導(dǎo)原則中未得到相應(yīng)重視���,至今尚未有相關(guān)指導(dǎo)原則發(fā)布。在加快兒童用藥審評審批的形勢下���,大量開展兒童用藥臨床試驗�����,采用成人藥物警戒指導(dǎo)原則及思維模式開展兒童用藥臨床試驗期間藥物警戒���,存在一定的安全隱患���,所以亟需相關(guān)指導(dǎo)原則指導(dǎo)兒童用藥臨床試驗期間藥物警戒活動。
二�、我國臨床試驗期間藥物警戒監(jiān)管模式
2.1 臨床試驗期間安全性報告及監(jiān)管措施的傳遞
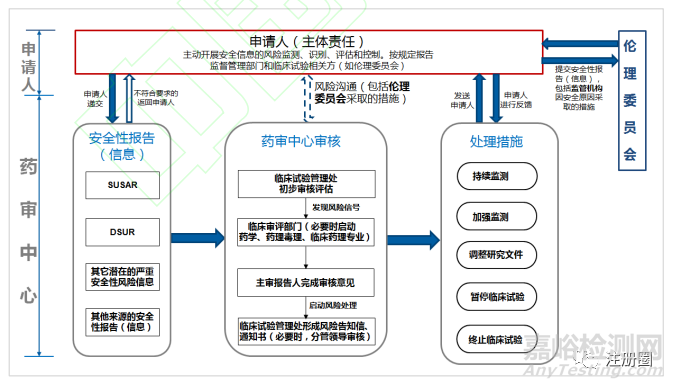
在臨床試驗期間,受試者安全的保護是重中之重�����,申辦者���、倫理委員會�����、藥監(jiān)機構(gòu)各司其職���,做到信息和審核處理意見的及時傳遞�。申請人在獲知發(fā)生嚴(yán)重不良事件時���,要迅速進行分析評估�,包括可預(yù)期性�、藥物的相關(guān)性、嚴(yán)重程度�。判斷為符合可疑且非預(yù)期嚴(yán)重不良反應(yīng)(SUSAR)的,要按照 ICH E2A�、E2B 進行快速向藥監(jiān)機構(gòu)上報,同時按照《藥物臨床試驗質(zhì)量管理規(guī)范》(GCP)要求上報醫(yī)院倫理委員會[15]�。申請人還應(yīng)定期進行匯總分析,對累積性安全信號進行識別評估�,符合其他潛在安全性信息的,也應(yīng)按 ICH E2A 要求進行上報[16]�。另外按照 ICH E2F 要求,每年撰寫定期安全性更新報告�,對藥物安全性進行總體評估。對于在臨床試驗中發(fā)現(xiàn)的安全性風(fēng)險及時制定相關(guān)風(fēng)險控制措施���,對因安全性原因采取的重大措施,及時報藥監(jiān)機構(gòu)及倫理委員會�����。倫理委員會對申請人提交的安全性信息及時進行審查,對發(fā)現(xiàn)可能存在安全性問題的應(yīng)要求申請人采取相關(guān)措施�����,必要時可叫停臨床試驗[17]�����。對于倫理委員會的重要審核意見�,申請人應(yīng)及時在臨床試驗登記平臺進行信息更新,并在研發(fā)期間定期安全性更新報告中進行記錄總結(jié)�。藥審中心對申請人采取的措施進行評估,同時參考倫理委員會意見���,如審核后認(rèn)為受試者安全仍未能得到保障時���,可要求申請人加強監(jiān)測、修改方案�、知情同意書、研究者手冊等�����。申請人修改后反饋藥審中心���,同時報倫理委員會審核[18]�����。必要時���,藥審中心可暫?����;蚪K止臨床試驗�,申請人收到暫?����;蚪K止臨床試驗通知書時�����,應(yīng)立即采取行動�,并及時遞交倫理委員會(圖 1)。
圖1-臨床試驗期間藥物警戒信息傳遞示意圖
由圖 1 可以看出�����,在申請人落實主體責(zé)任���、倫理委員會發(fā)揮審查作用�、藥品監(jiān)管部門履行監(jiān)督義務(wù)的情況下�,基本可以保證臨床試驗期間安全性報告和監(jiān)管措施的及時傳遞,暫無需對兒童用藥進行單獨調(diào)整�����。未來結(jié)合中國疫苗國家監(jiān)管體系(NRA)評估時�����,國外專家提出的藥品監(jiān)管部門和倫理委員會直接進行信息傳遞等建議���,可考慮從兒童用藥臨床試驗開始試點���,更好地保護兒童受試者安全。
2.2 兒童用藥臨床試驗期間安全性報告特點以及與成人用藥審核思維的差異
2.2.1 報告數(shù)量方面差異較大
兒童用藥臨床試驗期間 SUSAR 報告相對成人報告數(shù)量較少�����。以藥審中心 2022 年收到的國內(nèi)首次報告為例�,其中 14 歲以下受試者 SUSAR 報告僅占全部報告的 1.38%�����。有限的數(shù)據(jù)對匯總分析提出了挑戰(zhàn)���,所以通常采用人工逐例審核的方式。
2.2.2 藥物適應(yīng)證方面差異較大
藥審中心收到的報告主要以腫瘤藥物為主�,約占全部報告的 88.90%。但是在收到的兒童 SUSAR 報告中�,卻是以疫苗臨床試驗為主(占 74.60%)�����,其次是腫瘤(占 6.35%)和系統(tǒng)性紅斑狼瘡(占 3.97%)�����,顯然在藥物適應(yīng)證方面存在較大差異�。
2.2.3 安全性信號發(fā)現(xiàn)方面差異較大
疫苗臨床試驗基本為健康受試者,對安全性要求更高。腫瘤藥物對安全性耐受程度相對較大�,死亡事件經(jīng)常作為試驗的終點,所以腫瘤藥物安全性信號通常是在大量數(shù)據(jù)累積的基礎(chǔ)上發(fā)現(xiàn)的�����。而對于健康受試者�,即使是嚴(yán)重性標(biāo)準(zhǔn)為住院�,甚至其他重要醫(yī)學(xué)事件時,即可產(chǎn)生出強烈的安全性信號[19]�����。比如 BC0335 顆粒�,該品種適應(yīng)證為兒童呼吸道合胞病毒感染,2021 年發(fā)生了因急性肝損傷導(dǎo)致住院的 SUSAR�,經(jīng)藥審中心審核后,認(rèn)為本品適用人群為兒童���,耐受力較差�,風(fēng)險較大���,發(fā)送了暫停臨床試驗通知書���。
三�����、對兒童用藥臨床試驗期間藥物警戒監(jiān)管工作的建議
3.1 制定相關(guān)指導(dǎo)原則
建議出臺針對特殊用藥人群(尤其是兒童)臨床試驗期間安全性監(jiān)測評估相關(guān)指導(dǎo)原則���。一方面,可參考國外的先進經(jīng)驗和上市后藥物警戒經(jīng)驗�,雖然臨床試驗期間藥物警戒與上市后藥物警戒存在一定差異,但很多方法�、理念是可以借鑒的[20]。美國對于兒科用藥相關(guān)法規(guī)制定發(fā)布較早�����,比如非常具有影響力且現(xiàn)在仍適用的兩部法律:《兒童最佳藥品法》(Best Pharmaceuticals for Children Act���,BPCA)和《兒科研究公平法》(Pediatric ResearchEquity Act���,PREA)[21-22],對鼓勵企業(yè)研發(fā)���、加強兒科用藥藥物警戒進行了詳細(xì)規(guī)定�����。另外���,21 CFR Part 50 Subpart D 對臨床研究中兒童的額外保障進行了要求[23]���。歐盟 2006 年發(fā)布的《兒科藥品管理條例》(Paediatric Regulation)(第 1901/2006 號(EC)指令)[24]�����。與美國類似�,一方面從審批形式���、專利保護等多舉措鼓勵企業(yè)研發(fā),另外從倫理審查等角度5加強了兒童受試者保護���。在歐盟 GVP 中,制定了《產(chǎn)品或人群特殊考慮因素 IV:兒科人群》�,從兒童年齡�、生長發(fā)育情況等方面詳細(xì)闡述了兒童用藥藥物警戒考慮因素,并對藥物警戒活動中的安全風(fēng)險管理���、不良反應(yīng)報告�、信號的檢測�����、管理�、溝通(包括與兒科委員會的溝通)進行了詳細(xì)介紹[25]。另外,要根據(jù)中國現(xiàn)有的監(jiān)管理念���、經(jīng)驗,堅持獨立自主思考和解決實際問題�����。雖然我國臨床試驗期間藥物警戒起步較晚�,但從 2018 年 5 月至今,積累了大約 5年的數(shù)據(jù)���,有很多經(jīng)驗���、案例可以與世界分享�。藥審中心也在積極探索數(shù)字化�、智能化的藥物警戒監(jiān)管模式�����,為世界貢獻更多中國智慧�����。所以在制定指導(dǎo)原則時�,在借鑒國外監(jiān)管機構(gòu)法規(guī)的同時,更要保持獨立自主�����。
3.2 修訂相關(guān)審核標(biāo)準(zhǔn)
在修訂藥審中心內(nèi)部臨床試驗期間安全性報告審核評估標(biāo)準(zhǔn)時,建議加入對特殊人群的考慮���,尤其是兒童�����。目前,藥審中心在審核安全性報告時�,主要考慮因素包括:不良反應(yīng)術(shù)語、嚴(yán)重性標(biāo)準(zhǔn)�����、相關(guān)性以及同品種信息等,雖然在實際審核過程中對于兒童受試者會給予關(guān)注���,但未形成統(tǒng)一的標(biāo)準(zhǔn)�,存在審核尺度不一致的風(fēng)險�。前文已闡述了藥審中心收到的SUSAR 中�,兒童和成人報告的不同點?��?筛鶕?jù)這些不同點,結(jié)合實際審核案例�����,制定兒童用藥安全性報告審核要點�����,統(tǒng)一審核尺度,提高審核效率。
3.3 組建兒童用藥藥物警戒相關(guān)委員會
建議藥審中心建立針對兒童用藥的臨床試驗藥物警戒安全委員會�。美國食品藥品監(jiān)督管理局(FDA)通過兒科咨詢委員會( Pediatric Advisory Committee���,PAC)及公眾參與等形式���,提高審查的全面性、完整性和公開透明�����,最大限度地保護兒童受試者的安全[26]�。歐盟也設(shè)立了兒科委員會(PDCO)�,提升監(jiān)管專業(yè)能力�。藥審中心目前建立了兒童用藥技術(shù)審評臨床專家咨詢委員會,主要為提高兒童用藥審評工作的質(zhì)量和效率而組建,以臨床專家為主���。而臨床試驗期間藥物警戒經(jīng)常涉及多學(xué)科,比如藥理毒理學(xué)�����、藥學(xué)���、臨床藥理學(xué)、理學(xué)等�����。建議組建針對兒童用藥的臨床試驗藥物警戒安全委員會�,研究解決兒童用藥臨床試中發(fā)生的重點難點問題���,保障審核的科學(xué)公正�。
綜上�����,在兒童用藥臨床試驗過程中�,保護兒童受試者的安全至關(guān)重要。建議通過制相關(guān)指導(dǎo)原則和審核標(biāo)準(zhǔn)�,建立相關(guān)委員會�,不斷提升我國兒童用藥藥物警戒監(jiān)管力,以期為兒童受試者安全性提供有力的保障���。
參考文獻
[1] LIANG Q. Lack of motivation in clinical trials of the pediatric drug[N]. Economic information67daily(經(jīng)濟參考報), 2021-08-25(005).
[2] YUAN LJ, WANG LQ, WANG XY, et al. The role and consideration of acceleratedapprovalprocess in pediatric drug registration system[J]. Chinese Journal ofPharmaceuticals(中國醫(yī)藥工業(yè)雜志), 2022, 53(11): 1529-1538.
[3] LUO N. Review and approval of the pediatric drug are accelerated[N].ChinaPharmaceuticalNews(中國醫(yī)藥報), 2023-01-17(001).
[4] Center for Drug Evaluation, National Medical Products Administration. The Annual Report onProgress of Clinical Trials for New Drug Registration in China (2021)[EB/OL].(2022-06-07)[2023-03-16].
https://www.cde.org.cn/main/news/viewInfoCommon/1839a2c931e1ed43eb4cc049e189cb0.
[5] Center for Drug Evaluation, National Medical Products Administration. TheAnnual Report onProgress of Clinical Trials for New Drug Registration in China (2020)[EB/OL].(2021-11-10)[2023-03-16].
https://www.cde.org.cn/main/news/viewInfoCommon/d670723dd2f646722097b3cf005e052.
[6] PAN M. Analysis the Characteristic of the pediatric drug[J]. Journal ofPractical MedicalTechniques(實用醫(yī)技雜志), 2013, 20(4): 403-404.
[7] NMPA.NMPA Issued the Announcement on Good Pharmacovigilance Practice (No.65 of2021)[EB/OL].(2021-05-07)[2023-06-01].
https://www.gov.cn/gongbao/content/2021/content_5629614.htm.
[8] Pharmaceutical Administration Law of the People's Republic ofChina[EB/OL]. (2019-08-26)[2023-06-01].https://www.gov.cn/xinwen/2019-08/26/content_5424780.htm.
[9] Vaccine Administration Law of the People's Republic of China[EB/OL].(2019-06-29)[2023-06-01] http://www.npc.gov.cn/npc/c30834/201907/11447c85e05840b9b12c62b5b645fed.shtml.
[10] NMPA . NMPA publicly solicits opinions on the ImplementationRegulations ofPharmaceutical Administration Law of the People's Republic of China[EB/OL].(2022-05-09)[2023-0601]
https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20220509222233134.html.
[11] State Administration for Market Regulation.Provisions for DrugRegistration[EB/OL]. (2020-01-22)[2023-06-01]
https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/fgs/art/2023/art_3275cb2a929d4c4ac8c0421b2a9c257.html.
[12] National Medical Products Administration, National Health Commission. NMPA and NHCIssued the Announcement on Good Clinical Practice (No.57 of 2020)[EB/OL](2020-04-23)[2023-06-01].https://www.gov.cn/gongbao/content/2020/content_5525106.htm.
[13] NMPA.NMPA Issued the Announcement on Good PharmacovigilancePractice (No.65 of2021)[EB/OL].(2021-05-07)[2023-06-01]
https://www.gov.cn/gongbao/content/2021/content_5629614.htm.
[14] Center for Drug Evaluation, National Medical Products Administration.speed up the review and approval for the pediatric drug [EB/OL].(2023-01-17)[2023-06-01].https://www.cde.org.cn/main/news/viewInfoCommon/0fa129a8ad32929943ac11ef438959
30.
[15] National Medical Products Administration, National Health Commission. NMPA and NHC
Issued the Announcement on Good Clinical Practice (No.57 of 2020)[EB/OL]. (2020-04-23)[2023-
06-01]. https://www.gov.cn/gongbao/content/2020/content_5525106.htm.
[16] FENG HY, ZHOU LY, LI H, et al. Research III on Pharmacovigilance and Risk Control During 8
Clinical Trials of New Drugs: On Regulatory Requirements for Individual Case Safety Reports in
Clinical Trials of Drugs[J]. Chinese Pharmaceutical Affairs(中國藥事), 2022, 36(6): 630-636.
[17] National Medical Products Administration, National Health Commission. NMPA and NHC
Issued the Announcement on Good Clinical Practice (No.57 of 2020)[EB/OL].(2020-04-23) [2023-
06-01]. https://www.gov.cn/gongbao/content/2020/content_5525106.htm.
[18] Center for Drug Evaluation, National Medical Products Administration. CDE issued the
Announcement on safety information evaluation and management practices during drug clinical
trials (No.5 of 2020) [EB/OL]. (2020-07-01)[2023-03-16].
https://www.cde.org.cn/main/news/viewInfoCommon/a1d42f512a341bc079ffb79df91f9cc7.
[19] CIOMS. Management of Safety Information from Clinical Trials(臨床試驗安全信息管理)
[M]//WANG HX, PEI XJ, CHEN J. Tianjin: Tianjin Science and Technology Translation and
Publishing Co., Ltd���,2022.
[20] LI XX, TANG ZM, ZHOU J, et al. Limitations of the safety assessment in premarketing clinical
trials of drugs and suggestions for improvement[J]. Chinese Journal of Pharmacovigilance(中國
藥物警戒), 2020, 164(8): 465-470.
[21] FDA. Best Pharmaceuticals for Children Act[EB/OL]. (2018-09-25)[2023-06-01].
https://www.fda.gov/drugs/development-resources/best-pharmaceuticals-children-act-bpca.
[22] FDA. Pediatric Research Equity Act[EB/OL]. (2019-11-07)[2023-06-01].
https://www.fda.gov/drugs/development-resources/pediatric-research-equity-act-prea.
[23] The U.S. National Archives and Records Administration. 21 CFR Part 50 Subpart D -Additional Safeguards for Children in Clinical Investigations [EB/OL]. (2001-04-24) [2023-03-16].
https://www.ecfr.gov/current/title-21/chapter-I/subchapter-A/part-50/subpart-D.
[24] European Medicines Agency. Regulation (EC) No 1901/2006 of the European Parliament and of the Council of 12 December 2006 on Medicinal Products for Paediatric Use and Amending Regulation (EEC) No 1768/92, Directive 2001/20/EC, Directive 2001/83/EC and Regulation (EC)No 726/ 2004. [EB/OL]. (2006-12-27) [2023-03-16].
https://eurlex.europa.eu/legalcontent/EN/TXT/PDF/uri=CELEX:32006R1901&qid=1661481204018&from=EN.
[25] European Medicines Agency. Guideline on good pharmacovigilance practices (GVP) Productor Population-Specific Considerations IV: Paediatric population [EB/OL]. (2018-11-08) [2023-03-16].https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-goodphar.macovigilance-practices-gvp-product-population-specific-considerations-iv_en-0.pdf.
[26] FDA. Process for Handling Referrals to FDA Under 21 CFR 50.54 - Additional Safeguards for
Children in Clinical Investigations[EB/OL].[2023-03-16].
https://www.fda.gov/media/75222/download.