摘 要 Abstract
本文介紹了國(guó)際監(jiān)管科學(xué)創(chuàng)新中心(CIRS)對(duì)六大監(jiān)管機(jī)構(gòu)批準(zhǔn)的新活性物質(zhì)(NAS)的年度分析結(jié)果���,重點(diǎn)分析了2021 年NAS 批準(zhǔn)情況,并回顧了2012~2021 年的情況����。通過分析可以看出,盡管中位批準(zhǔn)時(shí)間可以作為考量監(jiān)管機(jī)構(gòu)工作效率和藥物獲批上市所需時(shí)間的重要指標(biāo)��,但同時(shí)也需要考慮其他因素��,包括監(jiān)管促進(jìn)路徑(FRP)�����、NAS 的國(guó)際化以及新數(shù)據(jù)來源[ 包括真實(shí)世界數(shù)據(jù)(RWD)]的使用等�����。
This R&D Briefing presents the annual analysis results of new active substance (NAS) approvals by the Centre for Innovation in Regulatory Science (CIRS). It focuses on the NAS approvals in 2021 while also reviewing the period from 2012 to 2021. The analysis highlights that while median approval time can be a marker of agency performance and the time required to make medicines available to patients, other factors need to be taken into account as well. This R&D Briefing focuses on factors such as facilitated regulatory pathways (FRP), internationalization of NAS, and the use of novel data sources, including realworld data (RWD).
關(guān)鍵詞 Key words 監(jiān)管機(jī)構(gòu);批準(zhǔn)時(shí)間�;監(jiān)管促進(jìn)路徑
regulatory agency; approval time; facilitated regulatory pathway
1、 六大監(jiān)管機(jī)構(gòu)批準(zhǔn)的總體情況
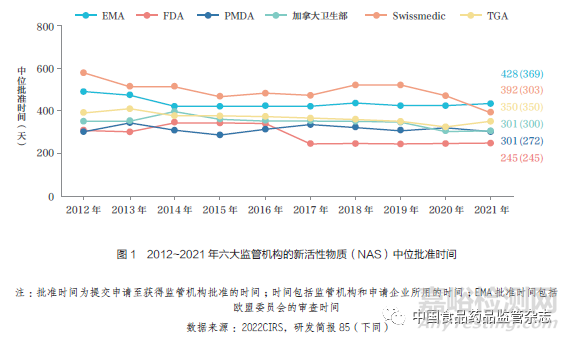
本文介紹了國(guó)際監(jiān)管科學(xué)創(chuàng)新中心(CIRS)對(duì)六大監(jiān)管機(jī)構(gòu)批準(zhǔn)的新活性物質(zhì)(NAS)的年度分析結(jié)果����,其中六大監(jiān)管機(jī)構(gòu)包括:歐洲藥品管理局(EMA)���、美國(guó)食品藥品監(jiān)督管理局(FDA)�、日本藥品和醫(yī)療器械管理局(PMDA)��、加拿大衛(wèi)生部���、瑞士醫(yī)藥管理局(Swissmedic)和澳大利亞藥品監(jiān)督管理局(TGA)��。2012~2021 年六大監(jiān)管機(jī)構(gòu)的NAS 中位批準(zhǔn)情況���,如圖1所示。
上市許可中位批準(zhǔn)時(shí)間出現(xiàn)差異歸結(jié)于多種因素�,包括監(jiān)管機(jī)構(gòu)的因素、產(chǎn)品因素和企業(yè)策略等���。監(jiān)管機(jī)構(gòu)因素包括規(guī)定時(shí)間線的法律框架���、提交或滾動(dòng)提交前的程序����、監(jiān)管促進(jìn)路徑(例如加速評(píng)審)����、各監(jiān)管機(jī)構(gòu)間的工作共享(例如Access聯(lián)盟)以及科學(xué)評(píng)估后的活動(dòng)(例如行政程序或標(biāo)簽談判)。產(chǎn)品因素包括了各監(jiān)管機(jī)構(gòu)收到申請(qǐng)或?qū)徳u(píng)的NAS 不同�����。企業(yè)策略的因素為根據(jù)提交申請(qǐng)時(shí)間或真實(shí)世界數(shù)據(jù)(RWD)等不同數(shù)據(jù)來源采用不同的數(shù)據(jù)包�����。
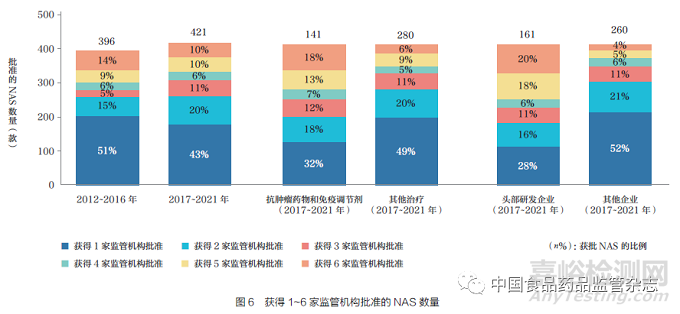
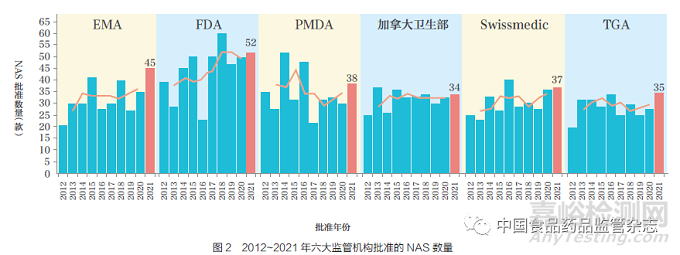
過去10 年����, 六大監(jiān)管機(jī)構(gòu)批準(zhǔn)的NAS 總數(shù)雖整體呈增加趨勢(shì), 但2017~2021 年���,F(xiàn)DA 和加拿大衛(wèi)生部的批準(zhǔn)數(shù)量卻趨于平穩(wěn)���。2021 年�,F(xiàn)DA[ 藥物評(píng)價(jià)和研究中心(CDER)與生物制品評(píng)價(jià)和研究中心(CBER)] 總計(jì)批準(zhǔn)的NAS 數(shù)量(52 款)最多��,如圖2 所示�。FDA 批準(zhǔn)數(shù)量高于其他監(jiān)管機(jī)構(gòu)的可能原因是:①監(jiān)管促進(jìn)路徑(FRP)的可及性;②由于FDA 批準(zhǔn)的一些藥物尤其小型企業(yè)申報(bào)的藥物���,尚未進(jìn)行國(guó)際化����。通過對(duì)比2012~2016 年和2017~2021 年這兩個(gè)5 年批準(zhǔn)的NAS數(shù)量可以發(fā)現(xiàn)��,F(xiàn)DA 批準(zhǔn)數(shù)量增幅最大���,增加了39%,其次是EMA(18%)����、Swissmedic(9%) 和加拿大衛(wèi)生部(4%),而TGA 和PMDA 批準(zhǔn)數(shù)量則分別減少了3% 和21%�。各監(jiān)管機(jī)構(gòu)在產(chǎn)品批準(zhǔn)數(shù)量方面的差異可能受到諸多因素的影響,例如���,申請(qǐng)人根據(jù)企業(yè)自身的規(guī)模��、未滿足的臨床需求和審評(píng)速度�,針對(duì)不同監(jiān)管機(jī)構(gòu)采取了不同申報(bào)策略。
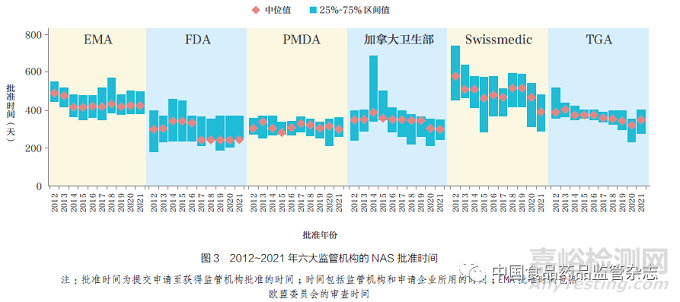
2021 年����,F(xiàn)DA 的中位批準(zhǔn)時(shí)間最短(245 天), 這可能歸因于FRP的廣泛應(yīng)用��, 其次是加拿大衛(wèi)生部和PMDA(均為301 天)����、TGA(350 天)、Swissmedic(392 天) 和EMA(428天)���,如圖3 所示�。在過去20 年中����,盡管六大監(jiān)管機(jī)構(gòu)的批準(zhǔn)時(shí)間均有所縮短,但各機(jī)構(gòu)在中位批準(zhǔn)時(shí)間方面仍存在差異(例如FDA 和EMA 的批準(zhǔn)時(shí)間相差183 天)����。然而,從提交申請(qǐng)至科學(xué)評(píng)估結(jié)束的中位時(shí)間差異已縮?�。ɡ鏔DA和EMA 相差124 天)。FDA�、加拿大衛(wèi)生部和TGA 的總體批準(zhǔn)時(shí)間和至科學(xué)評(píng)估結(jié)束時(shí)間相近,這表明科學(xué)評(píng)估后沒有或很少有其他相關(guān)程序��。2020~2021年���,Swissmedic 的中位批準(zhǔn)時(shí)間差最大�����,2020 年為173 天、2021 年為89天���,減少了78 天,主要是由于科學(xué)評(píng)估后的時(shí)間(例如標(biāo)簽談判)減少��。2021年TGA 批準(zhǔn)時(shí)間較2020 年延長(zhǎng)����,這可能是由于新冠疫情導(dǎo)致的工作量增加。
2�����、共同審評(píng)情況
2.1 六大監(jiān)管機(jī)構(gòu)共同批準(zhǔn)
為了進(jìn)行監(jiān)管機(jī)構(gòu)工作績(jī)效基準(zhǔn)的對(duì)標(biāo)評(píng)估,對(duì)六大監(jiān)管機(jī)構(gòu)已批準(zhǔn)的藥物進(jìn)行審評(píng)十分重要���。這項(xiàng)評(píng)估工作���,將過去10 年分為兩個(gè)時(shí)間段(即2012~2016年和2017~2021 年),以發(fā)現(xiàn)變化趨勢(shì)����。與以往分析中發(fā)現(xiàn)批準(zhǔn)產(chǎn)品的數(shù)量增加相比,六大監(jiān)管機(jī)構(gòu)在5 年內(nèi)批準(zhǔn)的產(chǎn)品數(shù)量減少�,從2012~2016 年批準(zhǔn)了56款NAS,到2017~2021 年只批準(zhǔn)了43款NAS����,這表明國(guó)際化的進(jìn)程可能趨于平穩(wěn)。不同國(guó)家和地區(qū)注冊(cè)審批時(shí)間可能受到諸多因素的影響���,包括提交時(shí)間差和批準(zhǔn)時(shí)間等���。例如企業(yè)申報(bào)策略以及為解決未滿足的醫(yī)療需求而使用快速通道的情況。2017~2021 年�����,F(xiàn)DA 的總體中位注冊(cè)審批時(shí)間最短(250 天),這是因?yàn)槠髽I(yè)最先向FDA 申報(bào)���,并且由于加速審評(píng)的更廣泛使用�,F(xiàn)DA 的監(jiān)管審評(píng)時(shí)間加快(63%)�,其次是EMA(446 天)、加拿大衛(wèi)生部(471 天)�、PMDA(535天)、TGA(542 天) 和Swissmedic(669 天)���,如圖4 所示�����。
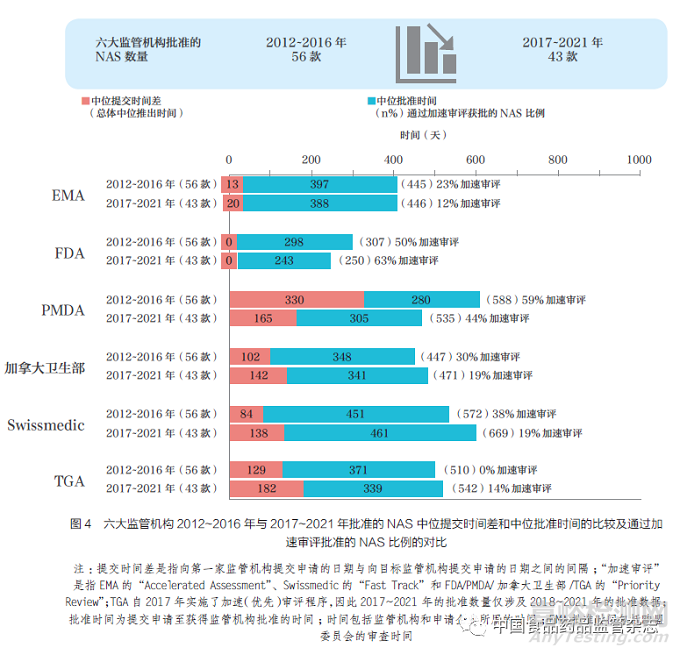
向EMA 提交申請(qǐng)與FDA 幾乎是同時(shí)發(fā)生�����, 其次是加拿大衛(wèi)生部、Swissmedic��、TGA 和PMDA���。本文中向監(jiān)管機(jī)構(gòu)提交申請(qǐng)的順序發(fā)生了變化:主要是由于之前發(fā)現(xiàn)向PMDA 提交申請(qǐng)的時(shí)間比向加拿大衛(wèi)生部�����、Swissmedic和TGA 提交的時(shí)間晚�,但目前這幾個(gè)監(jiān)管機(jī)構(gòu)提交申請(qǐng)的時(shí)間相同。事實(shí)上����,PMDA 的中位提交時(shí)間差從2012~2016年的330 天縮短至2017~2021 年的165 天,減少了一半��。
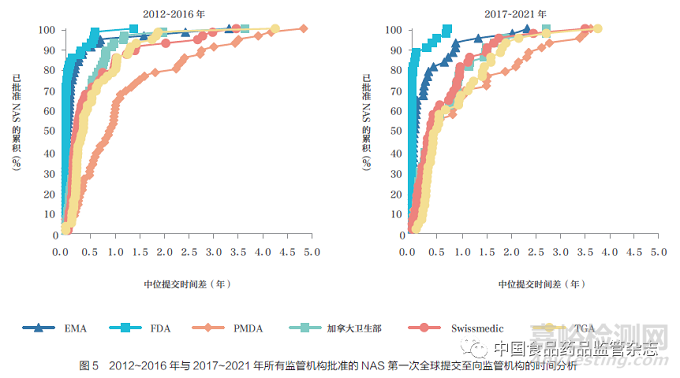
本文通過比較六大監(jiān)管機(jī)構(gòu)2012~2016 年(56 款)與2017~2021年(43 款) 間批準(zhǔn)的NAS 提交時(shí)間差分布�,進(jìn)一步分析了企業(yè)申報(bào)策略的差異。結(jié)果表明�,PMDA 的中位提交時(shí)間差由2012~2016 年的1 年縮短至2017~2021 年半年左右,如圖5 所示�����。2017~2021 年P(guān)MDA 分布曲線的收緊�����,表明第一次全球提交后向PMDA 提交所需的時(shí)間與加拿大衛(wèi)生部��、Swissmedic和TGA 的時(shí)間相近����。
通過比較每款NAS 獲批的監(jiān)管機(jī)構(gòu)數(shù)量���,本文對(duì)產(chǎn)品的國(guó)際化情況進(jìn)行了研究。2012~2016 年與2017~2021年比較表明����,盡管六大監(jiān)管機(jī)構(gòu)批準(zhǔn)的產(chǎn)品數(shù)量沒有呈現(xiàn)明顯的增加趨勢(shì),但獲得兩家或以上監(jiān)管機(jī)構(gòu)批準(zhǔn)的NAS比例由2012~2016 年的49% 增加至2017~2021 年的57%����。進(jìn)一步探索2017~2021 年影響國(guó)際化的可能因素,在比較治療領(lǐng)域和基于研發(fā)支出的企業(yè)規(guī)模方面�,觀察到存在較大的差異。在治療領(lǐng)域�,18% 的抗腫瘤藥物和免疫調(diào)節(jié)劑NAS 獲得六大監(jiān)管機(jī)構(gòu)的批準(zhǔn),而其他治療領(lǐng)域?yàn)?% �;在研發(fā)投入水平方面,來自頭部企業(yè)(2021 年研發(fā)支出超過30億美元的制藥企業(yè))的NAS 有20% 獲得了六大監(jiān)管機(jī)構(gòu)的批準(zhǔn)�,而其他較小型企業(yè)的NAS 獲批比例為4%,如圖6 所示����。
2.2 Access 工作共享聯(lián)盟
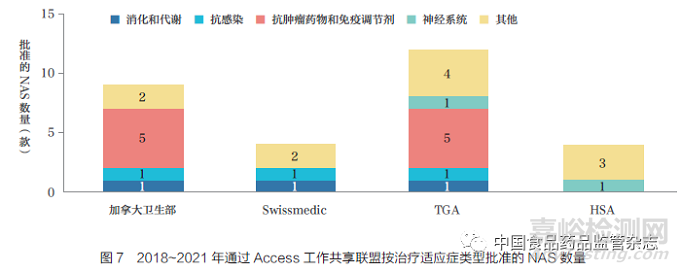
Access 聯(lián)盟是一個(gè)由“志同道合”的監(jiān)管機(jī)構(gòu)于2007 年成立的中等規(guī)模的聯(lián)合體���,旨在促進(jìn)更多合作和提升監(jiān)管一致性����,其目標(biāo)是最大限度地開展國(guó)際合作,減少重復(fù)性審評(píng)�,提升各監(jiān)管機(jī)構(gòu)的效能,以確?����;颊呒皶r(shí)獲得高質(zhì)量�、安全和有效的藥物。各監(jiān)管機(jī)構(gòu)作為Access 工作共享聯(lián)盟的成員��,負(fù)責(zé)審評(píng)申請(qǐng)資料的不同部分�。盡管各監(jiān)管機(jī)構(gòu)之間共享審評(píng)結(jié)果,但每家監(jiān)管機(jī)構(gòu)均有權(quán)對(duì)新藥的批準(zhǔn)(上市許可)與否獨(dú)立做出決定���。目前��,這種“共享”模式是否能成為一種聯(lián)盟的監(jiān)管機(jī)構(gòu)在區(qū)域和跨區(qū)域間共享資源����、簡(jiǎn)化與企業(yè)互動(dòng)的模式備受關(guān)注。本文對(duì)實(shí)施新化學(xué)實(shí)體工作共享倡議的加拿大衛(wèi)生部�、Swissmedic、TGA 和新加坡衛(wèi)生科學(xué)管理局(HSA)2018~2021 年的NAS批準(zhǔn)情況進(jìn)行了分析�����,各監(jiān)管機(jī)構(gòu)共批準(zhǔn)了12 款NAS�,如圖7 所示。TGA 是參與所有12 款NAS 工作共享最多的機(jī)構(gòu)(12 款)�,主要是抗腫瘤藥物和免疫調(diào)節(jié)劑,其次是加拿大衛(wèi)生部(9 款)����、HSA(4款)和Swissmedic(4 款)。2021 年1月����,英國(guó)藥品和健康產(chǎn)品管理局(MHRA)在該倡議中發(fā)起了工作共享申請(qǐng),但當(dāng)年沒有NAS 獲批���。
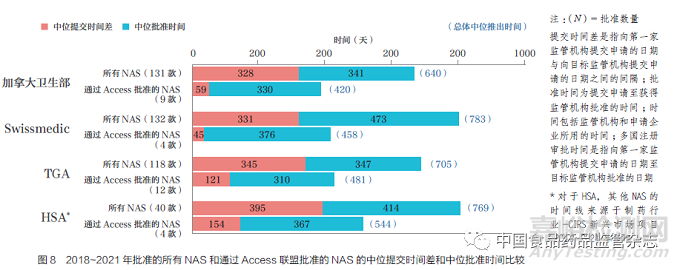
對(duì)于評(píng)估的所有監(jiān)管機(jī)構(gòu)��, 與2018~2021 年批準(zhǔn)的所有NAS 相比���,通過Access 工作共享聯(lián)盟批準(zhǔn)的NAS的中位提交時(shí)間差和中位批準(zhǔn)時(shí)間更短��,如圖8 所示,表明工作共享機(jī)制對(duì)不同國(guó)家和地區(qū)注冊(cè)審批時(shí)間(提交時(shí)間差+批準(zhǔn)時(shí)間)具有積極影響����。就總體中位注冊(cè)審批時(shí)間而言,與2018~2021 年批準(zhǔn)的所有NAS 相比���,Swissmedic 通過Access 批準(zhǔn)NAS 的中位注冊(cè)審批時(shí)間縮短326 天�,其次是HSA(225 天)���、TGA(224 天)和加拿大衛(wèi)生部(220 天)���。
2.3 Orbis 計(jì)劃
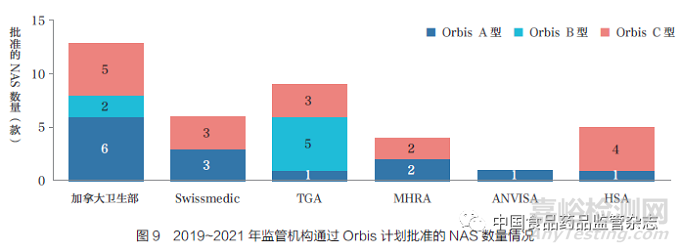
Orbis 計(jì)劃是FDA 腫瘤卓越中心(OCE) 發(fā)起的一項(xiàng)倡議, 旨在讓全球患者更快地獲得有前景的癌癥治療���。Orbis 計(jì)劃的合作伙伴合作審評(píng)癌癥藥物提交的資料�。根據(jù)FDA 與合作伙伴的提交時(shí)間表����,Orbis 計(jì)劃的提交類型分三種:A 型,提交基本上同時(shí)進(jìn)行���;B 型���,從向FDA 提交到向合作伙伴提交有超過30 天的延遲��;C 型���,在FDA 已經(jīng)采取監(jiān)管行動(dòng)后提交。2019~2021 年通過Orbis 計(jì)劃批準(zhǔn)的NAS 情況��,如圖9 所示�����,加拿大衛(wèi)生部批準(zhǔn)的NAS 數(shù)量最多(13 款�����, 大部分為Orbis A 型)����,其次是TGA(9 款)、Swissmedic(6款)�、HSA(5 款)、MHRA(4 款)和巴西國(guó)家衛(wèi)生監(jiān)督局(ANVISA)(1 款)�����。最常使用的Orbis 類型為C 型,表明最常發(fā)生的情況是FDA 分享其已完成的審評(píng)文件��,而不是同時(shí)進(jìn)行審評(píng)����。
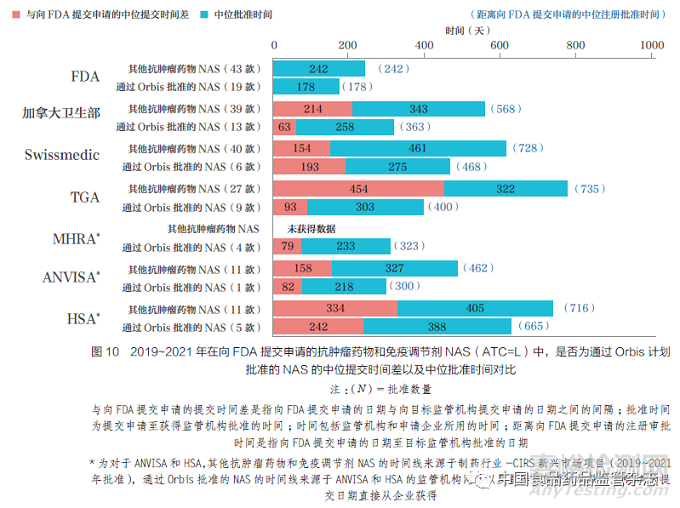
與其他方式批準(zhǔn)的抗腫瘤藥物和免疫調(diào)節(jié)劑的時(shí)間相比�,Orbis 批準(zhǔn)縮短了向FDA 提交申請(qǐng)的不同國(guó)家和地區(qū)中位注冊(cè)審批時(shí)間,由于與FDA 的提交時(shí)間差縮短�����,批準(zhǔn)時(shí)間也縮短����,如圖10 所示,也表明了全球監(jiān)管合作可以讓腫瘤患者更快地獲得新療法���。
3���、 影響六大監(jiān)管機(jī)構(gòu)NAS 批準(zhǔn)的因素
3.1 審評(píng)類型
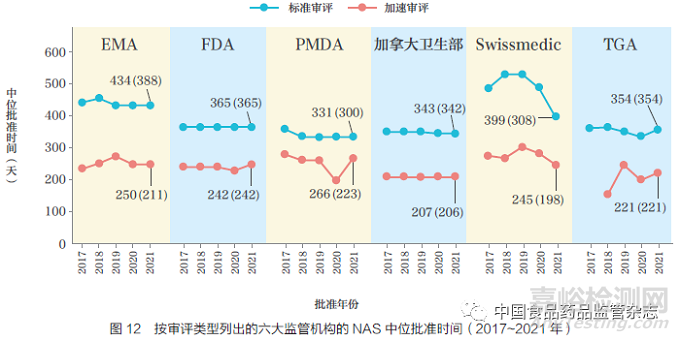
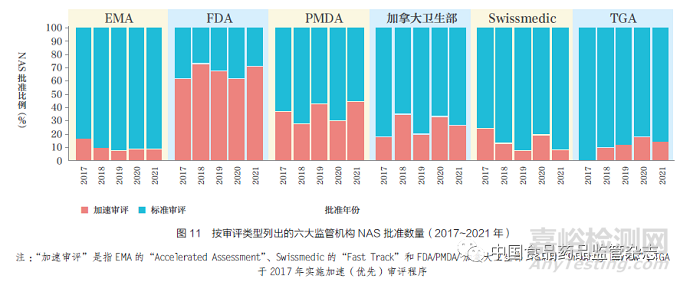
六大監(jiān)管機(jī)構(gòu)均已設(shè)立加速審評(píng)程序,以加快具有前景的NAS 審評(píng)過程�����,如圖11 所示。2021 年�����,F(xiàn)DA 的加速審評(píng)與標(biāo)準(zhǔn)審評(píng)比值最高(71%)��,其次是PMDA(45%)��、加拿大衛(wèi)生部(26%)�����、TGA(14%)�、EMA(9%)和Swissmedic(8%)。TGA 自2017年開始實(shí)施優(yōu)先審評(píng)體系�;2018 年和2019 年分別加速審評(píng)批準(zhǔn)了3 款NAS,2020 年和2021 年分別加速審評(píng)批準(zhǔn)了5 款NAS���。FDA 的加速審評(píng)比例一直較高���,從2012~2016 年的50% 增加到2017~2021 年的68%。Swissmedic在2021 加速審評(píng)批準(zhǔn)了3 款NAS����,EMA 加速審評(píng)批準(zhǔn)了4 款���。其中EMA加速審評(píng)數(shù)量較低的部分原因可能是申請(qǐng)人需要滿足時(shí)間線的要求,否則將仍使用標(biāo)準(zhǔn)審評(píng)程序進(jìn)行審評(píng)����。例如,2021年���,EMA 將最初指定為加速審評(píng)的9 款NAS 轉(zhuǎn)為標(biāo)準(zhǔn)審評(píng),而申請(qǐng)人要求加速審評(píng)7 款NAS���,被EMA 拒絕�。
2021 年�,EMA 是加速審評(píng)和標(biāo)準(zhǔn)審評(píng)之間中位批準(zhǔn)時(shí)間差異最大的監(jiān)管機(jī)構(gòu)(184 天),PMDA 的差異最?���。?5天),Swissmedic(154 天)���,加拿大衛(wèi)生部(136 天)�,TGA(133 天),F(xiàn)DA(123 天)����,如圖12 所示。值得注意的是����,對(duì)于Swissmedic 來說,在科學(xué)評(píng)估結(jié)束后進(jìn)行的額外標(biāo)簽談判程序中���,加速審評(píng)產(chǎn)品所用的時(shí)間約為標(biāo)準(zhǔn)審評(píng)的1/2�����,這表明對(duì)于高度未滿足需求的產(chǎn)品�����,標(biāo)簽談判和其他行政程序正在以更快的速度進(jìn)行��。TGA 通過引入加速通道批準(zhǔn)的5 款產(chǎn)品的中位審評(píng)時(shí)間為221 天���,與其他監(jiān)管機(jī)構(gòu)一致。
3.2 罕見病藥
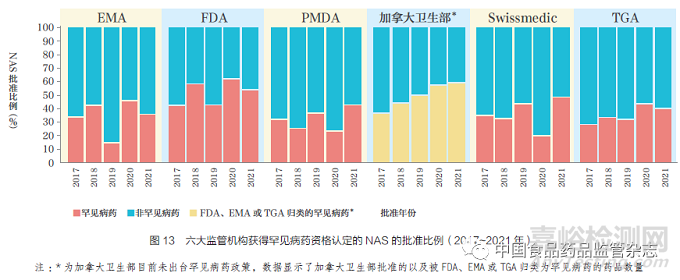
2021 年,各監(jiān)管機(jī)構(gòu)授予罕見病藥資格的NAS 獲批比例均較高��,其中TGA(40%)����,EMA(36%),PMDA(42%)��,Swissmedic(49%)����,F(xiàn)DA(54%),如圖13 所示����。目前���,盡管加拿大衛(wèi)生部未出臺(tái)罕見病藥相關(guān)政策�,但其在2021 年批準(zhǔn)的NAS 中有59% 被FDA�����、EMA 以及TGA 歸類為罕見病藥�。
2017~2021 年,各監(jiān)管機(jī)構(gòu)批準(zhǔn)的罕見病藥比例逐年變化�,但普遍呈增加趨勢(shì)����,可能是由于疾病分層和企業(yè)研發(fā)管線的不斷擴(kuò)大�,并且與各監(jiān)管機(jī)構(gòu)為解決未滿足的醫(yī)療需求而增加投入相符。監(jiān)管機(jī)構(gòu)間的差異可能是由于提交給各監(jiān)管機(jī)構(gòu)的產(chǎn)品類型不同以及各監(jiān)管機(jī)構(gòu)對(duì)罕見病藥認(rèn)定標(biāo)準(zhǔn)不同����,以及申請(qǐng)人提交的適應(yīng)癥不同。
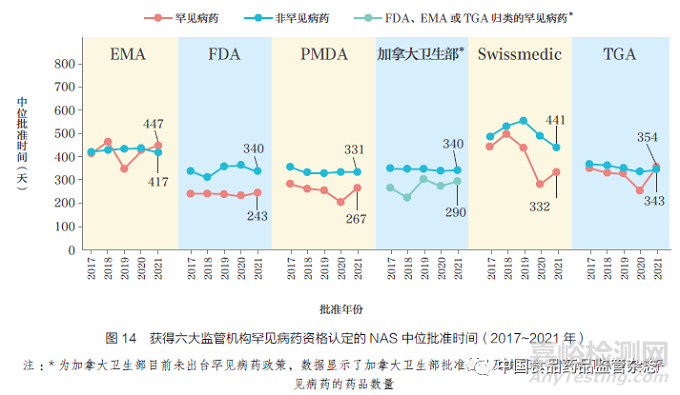
本文對(duì)2017~2021 年六大監(jiān)管機(jī)構(gòu)批準(zhǔn)罕見病藥和非罕見病藥的時(shí)間線進(jìn)行了比較���, 如圖14 所示���。2021 年,F(xiàn)DA 的罕見病藥中位批準(zhǔn)時(shí)間最短(243天)��,可能由于大部分產(chǎn)品為通過加速審評(píng)獲得批準(zhǔn)�。2021 年,PMDA 的罕見病藥中位批準(zhǔn)時(shí)間位居第二(267 天)����。在日本獲批的所有罕見病藥NAS 均通過加速審評(píng)進(jìn)行,這是因?yàn)榧铀賹徳u(píng)是PMDA 為解決未滿足的醫(yī)療需求而實(shí)施的激勵(lì)政策�����。目前,加拿大衛(wèi)生部未出臺(tái)罕見病藥相關(guān)政策�,但其在2021 年批準(zhǔn)的20 款NAS 已被FDA、EMA 以及TGA 歸類為罕見病藥�,中位批準(zhǔn)時(shí)間為290 天。2021 年EMA 批準(zhǔn)16 種罕見病藥�,中位批準(zhǔn)時(shí)間為447 天,其中獲得快速審評(píng)的罕見病藥占13%��,而2019 年獲得快速審評(píng)的罕見病藥占50%�,2021 年度批準(zhǔn)的4 種罕見病藥的中位批準(zhǔn)時(shí)間為352 天。
3.3 監(jiān)督促進(jìn)路徑(FRP)
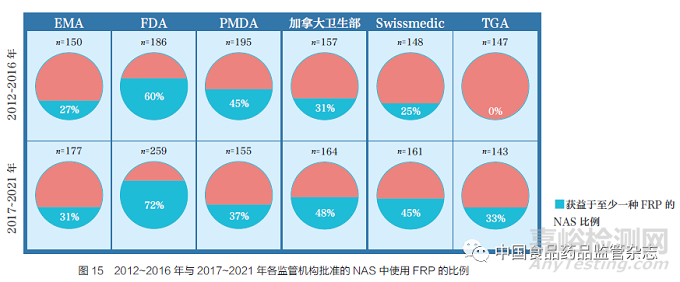
2017~2021 年與2012~2016 年相比�,大部分監(jiān)管機(jī)構(gòu)對(duì)FRP 的使用都有所增加。FDA 是使用FRP 最多的監(jiān)管機(jī)構(gòu)�����,其中2017~2021 年72% 的NAS 至少使用了一種FRP���,其次是加拿大衛(wèi)生部(48%)、Swissmedic(45%)��、PMDA(37%)�、TGA(33%)和EMA(31%),如圖15 所示。TGA 是通過FRP 批準(zhǔn)NAS 數(shù)量增加最多的監(jiān)管機(jī)構(gòu)���,這是由于TGA 最近實(shí)施了5 種FRP[ 優(yōu)先審評(píng)�����、臨時(shí)批準(zhǔn)����、國(guó)外同類監(jiān)管機(jī)構(gòu)(COR)審評(píng)���、Access 工作共享聯(lián)盟和Orbis 計(jì)劃]�。對(duì)比2012~2016 年與2017~2021 年��,PMDA 是唯一通過FRP 批準(zhǔn)NAS 比例略有下降的監(jiān)管機(jī)構(gòu)��。
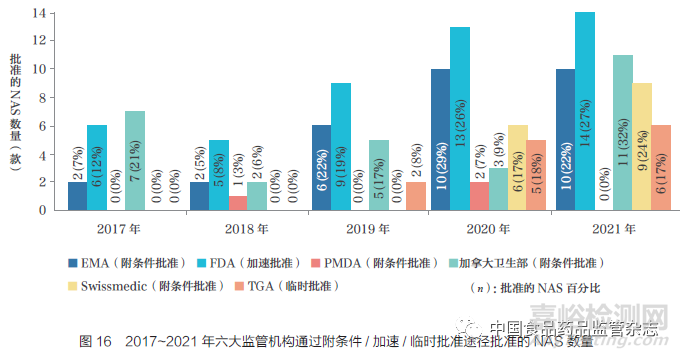
在過去5 年中���,六大監(jiān)管機(jī)構(gòu)的附條件/ 加速/ 臨時(shí)批準(zhǔn)的數(shù)量普遍增加����。2017~2021 年���,F(xiàn)DA 是使用這些途徑批準(zhǔn)NAS 數(shù)量最多的監(jiān)管機(jī)構(gòu)���,批準(zhǔn)了47 款�����, 其次是EMA(30 款)�����、加拿大衛(wèi)生部(28 款)�����、TGA(13 款)��、Swissmedic(15 款)和PMDA(3 款)�,如圖16 所示����。此外,六大監(jiān)管機(jī)構(gòu)通過這些途徑批準(zhǔn)的NAS 數(shù)量呈逐年增加趨勢(shì)�����,并且在2020 年和2021 年為最高���,這可能與新冠疫情相關(guān)產(chǎn)品有關(guān)��。
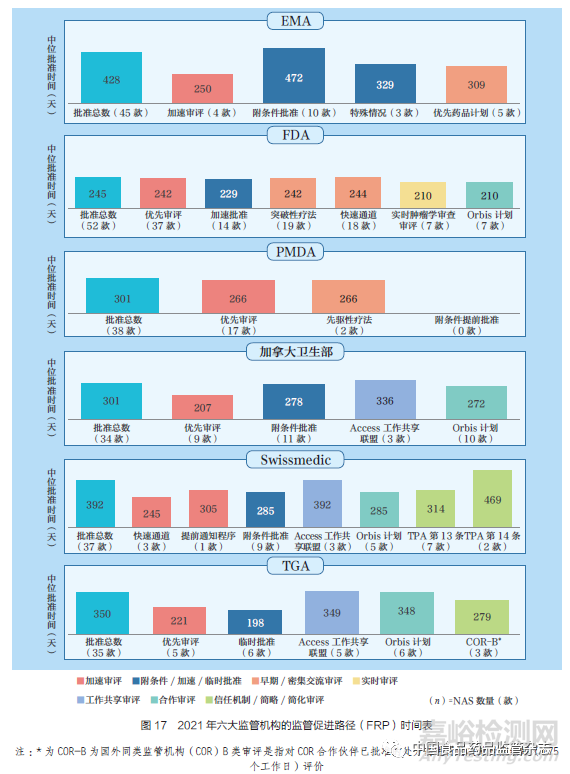
2021 年不同F(xiàn)RP 的NAS 中位批準(zhǔn)時(shí)間���,如圖17 所示。
3.4 治療領(lǐng)域
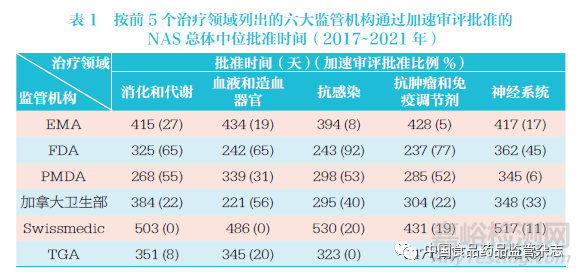
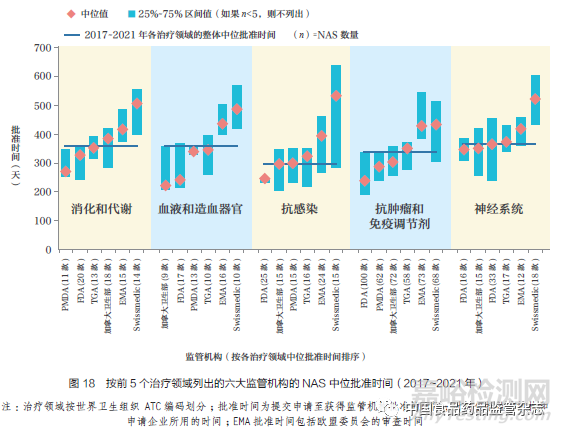
2017~2021 年六大監(jiān)管機(jī)構(gòu)中在前5 的治療領(lǐng)域中批準(zhǔn)的NAS 數(shù)量占全部批準(zhǔn)數(shù)量的77%���,其中抗腫瘤藥物和免疫調(diào)節(jié)劑在前5 個(gè)治療領(lǐng)域批準(zhǔn)數(shù)量中占53%��,如圖18 所示���。抗感染治療藥物的批準(zhǔn)速度略快���,其NAS 中位批準(zhǔn)時(shí)間為296 天����,抗腫瘤藥物和免疫調(diào)節(jié)劑NAS 為337 天�,血液和造血器官治療用NAS 為357 天,消化和代謝領(lǐng)域NAS為358 天��,神經(jīng)系統(tǒng)領(lǐng)域NAS 為365 天。PMDA 在消化和代謝以及神經(jīng)系統(tǒng)領(lǐng)域的批準(zhǔn)速度最快�,F(xiàn)DA 在抗腫瘤藥物和免疫調(diào)節(jié)劑以及抗感染藥物領(lǐng)域的批準(zhǔn)速度最快。這可能是對(duì)于這5 個(gè)治療領(lǐng)域的藥物�����,各監(jiān)管機(jī)構(gòu)使用快速審評(píng)通道的頻率更高�����,如表1 所示���。但同時(shí)�����,如圖18 所示(即25%~75% 區(qū)間值條形圖)���,各監(jiān)管機(jī)構(gòu)在不同的治療領(lǐng)域的批準(zhǔn)時(shí)間也有較大差異。
3.5 新數(shù)據(jù)來源
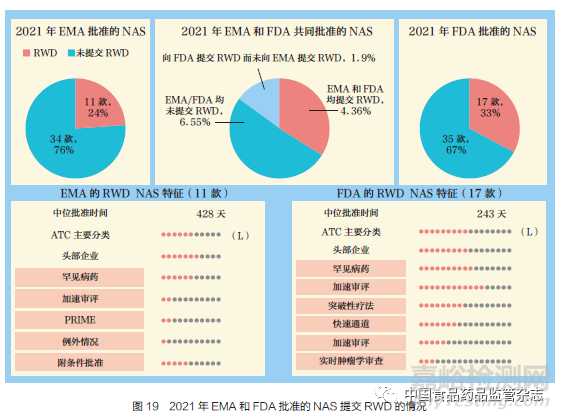
隨著監(jiān)管格局的演變�����,證據(jù)來源正在發(fā)生變化�。這些變化包括申請(qǐng)中更多地使用真實(shí)世界數(shù)據(jù)(RWD)����,以及對(duì)患者體驗(yàn)數(shù)據(jù)(PED)的收集和使用�。本文對(duì)2021 年EMA 和FDA 在申請(qǐng)中采用RWD 的批準(zhǔn)進(jìn)行了分析����。EMA 批準(zhǔn)的NAS 中有24% 申報(bào)資料采用RWD,F(xiàn)DA 為33%����。RWD 是指從多種來源(例如電子健康記錄)定期收集的與患者健康狀況和(或)醫(yī)療保健相關(guān)的數(shù)據(jù)。2021 年�����, 獲得EMA 和FDA 共同批準(zhǔn)的NAS 有11 款���, 如圖19 所示���, 其中兩家監(jiān)管機(jī)構(gòu)有4 款都提交了RWD 資料,有6 款都沒有提交RWD 數(shù)據(jù)�����,剩余1 款NAS 僅向FDA 提交了RWD 資料,但未向EMA 提交����。這些NAS 主要是來自頭部企業(yè)的抗腫瘤藥物和免疫調(diào)節(jié)劑(ATC=L),并且都得益于多種FRP的運(yùn)用���,如EMA 的附條件批準(zhǔn)和FDA的加速審評(píng)(優(yōu)先審評(píng))���。
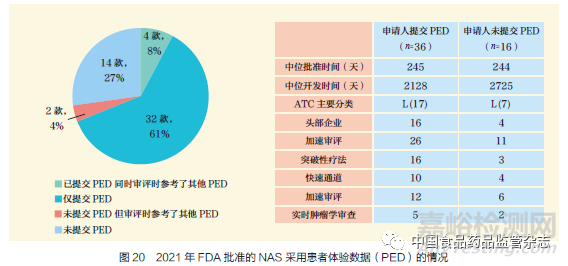
患者體驗(yàn)數(shù)據(jù)(PED)是指系統(tǒng)地收集與患者有關(guān)的體驗(yàn)、觀點(diǎn)�、需求和偏好等有意義的數(shù)據(jù)。2021 年�,52 款NAS獲得FDA 批準(zhǔn)。其中���,38 款使用了PED���,這當(dāng)中的36 款的PED 由申請(qǐng)人提交;36 款NAS 中���,有4 款被監(jiān)管機(jī)構(gòu)認(rèn)為申請(qǐng)人需要補(bǔ)充提交額外的PED作為審評(píng)的重要內(nèi)容��。其余2 款����,盡管申請(qǐng)中沒有提交PED,但審評(píng)員仍將其他PED 作為審評(píng)的重要部分��,如圖20 所示��。
4�����、 2021 年六大監(jiān)管機(jī)構(gòu)批準(zhǔn)的NAS 情況匯總
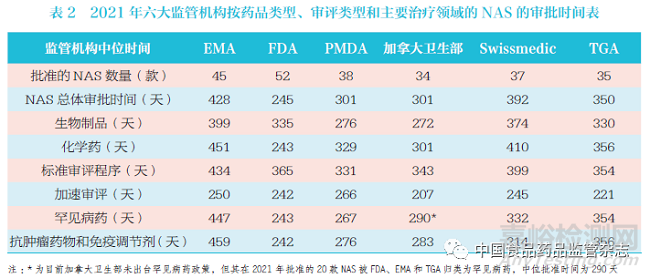
本文按藥品類型�、審評(píng)類型和主要治療領(lǐng)域�,對(duì)六大監(jiān)管機(jī)構(gòu)在2021 年批準(zhǔn)NAS 的審批時(shí)間進(jìn)行了匯總,見表2�。
4.1 2021 年EMA 批準(zhǔn)的NAS 情況
與其他監(jiān)管機(jī)構(gòu)不同的是,EMA 批準(zhǔn)時(shí)間包括了歐盟委員會(huì)的審查時(shí)間��。2021 年EMA 共批準(zhǔn)了45 款NAS�,中位批準(zhǔn)時(shí)間為428 天(至科學(xué)評(píng)估結(jié)束的時(shí)間為369 天),其中歐盟委員會(huì)中位時(shí)間為57 天���,監(jiān)管機(jī)構(gòu)中位時(shí)間為244天����,申請(qǐng)企業(yè)中位時(shí)間為133 天。藥物類型方面���,2021 年EMA 批準(zhǔn)17 款生物制品NAS���,中位批準(zhǔn)時(shí)間為399 天;批準(zhǔn)28 款化學(xué)藥NAS�����,中位批準(zhǔn)時(shí)間為451 天�;批準(zhǔn)21 款抗腫瘤藥物和免疫調(diào)節(jié)劑NAS,中位批準(zhǔn)時(shí)間為459天�;批準(zhǔn)其他治療領(lǐng)域的24 款NAS,中位批準(zhǔn)時(shí)間為416 天��。資格認(rèn)定和審評(píng)類型方面���,2021 年批準(zhǔn)16 款罕見病藥NAS�����,中位批準(zhǔn)時(shí)間為447 天�����,比2021 年批準(zhǔn)的29 款非罕見病藥NAS的中位批準(zhǔn)時(shí)間縮短30 天����。加速審評(píng)方面,值得注意的是�����,EMA 的“加速審評(píng)”指的是“ 加速評(píng)估”���,2021 年EMA 加速審評(píng)批準(zhǔn)4 款NAS,中位批準(zhǔn)時(shí)間為250 天�,比2021 年標(biāo)準(zhǔn)審評(píng)程序批準(zhǔn)的41 款NAS 的中位批準(zhǔn)時(shí)間縮短184 天。
提交時(shí)間差是指向第一家監(jiān)管機(jī)構(gòu)提交申請(qǐng)的日期與向目標(biāo)監(jiān)管機(jī)構(gòu)提交申請(qǐng)的日期之間的間隔���。2021 年EMA 批準(zhǔn)的NAS 中�����,22% 最先獲得EMA 批準(zhǔn)���,或是在FDA、PMDA、加拿大衛(wèi)生部���、Swissmedic 或TGA 最先批準(zhǔn)后的1 個(gè)月內(nèi)獲得EMA 批準(zhǔn)�����。2021 年EMA批準(zhǔn)的NAS 中�����,78% 最先獲得FDA���、PMDA、加拿大衛(wèi)生部�、Swissmedic或TGA 批準(zhǔn),或是在這五家監(jiān)管機(jī)構(gòu)批準(zhǔn)1 個(gè)月后才獲得EMA 批準(zhǔn)���,這些NAS 在EMA 的中位提交時(shí)間差為97 天����。
4.2 2021 年FDA 批準(zhǔn)的NAS情況
2021 年FDA(CDER 和CBER)共批準(zhǔn)了52 款NAS�����,中位批準(zhǔn)時(shí)間為245 天,對(duì)于批準(zhǔn)的NAS����,87% 為首輪批準(zhǔn),13% 為二輪批準(zhǔn)�。藥物類型方面,2021 年批準(zhǔn)17 款生物制品NAS�,中位批準(zhǔn)時(shí)間為335 天;批準(zhǔn)35 款化學(xué)藥NAS���,中位批準(zhǔn)時(shí)間為244 天��;批準(zhǔn)24款抗腫瘤藥物和免疫調(diào)節(jié)劑NAS�,中位批準(zhǔn)時(shí)間為242 天�;批準(zhǔn)其他治療領(lǐng)域的28 款NAS���,中位批準(zhǔn)時(shí)間為284 天��。資格認(rèn)定和審評(píng)類型方面��,2021 年批準(zhǔn)28 款罕見病藥NAS��,中位批準(zhǔn)時(shí)間為243 天���,比2021 年批準(zhǔn)的24 款非罕見病藥NAS 的中位批準(zhǔn)時(shí)間縮短97 天�。加速審評(píng)方面�,F(xiàn)DA 的“加速審評(píng)”是指“ 優(yōu)先審評(píng)”,2021 年FDA 加速審評(píng)批準(zhǔn)37 款NAS����,中位批準(zhǔn)時(shí)間為242天,比2021 年標(biāo)準(zhǔn)審評(píng)程序批準(zhǔn)的15款NAS 的中位批準(zhǔn)時(shí)間縮短123 天�。
2021 年FDA 批準(zhǔn)的NAS 中,85% 最先獲得FDA 批準(zhǔn)�,或是在EMA、PMDA�、加拿大衛(wèi)生部、Swissmedic或TGA 最先批準(zhǔn)后的1 個(gè)月內(nèi)獲得FDA 批準(zhǔn)�����。2021 年FDA 批準(zhǔn)的NAS 中����,15% 最先獲得EMA、PMDA��、加拿大衛(wèi)生部�、Swissmedic 或TGA 批準(zhǔn)���,或是在這五家監(jiān)管機(jī)構(gòu)批準(zhǔn)1 個(gè)月后才獲得FDA 批準(zhǔn)。這些NAS 在FDA 的中位提交時(shí)間差為55 天���。
4.3 2021 年P(guān)MDA 批準(zhǔn)的NAS 情況
2021 年P(guān)MDA 共批準(zhǔn)38 款NAS����,中位批準(zhǔn)時(shí)間為301 天( 至科學(xué)評(píng)估結(jié)束的時(shí)間為272 天)�。藥物類型方面,2021 年批準(zhǔn)16 款生物制品NAS���, 中位批準(zhǔn)時(shí)間為276 天��;批準(zhǔn)22 款化學(xué)藥NAS���,中位批準(zhǔn)時(shí)間為329 天;批準(zhǔn)14 款抗腫瘤藥物和免疫調(diào)節(jié)劑NAS���,中位批準(zhǔn)時(shí)間為276 天;批準(zhǔn)其他治療領(lǐng)域的24 款NAS�,中位批準(zhǔn)時(shí)間為329天。資格認(rèn)定和審評(píng)類型方面���,2021 年批準(zhǔn)16 款罕見病藥NAS����,中位批準(zhǔn)時(shí)間為267 天,比2021 年批準(zhǔn)的22 款非罕見病藥NAS 的中位批準(zhǔn)時(shí)間縮短64天��。加速審評(píng)方面�,2021 年加速審評(píng)批準(zhǔn)17 款NAS,中位批準(zhǔn)時(shí)間為266 天����,比2021 年標(biāo)準(zhǔn)審評(píng)程序批準(zhǔn)的21 款NAS 的中位批準(zhǔn)時(shí)間縮短65 天。
2021 年P(guān)MDA 批準(zhǔn)的NAS中�,26% 最先獲得PMDA 批準(zhǔn), 或是在EMA����、FDA、加拿大衛(wèi)生部����、Swissmedic 或TGA 最先批準(zhǔn)后的1 個(gè)月內(nèi)獲得PMDA 批準(zhǔn)。2021 年P(guān)MDA批準(zhǔn)的NAS 中�,74% 最先獲得EMA、FDA�����、加拿大衛(wèi)生部、Swissmedic 或TGA 批準(zhǔn)�,或是在這五家機(jī)構(gòu)批準(zhǔn)1 個(gè)月后才獲得PMDA 批準(zhǔn)。這些NAS 提交至PMDA 的中位提交時(shí)間差為596 天����。
4.4 2021 年加拿大衛(wèi)生部批準(zhǔn)的NAS 情況
2021 年加拿大衛(wèi)生部共批準(zhǔn)了34款NAS,中位批準(zhǔn)時(shí)間為301 天(至科學(xué)評(píng)估結(jié)束的時(shí)間為300 天)�。藥物類型方面,2021 年批準(zhǔn)13 款生物制品NAS����,中位批準(zhǔn)時(shí)間為272 天;批準(zhǔn)21款化學(xué)藥NAS�����,中位批準(zhǔn)時(shí)間為301天���;批準(zhǔn)20 款抗腫瘤藥物和免疫調(diào)節(jié)劑NAS�,中位批準(zhǔn)時(shí)間為283 天�����;批準(zhǔn)其他治療領(lǐng)域的14 款NAS��,中位批準(zhǔn)時(shí)間為343 天����。資格認(rèn)定和審評(píng)類型方面,目前�,加拿大衛(wèi)生部未出臺(tái)罕見病藥相關(guān)政策,但其在2021 年批準(zhǔn)的20 款NAS被FDA����、EMA 或TGA 歸類為罕見病藥,中位批準(zhǔn)時(shí)間為290 天��。加速審評(píng)方面�����,2021 年加速審評(píng)批準(zhǔn)9 款NAS�,中位批準(zhǔn)時(shí)間為207 天,比2021 年標(biāo)準(zhǔn)審評(píng)程序批準(zhǔn)的25 款NAS 的中位批準(zhǔn)時(shí)間縮短136 天�。
2021 年加拿大衛(wèi)生部批準(zhǔn)的NAS 中,6% 最先獲得加拿大衛(wèi)生部批準(zhǔn)�, 或是在EMA、FDA、PMDA�、Swissmedic 或TGA 最先批準(zhǔn)后的1 個(gè)月內(nèi)獲得加拿大衛(wèi)生部批準(zhǔn)。2021 年加拿大衛(wèi)生部批準(zhǔn)的NAS 中���,94% 最先獲得EMA�����、FDA��、PMDA�、Swissmedic或TGA 批準(zhǔn)�����,或是在這五家機(jī)構(gòu)批準(zhǔn)1個(gè)月后才獲得加拿大衛(wèi)生部批準(zhǔn)���。這些NAS 提交至加拿大衛(wèi)生部的中位提交時(shí)間差為347 天��。
4.5 2021 年Swissmedic 批準(zhǔn)的NAS 情況
2021 年Swissmedic 共批準(zhǔn)37 款NAS���, 中位批準(zhǔn)時(shí)間為392 天( 至科學(xué)評(píng)估時(shí)間為303 天)。藥物類型方面���,2021 年批準(zhǔn)11 款生物制品NAS���,中位批準(zhǔn)時(shí)間為374 天�����;批準(zhǔn)26 款化學(xué)藥NAS,中位批準(zhǔn)時(shí)間為410 天�;批準(zhǔn)19款抗腫瘤藥物和免疫調(diào)節(jié)劑NAS,中位批準(zhǔn)時(shí)間為314 天����;批準(zhǔn)18 款其他治療領(lǐng)域的NAS,中位批準(zhǔn)時(shí)間為460 天�����。資格認(rèn)定和審評(píng)類型方面���,2021 年批準(zhǔn)18 款罕見病藥NAS����,中位批準(zhǔn)時(shí)間為332 天����,比2021 年批準(zhǔn)的19 款非罕見病藥NAS 的中位批準(zhǔn)時(shí)間縮短109 天���。加速審評(píng)方面,Swissmedic“ 加速審評(píng)”指的是“Fast-Track procedure”����,2021 年Swissmedic 加速審評(píng)批準(zhǔn)3款NAS,中位批準(zhǔn)時(shí)間為245 天����,比2021 年標(biāo)準(zhǔn)審評(píng)程序批準(zhǔn)的34 款NAS的中位批準(zhǔn)時(shí)間縮短154 天。
2021 年Swissmedic 批準(zhǔn)的NAS中�����,3% 最先獲得Swissmedic 批準(zhǔn)�����,或是在FDA����、EMA、PMDA���、加拿大衛(wèi)生部或TGA 最先批準(zhǔn)后的1 個(gè)月內(nèi)獲得Swissmedic 批準(zhǔn)�����。2021 年Swissmedic 批準(zhǔn)的NAS 中�����,97% 最先獲得FDA�、EMA��、PMDA�、加拿大衛(wèi)生部或TGA 批準(zhǔn),或是在這五家機(jī)構(gòu)批準(zhǔn)1 個(gè)月后才獲得Swissmedic 批準(zhǔn)���。這些NAS 在Swissmedic 的中位提交時(shí)間差為351 天���。
4.6 2021 年TGA 批準(zhǔn)的NAS情況
2021 年TGA 共批準(zhǔn)35 款NAS,中位批準(zhǔn)時(shí)間為350 天����。藥物類型方面,2021 年批準(zhǔn)14 款生物制品NAS����, 中位批準(zhǔn)時(shí)間為330 天�����;批準(zhǔn)21 款化學(xué)藥NAS�����,中位批準(zhǔn)時(shí)間為356 天��;批準(zhǔn)9 款抗腫瘤藥物和免疫調(diào)節(jié)劑NAS����,中位批準(zhǔn)時(shí)間為356 天����;批準(zhǔn)其他治療領(lǐng)域的26 款NAS,中位批準(zhǔn)時(shí)間為350天��。資格認(rèn)定和審評(píng)類型方面����,2021 年批準(zhǔn)14 款罕見病藥NAS,中位批準(zhǔn)時(shí)間為354 天�����,比2021 年批準(zhǔn)的21 款非罕見病藥NAS 的中位批準(zhǔn)時(shí)間縮短11天。加速審評(píng)方面����,TGA 的“加速審評(píng)”指的是2017 年TGA 實(shí)施的“PriorityReview” 程序,2021 年TGA 加速審評(píng)批準(zhǔn)5 款NAS�,中位批準(zhǔn)時(shí)間為221天,比2021 年標(biāo)準(zhǔn)審評(píng)程序批準(zhǔn)的30款NAS 的中位批準(zhǔn)時(shí)間縮短133 天�。
2021 年TGA 批準(zhǔn)的NAS 中,14% 最先獲得TGA 批準(zhǔn)��, 或是在FDA����、EMA���、PMDA��、加拿大衛(wèi)生部或Swissmedic 最先批準(zhǔn)后的1 個(gè)月內(nèi)獲得TGA 批準(zhǔn)�����。2021 年TGA 批準(zhǔn)的NAS 中�,86% 最先獲得FDA、EMA�、PMDA、加拿大衛(wèi)生部或Swissmedic批準(zhǔn)�����,或是在這五家機(jī)構(gòu)批準(zhǔn)1 個(gè)月后才獲得TGA 批準(zhǔn)��。這些NAS 在TGA的中位提交時(shí)間差為413 天����。
專家點(diǎn)評(píng)
本文介紹了國(guó)際監(jiān)管科學(xué)創(chuàng)新中心(CIRS)對(duì)六大監(jiān)管機(jī)構(gòu)批準(zhǔn)的新活性物質(zhì)(NAS)的年度分析結(jié)果,這六大監(jiān)管機(jī)構(gòu)分別是歐洲藥品管理局(EMA)�、美國(guó)食品藥品監(jiān)督管理局(FDA)、日本藥品和醫(yī)療器械管理局(PMDA)�、加拿大衛(wèi)生部、瑞士醫(yī)藥管理局(Swissmedic)和澳大利亞藥品監(jiān)督管理局(TGA)�。
過去十年,在不同的監(jiān)管機(jī)構(gòu)獲批NAS 數(shù)量整體呈逐漸增加的趨勢(shì)��, 但FDA 和加拿大衛(wèi)生部獲批數(shù)量趨于平穩(wěn)�;從審批周期上來說,以FDA 的中位批準(zhǔn)時(shí)間最短�,本文推測(cè)歸因于廣泛應(yīng)用監(jiān)管促進(jìn)路徑;另外本文從共同審批情況對(duì)提交時(shí)間差和審批時(shí)間����,以及在不同監(jiān)管機(jī)構(gòu)之間的差異進(jìn)行了總結(jié)和分析��,并分析了Access 工作聯(lián)盟和Orbis 計(jì)劃對(duì)審評(píng)效率的影響���。本文詳實(shí)地介紹了六大監(jiān)管機(jī)構(gòu)NAS 批準(zhǔn)時(shí)間的影響因素,包括加速審評(píng)程序���,罕見病藥���,監(jiān)管促進(jìn)路徑,治療領(lǐng)域不同���,新數(shù)據(jù)來源(如真實(shí)世界數(shù)據(jù))等方式和途徑��。
本文以全球的視角,高度概括了六大監(jiān)管機(jī)構(gòu)審批效率的對(duì)比分析�����,闡釋了提高審批效率的多種因素�,以及全球化發(fā)展帶來的監(jiān)管效率的提升。尤其是豐富的數(shù)據(jù)分析維度��,清晰地顯示了監(jiān)管科學(xué)的變化和進(jìn)步,對(duì)讀者更好地理解全球監(jiān)管和審批的發(fā)展趨勢(shì)有重要的參考價(jià)值�����,為我國(guó)監(jiān)管方向提供借鑒意義�����。
引用本文
Juan Lara���,Magda Bujar�,Neil McAuslane����,編譯/ 張穎.2012~2021 年國(guó)外六大監(jiān)管機(jī)構(gòu)新藥審評(píng)情況分析:聚焦監(jiān)管促進(jìn)路徑和國(guó)際化[J].中國(guó)食品藥品監(jiān)管.2023.06(233):12-29.