今日頭條
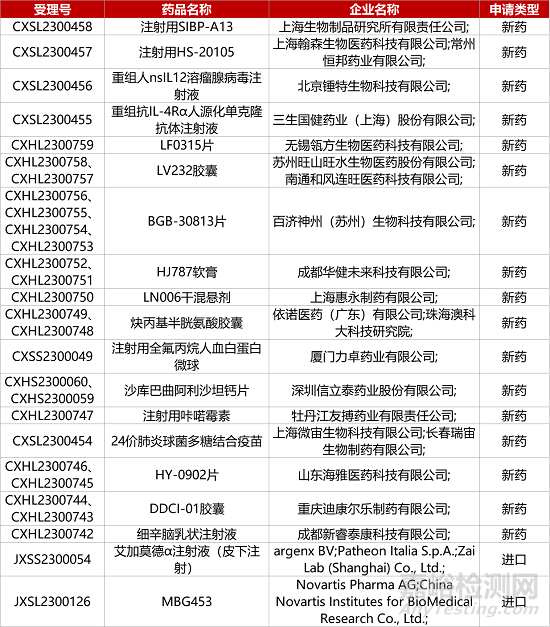
信立泰ARNi類降血壓新藥報(bào)產(chǎn)���。信立泰自主研發(fā)的ARNi類小分子1類新藥沙庫(kù)巴曲阿利沙坦鈣片(S086)的上市申請(qǐng)獲CDE受理�,推測(cè)適應(yīng)癥為治療輕�����、中度原發(fā)性高血壓�。今年1月,S086已在治療輕�、中度原發(fā)性高血壓適應(yīng)癥的III期臨床中達(dá)到主要終點(diǎn)。與奧美沙坦酯(20mg)相比�,接受S086(240mg、480mg)治療12周后患者平均診室坐位收縮壓的降幅均值高1.90���、5.04mmHg�。
國(guó)內(nèi)藥訊
1.復(fù)星引進(jìn)創(chuàng)新型肉毒素報(bào)新NDA。復(fù)星醫(yī)藥從Revance公司引進(jìn)的注射用A型肉毒毒素(RT002����,DaxibotulinumtoxinA-lanm)的第二個(gè)適應(yīng)癥上市申請(qǐng)獲CDE受理,用于治療成人頸部肌張力障礙�。RT002是一種長(zhǎng)效肽制劑神經(jīng)調(diào)節(jié)劑,已獲FDA批準(zhǔn)上市���,用于改善成人中重度皺眉紋���。今年4月,RT002也在中國(guó)遞交了用于改善成人中重度皺眉紋的上市申請(qǐng)����。
2.創(chuàng)勝CLDN18.2抗體獲批胃癌國(guó)際III期臨床。創(chuàng)勝集團(tuán)宣布其Claudin18.2單抗Osemitamab聯(lián)合PD-1抗體納武利尤單抗與化療治療HER2陰性�、CLDN18.2表達(dá)、局部晚期或轉(zhuǎn)移性胃或胃食管(G/GEJ)結(jié)合部腺癌患者的國(guó)際III期臨床(TranStar 301)IND申請(qǐng)分別獲得CDE和韓國(guó)MFDS批準(zhǔn)����。公布于ESMO GI2023年會(huì)的I/II期臨床(NCT04495296)最新數(shù)據(jù)顯示,該藥聯(lián)合卡培他濱和奧沙利鉑(CAPOX)一線治療�����,預(yù)計(jì)中位無(wú)進(jìn)展生存期達(dá)到9.5個(gè)月。
3.諾貝仁褪黑素兒童失眠擬納入優(yōu)先審評(píng)�����。諾貝仁醫(yī)藥申報(bào)的褪黑素顆粒因“符合兒童生理特征的兒童用藥品新品種���、劑型和規(guī)格”被CDE擬納入優(yōu)先審評(píng),適應(yīng)癥為兒童期伴隨神經(jīng)發(fā)育障礙的入睡困難的改善���。這是一款褪黑激素受體激動(dòng)劑�����,旨在通過(guò)褪黑素來(lái)抑制神經(jīng)的興奮性����,使血壓下降����,心跳速度減慢,提高睡眠質(zhì)量�����,讓心臟得到休息,消除疲勞���。2020年3月���,該新藥已在日本獲批上市,商品名為Melatobel�。
4.羅氏CFB靶向反義療法獲批腎病臨床。羅氏從Ionis公司引進(jìn)的靶向補(bǔ)體因子B(CFB)的反義療法RO7434656注射液(IONIS-FB-LRx)獲國(guó)家藥監(jiān)局臨床默認(rèn)許可���,擬開(kāi)發(fā)用于IgA腎病的治療�。去年11月���,IONIS-FB-LRx已在用于治療IgA腎病的II期臨床達(dá)到主要終點(diǎn)�,IONIS-FB-LRx治療29周后�����,患者的蛋白尿較基線平均減少44%����。羅氏擁有該藥物在全球范圍內(nèi)的開(kāi)發(fā)和商業(yè)化授權(quán)。
5.恒瑞3款放射性診療產(chǎn)品獲批臨床。恒瑞醫(yī)藥子公司天津恒瑞醫(yī)藥申報(bào)的3款1類新藥獲批臨床���。其中�,HRS-4357注射液為一款放射性治療類創(chuàng)新藥���,擬開(kāi)發(fā)用于既往接受過(guò)雄激素受體(AR)通路抑制劑和紫杉烷類化療的前列腺特異性膜抗原(PSMA)陽(yáng)性的轉(zhuǎn)移性去勢(shì)抵抗性前列腺癌(mCRPC)�����。HRS-9815注射液和HRS-9815注射液制備用藥盒則適用于成人前列腺癌患者的PSMA陽(yáng)性病灶的正電子發(fā)射斷層掃描(PET)。
6.百濟(jì)神州DGKζ抑制劑報(bào)IND����。百濟(jì)神州1類化藥BGB-30813片的臨床試驗(yàn)申請(qǐng)獲CDE受理。BGB-30813是一種新型DGKζ抑制劑�,具有增強(qiáng)DAG下游信號(hào)通路的潛力,可以激活T細(xì)胞�����,從而增強(qiáng)腫瘤殺傷作用����。今年6月,百濟(jì)神州在Clinicaltrials.gov網(wǎng)站上登記注冊(cè)一項(xiàng)BGB-30813單藥或與PD-1替雷利珠單抗聯(lián)用治療晚期或轉(zhuǎn)移性實(shí)體瘤的I期臨床試驗(yàn),擬評(píng)估其安全性��、耐受性�����、藥動(dòng)學(xué)�����、藥效學(xué)和初步抗腫瘤活性��。
國(guó)際藥訊
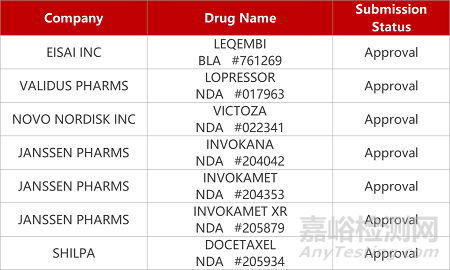
1.衛(wèi)材/渤健AD新藥獲FDA完全批準(zhǔn)�。衛(wèi)材與渤健開(kāi)發(fā)的阿爾茨海默病(AD)抗體療法Leqembi(lecanemab)獲FDA批準(zhǔn)由加速批準(zhǔn)轉(zhuǎn)為完全批準(zhǔn)。Leqembi通過(guò)與可溶性Aβ聚合體結(jié)合�����,可中和并清除具有毒性的可溶性寡聚體���。在Ⅲ期臨床(CLARITY AD)中���,lecanemab與安慰劑組相比,顯著降低AD患者CDR-SB評(píng)分的增加速度�,能夠延緩(大約延緩兩到三年)AD患者進(jìn)展到更嚴(yán)重的疾病階段。
2.創(chuàng)新HER2/3雙抗獲肺癌突破性療法認(rèn)定。Merus公司創(chuàng)新雙抗zenocutuzumab獲FDA授予突破性療法認(rèn)定�,用于治療晚期不可切除或轉(zhuǎn)移性NRG1融合(NRG1+)非小細(xì)胞肺癌。Zenocutuzumab可同時(shí)與HER2和HER3受體相結(jié)合����,阻止HER2和HER3形成二聚體,從而阻斷神經(jīng)調(diào)節(jié)蛋白的信號(hào)傳導(dǎo)��,對(duì)NRG1+癌癥具有治療潛力����。一周前,它剛剛獲得FDA授予用于治療NRG1融合陽(yáng)性胰腺癌的突破性療法認(rèn)定��。
3.羅氏PD-L1抑制劑肺癌Ⅲ期臨床積極��。羅氏在《柳葉刀》上發(fā)表PD-L1抑制劑Tecentriq(atezolizumab)一線治療非小細(xì)胞肺癌的Ⅲ期臨床最新數(shù)據(jù)����。與非鉑類化療相比�����,atezolizumab顯著改善患者的總體生存率【中位總生存期:10.3個(gè)月(95% CI 9.4-11.9)vs9.2個(gè)月(95% CI 5.9-11.2)】�,2年生存率為24%(vs12%),3-4級(jí)治療相關(guān)不良事件發(fā)生率為16%(vs33%)。
4.默沙東啟動(dòng)癌癥疫苗+K藥III期臨床���。默沙東宣布啟動(dòng)癌癥疫苗mRNA-4157 (V940)聯(lián)合PD-1療法帕博利珠單抗(Keytruda)用于一線治療II-IV期黑色素瘤的首個(gè)III期臨床(V940-001)試驗(yàn)��。mRNA-4157是針對(duì)每個(gè)癌癥患者的獨(dú)特腫瘤突變開(kāi)發(fā)的一款個(gè)性化腫瘤新抗原疫苗����。在IIb期臨床KEYNOTE-942/mRNA-4157-P201中��,與單獨(dú)Keytruda相比����,mRNA-4157聯(lián)合輔助治療使腫瘤產(chǎn)生遠(yuǎn)處轉(zhuǎn)移或死亡的風(fēng)險(xiǎn)降低65%。
5.羅氏撤回RET抑制劑一項(xiàng)適應(yīng)癥���。羅氏旗下基因泰克在美國(guó)撤回RET抑制劑Gavreto(普拉替尼)用于治療晚期RET突變甲狀腺髓樣癌的加速批準(zhǔn)上市許可�����?�;蛱┛吮硎?,其撤回適應(yīng)癥的決定并非由于Gavreto的任何新的安全性或有效性數(shù)據(jù)或產(chǎn)品質(zhì)量問(wèn)題���,在美國(guó)獲批的其他適應(yīng)癥不受影響���。據(jù)悉�����,羅氏基于戰(zhàn)略原因已于今年2月終止與Blueprint公司關(guān)于Gavreto的全球合作����,將該藥物的全球權(quán)益歸還給Blueprint�����。
6.Teva計(jì)劃出售API業(yè)務(wù)部門(mén)����。據(jù)外媒Endpoints披露,Teva正在考慮出售其原料藥(活性藥物成分����,API)業(yè)務(wù)�����。Teva已聘請(qǐng)了顧問(wèn)來(lái)考察是否有買方愿意以約20億美元的價(jià)格收購(gòu)該業(yè)務(wù)部門(mén)。Teva有著強(qiáng)大的API業(yè)務(wù)供應(yīng)鏈����,目前該業(yè)務(wù)部門(mén)已在全球14個(gè)生產(chǎn)基地?fù)碛屑s4000名員工,生產(chǎn)約350種產(chǎn)品����。2023年5月,Teva曾宣布了一項(xiàng)“轉(zhuǎn)向增長(zhǎng)”戰(zhàn)略���,為了更好地占領(lǐng)每年增長(zhǎng)約6%的API市場(chǎng)���,其考慮將API業(yè)務(wù)獨(dú)立出來(lái)。
醫(yī)藥熱點(diǎn)
1.河北省將再建一大型醫(yī)院�。近日,河北省滄州市發(fā)改委批復(fù)滄州市新華區(qū)人民醫(yī)院建設(shè)項(xiàng)目建議書(shū)�,原則同意滄州市新華區(qū)衛(wèi)生健康局開(kāi)展滄州市新華區(qū)人民醫(yī)院建設(shè)項(xiàng)目前期工作。該項(xiàng)目總投資約106710萬(wàn)元�����;規(guī)劃編制床位436張���,總建筑面積約115582㎡���;其中地上建筑面積約69782㎡, 包括醫(yī)療綜合樓���、住院樓、感染樓�、后勤保障樓、附屬配套用房�、地下車庫(kù)出入口等。
2.國(guó)家級(jí)醫(yī)療應(yīng)急工作專家組成立��。國(guó)家衛(wèi)健委日前發(fā)布《關(guān)于成立國(guó)家衛(wèi)生健康委醫(yī)療應(yīng)急工作專家組的通知》����,旨在進(jìn)一步發(fā)揮國(guó)家級(jí)專家在醫(yī)療應(yīng)急工作中的技術(shù)支持和業(yè)務(wù)指導(dǎo)作用,提高醫(yī)療應(yīng)急處置能力和水平�����,保障和維護(hù)人民群眾生命安全和身體健康��?!锻ㄖ访鞔_,國(guó)家級(jí)醫(yī)療應(yīng)急工作專家組包括急診醫(yī)學(xué)科�、重癥醫(yī)學(xué)科��、流行病學(xué)等22個(gè)組。
3.我國(guó)嚴(yán)打非法應(yīng)用人類輔助生殖技術(shù)��。國(guó)家衛(wèi)健委等14部門(mén)聯(lián)合制定《開(kāi)展嚴(yán)厲打擊非法應(yīng)用人類輔助生殖技術(shù)專項(xiàng)活動(dòng)工作方案》�,強(qiáng)化與人類輔助生殖技術(shù)應(yīng)用相關(guān)的全鏈條管理:要求建立健全準(zhǔn)入和退出機(jī)制,嚴(yán)格規(guī)范人類輔助生殖技術(shù)審批和校驗(yàn)管理����,加大對(duì)醫(yī)療機(jī)構(gòu)和醫(yī)務(wù)人員違規(guī)開(kāi)展人類輔助生殖技術(shù)的行政處罰力度;嚴(yán)禁輔助生殖技術(shù)從業(yè)人員在不具備資質(zhì)或者不具備相應(yīng)技術(shù)類別的機(jī)構(gòu)開(kāi)展輔助生殖技術(shù)服務(wù)�;嚴(yán)禁互聯(lián)網(wǎng)醫(yī)院開(kāi)具屬于藥品網(wǎng)絡(luò)銷售禁止清單所列的輔助生殖常用藥品處方。
評(píng)審動(dòng)態(tài)
1. CDE新藥受理情況(07月09日)
2. FDA新藥獲批情況(北美07月06日)