摘要
目的:分析2011—2021年期間中國獲批新藥上市的絕對滯后與相對滯后的狀況及原因,并初步探究影響新藥上市滯后的潛在因素�。
方法:收集2011—2021年期間中國、美國�、歐盟以及日本藥監(jiān)部門批準上市的新藥信息,并確定中國批準上市的新藥在全球首次獲批上市的時間���,以計算中國新藥上市的絕對滯后和相對滯后���;采用多元回歸分析方法探究藥物滯后相關的影響因素�。
結(jié)果:2011—2021年期間中國共批準新藥280個�,與美國、歐盟和日本的絕對滯后分別為180�����,82和154個���?����?傮w相對滯后中位時長為1359d�,其中2011—2014年滯后中位時長逐漸增加�����,2014年達到頂峰(3438d)�����;2015—2018年滯后中位時長下降明顯�����;2019—2021年滯后中位時長呈逐年下降態(tài)勢,2020和2021年處于總體滯后中位時長以下�,分別為1134和500d。感覺器官治療領域[非標準化系數(shù)(B)=-1153.840�,P<0.05]的新藥與較短的滯后中位時長相關,具有孤兒藥認定資格(B=441.147���,P<0.01)、分類為生物制品(B=502.205���,P<0.01)的新藥與較長的滯后中位時長相關�����。
結(jié)論:2011—2021年中國新藥上市滯后問題得到明顯的改善�,但各治療領域的新藥仍普遍存在滯后現(xiàn)象���。在新政策背景下���,進一步提升新藥審評審批的質(zhì)量和效率、加強政府審批機構(gòu)與申報企業(yè)的溝通交流���、對接國際通行規(guī)則�、鼓勵企業(yè)開展國際多中心臨床試驗等是減少新藥上市滯后的關鍵。
關鍵詞:上市滯后�����;新藥審評審批�����;滯后因素
正文:
新藥上市是一個藥物從研發(fā)到商業(yè)化的重要里程碑�����,意味著患者能夠獲得最新的治療方案�,對改善病種的發(fā)病率和死亡率都有著重要的意義。然而�,自20世紀60年代“反應停”事件發(fā)生以來,各國政府紛紛加強了對新藥上市的監(jiān)管�,制藥企業(yè)需要進行臨床試驗證明藥物的安全性和有效性,并經(jīng)過藥品監(jiān)管部門的審評審批才能將藥品上市銷售�����。與新藥相關的不良反應事件發(fā)生往往會讓監(jiān)管部門對新藥的審評審批更加嚴苛謹慎�,加上各國藥品監(jiān)管系統(tǒng)的差異以及藥企研發(fā)策略的不同,導致了同一個新藥在不同國家上市的批準時間具有先后順序,這一現(xiàn)象被稱為“藥物滯后(drug lag)”[1]�����。
中國的藥物滯后問題已存在多年�����,過去20多年中國新藥獲批上市的數(shù)量遠遠落后于歐盟�����、美國等發(fā)達國家或地區(qū)[2]�,國家藥品監(jiān)督管理局藥品審評中心(Center for Drug Evaluation���,CDE)的注冊申請積壓影響了具有高臨床治療價值新藥的可及性�����。雖然中國藥品監(jiān)管部門自2009年起出臺了一系列如《藥品注冊特殊審批管理規(guī)定》�����、《關于藥品醫(yī)療器械審評審批制度的意見》���、《化學藥品注冊分類改革工作方案》�����、《關于解決藥品注冊積壓實行優(yōu)先審批的意見》等政策文件�,旨在加快新藥審批審評�����、解決注冊審批積壓問題�,并取得了不錯的成效,但是中國新藥上市滯后問題依舊存在[3-6]�,2016—2020年中國批準的進口抗腫瘤新藥上市時間相對于美國滯后中位時長為2.7年[7]。因此���,本研究以2011—2021年在中國獲批上市的新藥為研究對象�����,以藥物國際誕生日(international birth date�,IBD)作為時間標準分析中國新藥批準上市的滯后問題并對其影響因素進行初步探究�����,探尋新藥上市滯后的關鍵原因,為解決中國藥物滯后問題提供參考���。
1���、數(shù)據(jù)來源與方法
1.1 IBD
IBD是指藥品在世界上任何國家首次上市許可的日期[8]。
1.2 數(shù)據(jù)收集及納入標準
由于世界各國對新藥的定義各不相同�,為保證新藥的納入標準一致,本研究以國際監(jiān)管科學創(chuàng)新研究中心的研究作為參考[9]�,將新藥定義為含有新分子實體(new molecular entities,NMEs)的藥物���。其中根據(jù)ICH指導原則Q1A(R2)部分�,新分子實體是指在有關國家或地區(qū)的藥品管理機構(gòu)注冊過的任何藥品中從未出現(xiàn)過的一種活性藥物成分���。
國內(nèi)藥品信息數(shù)據(jù)主要來源于第三方數(shù)據(jù)庫“Insight”數(shù)據(jù)庫[10]、“藥融云”數(shù)據(jù)庫[11]�、國家藥品監(jiān)督管理局(National Medical Products Administration,NMPA)和CDE官網(wǎng)公開信息���、CDE藥品年度審評報告[12]�;美國藥品信息數(shù)據(jù)主要來源于Drug@FDA數(shù)據(jù)庫[13]和美國FDA官網(wǎng)公開信息���;歐盟藥品信息數(shù)據(jù)主要來源于歐洲公共評估報告(European Public Assessment Report�����,EPAR)[14]�、成員國藥品信息登記目錄(National Registers,NR)[15]及歐洲EMA官網(wǎng)公開信息�;日本藥品信息數(shù)據(jù)主要來源于藥品和醫(yī)療器械監(jiān)督管理局(Pharmaceuticals and Medical Devices Agency,PMDA)官網(wǎng)“已批準的產(chǎn)品列表”[16]�。
從以上數(shù)據(jù)庫(中國的新藥數(shù)據(jù)主要來自“Insight”數(shù)據(jù)庫)收集2011—2021年批準上市的化學新藥和生物新藥(治療用生物制品)的相關信息,包括藥品名稱�、獲批適應證、批準時間�、企業(yè)名稱、藥品類型等���。因為中國分別在2016和2019年對化學藥品和生物制品的注冊分類進行修訂�,所以中國化學新藥數(shù)據(jù)納入標準分為2016年以前舊注冊分類為1.1類�、1.2類、1.5類�����、3類和2016年以后新注冊分類為1類�、5.1類的新藥�;生物新藥數(shù)據(jù)納入標準分為2020年以前注冊分類為1類�、2類、3類�、4類、6類�����、7類和2020年以后注冊分類為1類�����、3.1類���、3.2類的新藥���,同時需要對上述分類的化學藥和生物藥進行篩選,通過“藥融云”數(shù)據(jù)庫�、NMPA官網(wǎng)公開信息進一步排除當中不符合本研究新藥定義的藥物。IBD通過“藥融云”數(shù)據(jù)庫���、全球各國的藥監(jiān)政府官網(wǎng)信息、藥企官網(wǎng)信息進行確定�,對于一些爭議性新藥的IBD將進一步通過學術文獻�����、新聞���、行業(yè)報告等資料加以確認,若僅提及批準年份則批準日期統(tǒng)一按該年1月1日處理�����。本研究統(tǒng)計范圍不包括中藥���、預防用生物制品(疫苗)���、診斷試劑以及藥械組合產(chǎn)品。
1.3 藥物滯后分析
藥物滯后分為絕對滯后和相對滯后�,前者可用批準藥物的實際數(shù)量進行衡量,即一段時間跨度內(nèi)不同國家/地區(qū)批準上市的藥物數(shù)量差異�����;后者衡量的標準是時間���,即某一藥物在不同國家/地區(qū)之間批準上市的時間差[17]�。絕對滯后以中國NMPA、美國FDA�����、歐洲EMA和日本PMDA這4個國家/地區(qū)的監(jiān)管機構(gòu)批準的新藥數(shù)量進行計算�����,相對滯后以新藥首次全球批準時間作為標準�,計算中國每個上市新藥獲批的滯后時間,以中位時長進行分析���。本研究將新藥獲批上市的類型分為“中國首批”�����、“國外首批”�����、“僅境內(nèi)獲批”以及“境內(nèi)外獲批”�。“中國首批”是指新藥全球首次上市獲批發(fā)生在中國�,IBD為在中國獲批上市的日期;“國外首批”是指新藥全球首次上市獲批發(fā)生在國外,IBD為在國外獲批上市的日期�;“僅境內(nèi)獲批”是指新藥只在本國或地區(qū)境內(nèi)獲批上市�,境外尚未有國家或地區(qū)批準許可上市;“境內(nèi)外獲批”是指新藥除在本土獲批以外�,在其他國家/地區(qū)(不包括中國香港地區(qū)、中國澳門地區(qū)和中國臺灣地區(qū))同樣獲批上市�。廠家類型統(tǒng)計分為“國外企業(yè)”和“國內(nèi)企業(yè)”,其中“國外企業(yè)”是指由外商獨資經(jīng)營的制藥企業(yè)���;“國內(nèi)企業(yè)”是指內(nèi)資制藥企業(yè)�����,統(tǒng)計包括中外合資企業(yè)以及從外國企業(yè)獲得藥品許可的內(nèi)資企業(yè)�。“孤兒藥認定資格”以美國FDA認定的孤兒藥為準���;若藥物未獲得美國FDA孤兒藥認定資格�����,則以中國衛(wèi)生健康委員會發(fā)布的《第一批罕見病目錄》(以下簡稱《罕見病目錄》)作為依據(jù)[18]�,根據(jù)藥物上市獲批的適應證進行孤兒藥界定���。
1.4 統(tǒng)計分析
由于數(shù)據(jù)不呈正態(tài)分布�,因此使用Wilcoxon符號秩和檢驗來檢驗統(tǒng)計結(jié)果的顯著差異。多元回歸分析作為統(tǒng)計學上分析數(shù)據(jù)的方法�,目的在于了解多個自變量與因變量之間是否具有線性關系,預測藥物滯后可能受多個因素影響�����,因此使用多元回歸分析探索與藥物滯后相關的因素�����。以上均使用SPSS Statistics 26.0統(tǒng)計軟件對數(shù)據(jù)進行分析�。
2、結(jié)果
如表1和表2所示�����,2011—2021年間�����,中國共批準280個新藥上市�,其中化學藥203個(72.5%)、生物藥77個(27.5%)���。
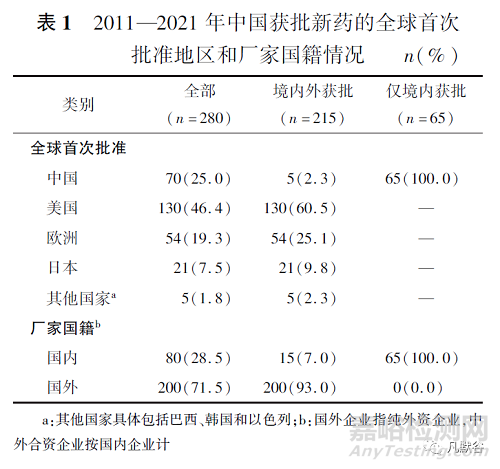
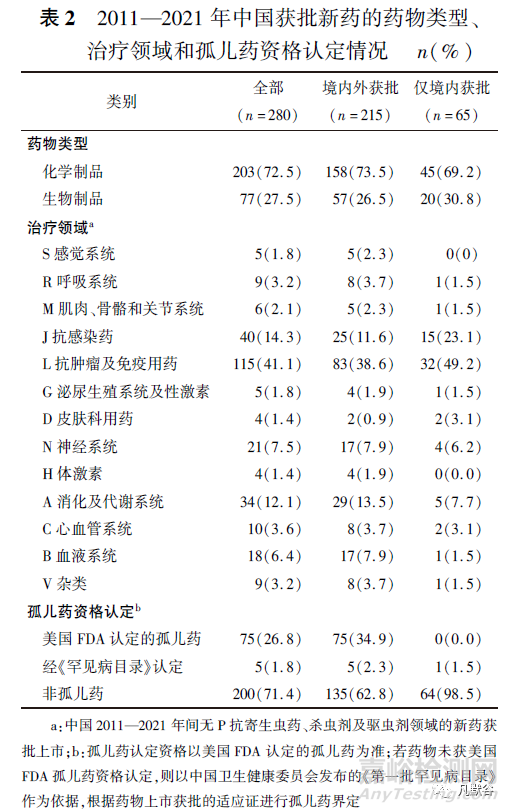
在280個新藥中�,有70個新藥是由中國全球首次批準,占所有獲批新藥的25.0%�����,其余分別為美國全球首批130個(46.4%)���、歐洲地區(qū)54個(19.3%)、日本21個(7.5%)�����、其他國家5個(1.8%)�。在中國全球首次批準上市的70個新藥中,已在其他國家批準上市的新藥僅5個(艾拉莫德�、羅沙司他、西達本胺���、康柏西普���、艾博韋泰),其余所有新藥(65個)只在中國境內(nèi)上市�����,并且均來自國內(nèi)企業(yè)申報。中國國內(nèi)企業(yè)和國外企業(yè)的新藥獲批數(shù)量存在較大差異�����,國外企業(yè)獲批上市的新藥個數(shù)為200個�����,占中國所有獲批新藥數(shù)量的71.5%�;國內(nèi)企業(yè)獲批上市的新藥個數(shù)為80個,占28.5%���,其中15個取得國外監(jiān)管機構(gòu)的上市許可。
另外���,國內(nèi)企業(yè)獲批上市的新藥數(shù)量多于中國全球首次批準數(shù)量�����,說明了部分國產(chǎn)新藥全球首次獲批上市地點是在國外而非中國�����。按世界衛(wèi)生組織藥物解剖學���、治療學及化學(anatomical therapeutic chemical���,ATC)分類代碼第一級治療領域劃分[19],L抗腫瘤及免疫用藥(115個�����,41.1%)���、J抗感染(40個,14.3%)�����、A消化及代謝系統(tǒng)(34個�,12.1%)是中國新藥批準活躍的三大治療領域,對于僅本土獲批的新藥而言�,L抗腫瘤及免疫用藥領域的新藥占近一半(33個,48.5%)�����。相對地,過去11年中國較少新藥獲批上市的治療領域是H體激素(4個�,1.4%)和D皮膚科用藥(4個,1.4%)�。按孤兒藥資格認定進行統(tǒng)計,共80個孤兒藥獲批上市���,約占所有獲批新藥數(shù)量的1/4���。
2.1 中國新藥上市的絕對滯后
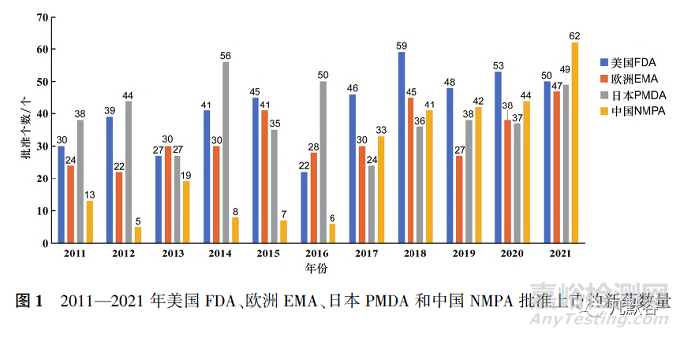
圖1顯示了美國、歐盟�、日本和中國這4個國家/地區(qū)于2011—2021年間上市的新藥數(shù)量,各藥品監(jiān)管機構(gòu)批準新藥數(shù)量由多至少分別是美國FDA(460個)�����、日本PMDA(434個)�����、歐洲EMA(362個)���、中國NMPA(280個)�����。
11年間中國NMPA相對于美國FDA�����、日本PMDA�、歐洲EMA批準新藥的絕對滯后分別為180,154和82個�,2017年起中國NMPA與歐洲EMA和日本PMDA每年的絕對滯后基本為0,但與美國FDA仍存在滯后(見表3)�����。
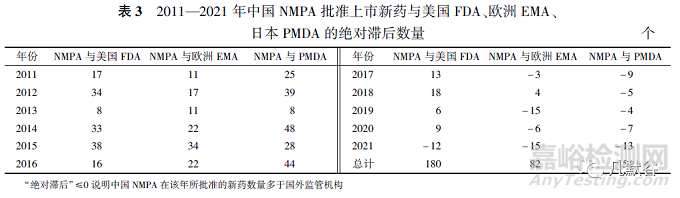
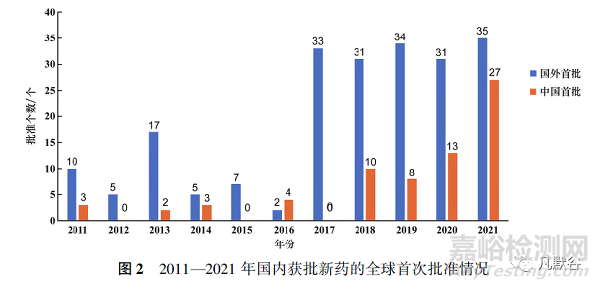
中國每年批準新藥數(shù)量在2011—2016年期間遠遠落后于其他3個國家/地區(qū)�,2014—2016年連續(xù)3年僅有個位數(shù)的獲批新藥數(shù)量���,但2017年以后中國批準新藥數(shù)量井噴式爆發(fā)并且逐年上升���,2021年批準新藥數(shù)量達到了62個,為歷年最高���。此外�����,2017年后每年“國外首批”的新藥數(shù)量總體維持在30個左右�����,而“中國首批”的新藥數(shù)量卻在不斷增加�,2021年“中國首批”與“國外首批”的新藥數(shù)量僅相差8個(見圖2)。
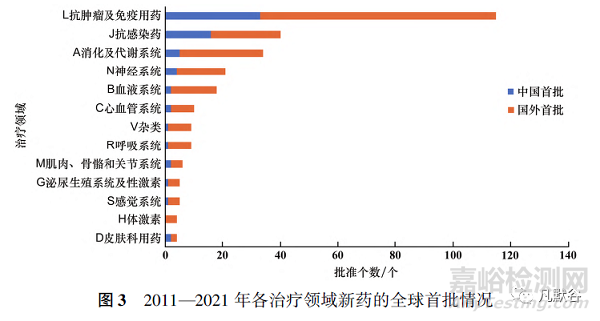
在13種ATC治療領域一級分類中�,同樣是以“國外首批”的新藥上市為主,獲批新藥主要集中在L抗腫瘤及免疫用藥領域���,獲批新藥數(shù)量遠超第2位和第3位的J抗感染藥和A消化及代謝系統(tǒng)�,在H體激素領域中沒有誕生“中國首批”的新藥(見圖3)���。
2.2 中國新藥上市的相對滯后
通過計算新藥獲批上市日期與IBD的時間差得到2011—2021年中國NMPA批準上市新藥相對于IBD的滯后天數(shù)�����,并使用Wilcoxon符號秩和檢驗比較每年新藥獲批上市的相對滯后天數(shù)與總體滯后中位時長的差異�,結(jié)果見圖4�。新藥上市總體滯后中位時長為1359d,自2011年起中國新藥批準上市滯后中位時長逐漸變大�����,于2014年達到頂峰(3438d),隨后幾年逐漸下降�,2020和2021年滯后中位時長明顯低于總體滯后中位時長,分別為1134和500d���。
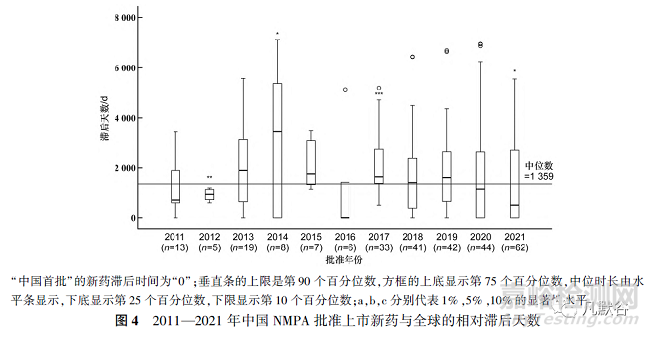
由于2014年滯后中位時長達到峰值�,故將2011—2014年�����、2015—2018年�、2019—2021年分為3組以觀察不同治療領域間的上市滯后變化,0≤滯后時間中位數(shù)(年)<2為“+”���,2≤滯后中位時長(年)<4為“++”�����,4≤滯后中位時長(年)<6為“+++”,滯后中位時長(年)≥6為“++++”�,見表4。
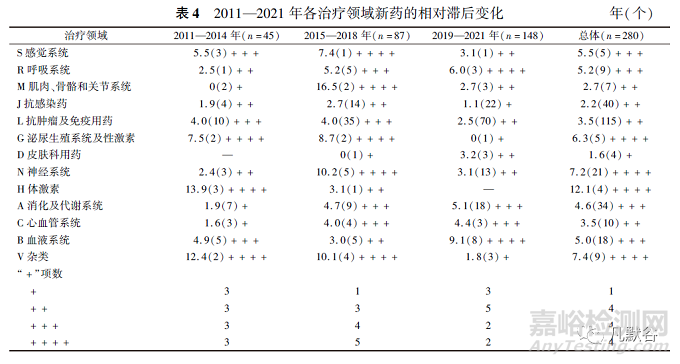
總體來看���,所有新藥中�,感覺系統(tǒng)、抗腫瘤及免疫用藥���、抗感染藥���、泌尿生殖系統(tǒng)及性激素、神經(jīng)系統(tǒng)等治療領域的滯后中位時長在近11年來均有所改善或保持良好�,在新藥批準數(shù)量相對較多的治療領域中(總批準數(shù)量≥20個),僅消化及代謝系統(tǒng)領域的滯后中位時長在增加�����,3組滯后中位時長分別為1.9�����,4.7和5.1年���。對于2019—2021年批準的藥物�����,滯后中位時長≥4年的治療領域有4項���,分別是消化及代謝系統(tǒng)(5.1年)�、心血管系統(tǒng)(4.4年)�����、呼吸系統(tǒng)(6.0年)和血液系統(tǒng)(9.1年)�,相比總體或者2011—2014年和2015—2018年所批準的藥物,滯后中位時長在4年以上的治療領域項數(shù)已明顯減少�。
2.3 中國新藥上市滯后影響因素的初步探究
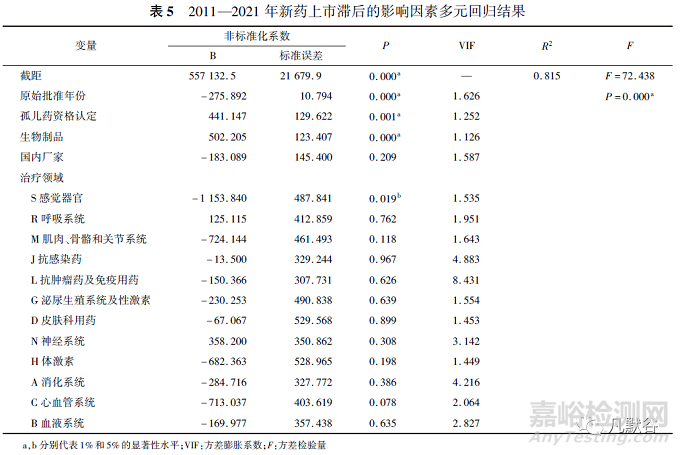
國外有研究指出,藥物滯后與幾個因素有關�����,包括企業(yè)國籍、分子類型、治療領域�、孤兒藥地位���、審評過程和臨床研發(fā)的策略[如納入全球臨床試驗(MRCT)][20-21]。為識別中國新藥批準上市滯后的影響因素�,以“相對滯后時間”作為因變量,“廠家國籍”���、“藥物分子類型”、“治療領域”���、“孤兒藥資格認定”���、“原始批準日期(按年份計)”作為自變量并創(chuàng)建分類變量進行多元回歸分析�����,其中“廠家國籍”�����、“藥物分子類型”以及“孤兒藥資格認定”為二值變量���,賦值為0,1�;“治療領域”為多分類變量,以“V雜類”作為參照組共設置12個啞變量�。回歸結(jié)果見表5���。
整體回歸水平上呈顯著性(F=72.438�����,P<0.01)���。結(jié)果表明�����,新藥上市滯后時間與原始批準年份(B=-275.892�,P<0.01)�、感覺系統(tǒng)治療領域(B=-1153.840,P<0.05)呈負相關�����;與具有孤兒藥資格認定(B=441.147�,P<0.01)、藥物分類為生物制品(B=502.205�����,P<0.01)呈正相關�����。盡管不同治療領域之間的新藥上市滯后時間存在差異�����,但除了感覺器官領域外�����,回歸結(jié)果未能說明不同治療領域分組和滯后中位時長之間存在相關性�����;新藥上市滯后時間與“國內(nèi)企業(yè)”呈負相關�,這是由于國內(nèi)企業(yè)獲批的新藥相對滯后時間絕大部分為0,理論上應能降低藥物滯后時間���,但回歸結(jié)果無統(tǒng)計學意義�����,因此本研究數(shù)據(jù)尚不能證實廠家國籍是影響新藥上市滯后的重要變量�。
3�、討論
本研究比較了2011—2021年間美國、歐盟���、日本���、中國4個國家或地區(qū)批準的新藥數(shù)量以及在中國獲批上市的280個新藥的獲批時間與其在全球首次獲批的時間差異�����。結(jié)果表明�,同一時間跨度內(nèi)�,中國NMPA批準上市的新藥總數(shù)量遠遠落后于美國FDA、歐洲EMA和日本PMDA�����,獲批上市時間相對于IBD而言�,總體滯后中位時長為1359d。
3.1 藥品審評審批制度改革初顯成效���,新藥上市滯后問題得到改善
過去冗長的藥品審評審批和臨床試驗審批程序是造成藥物滯后的原因之一[22]���,但近年來得益于藥品審批審評制度改革工作的持續(xù)推進,中國新藥上市的滯后問題正逐步好轉(zhuǎn)�。從絕對滯后的角度來看,2017—2021年間中國NMPA與歐洲EMA�、日本PMDA的絕對滯后基本為0,2017年無疑是中國新藥上市絕對滯后減少的轉(zhuǎn)折點���。一方面�����,原國家食品藥品監(jiān)督管理總局(CFDA)在2017年正式加入ICH���,這意味著中國在藥品注冊技術方面的要求與國際規(guī)則逐步接軌。對企業(yè)而言�����,按照國際通行規(guī)則進行新藥研發(fā)更容易獲得其他國家的批準上市�,不僅有利于進口新藥進入中國市場,同時也有利于國產(chǎn)新藥面向國際���;對NMPA而言���,接受并參與國際規(guī)則的制定和實施能減少中國與其他國家之間在藥品注冊技術、申報資料等要求上所存在的審評差異���,從而提升新藥的審評審批效率���;另一方面���,原CFDA于2017年出臺的《關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》和《國家食品藥品監(jiān)督管理總局關于調(diào)整進口藥品注冊管理有關事項的決定》中進一步放開了國際多中心臨床試驗數(shù)據(jù)在新藥注冊申報時的使用限制,鼓勵企業(yè)開展全球同步的臨床試驗�,并優(yōu)化了進口新藥的注冊申報程序,此舉減少了非必要的重復申報和臨床試驗���,從而加快了新藥在中國的上市速度���。從相對滯后的角度來看,新藥獲批上市的滯后中位時長在2011—2014年間伴隨著CDE審評任務的大量積壓達到峰值���,自2015年以來�,原CFDA出臺《總局關于發(fā)布化學藥品注冊分類改革工作方案的公告》���、《總局關于發(fā)布化學藥品新注冊分類申報資料要求(試行)的通告》�����、《關于解決藥品注冊申請積壓實行優(yōu)先審評審批的意見》等一系列政策文件來解決審評積壓問題�,具體措施包括對化學藥品的注冊分類���、注冊申報資料�����、優(yōu)先審評審批等重新作出要求�����,新修訂的申報資料要求更加趨向于國際通用的標準注冊技術文件格式(CTD)�,進一步規(guī)范了注冊申請人按照標準的新藥研發(fā)理念進行上市前的研究[23],也使得2015年之后的滯后中位時長有了明顯下降���。此外,2019年新修訂的《藥品管理法》中新增的附條件審批制度���、臨床試驗默示許可制度�、關聯(lián)審評審批制度等在加快新藥上市速度方面都起到了重要作用�����,自2019年《藥品管理法》以及2020年《藥品注冊管理辦法》實施以來�����,2021年的滯后中位時長下降到500d�����,為過去11年中最低。
3.2 新藥以歐洲�����、美國全球首批居多���,國產(chǎn)新藥受國際認可程度較低
中國批準上市的新藥以境外已上市的新藥為主�����,其中大部分新藥由美國FDA或歐洲EMA率先批準上市���,隨后引進至中國。由中國藥品監(jiān)管部門批準首次全球上市的新藥有70個���,占所有批準上市新藥的25.0%�,并且?guī)缀跞縼碜员就疗髽I(yè)的申報�。同樣的,近幾年來日本也存在相似情況�,Tanaka等[24]在關于日本新藥上市滯后問題的研究中發(fā)現(xiàn)2008—2019年在日本批準上市的400個新藥中有80個(20%)是由日本PMDA批準首次全球上市,其余大部分新藥都來自歐洲或美國。此外���,在由中國批準首次全球上市的新藥當中只有5款在國外獲得批準上市�����,分別是2011年上市的艾拉莫德片�����、2013年上市的康柏西普眼用注射液�����、2014年上市的西達本胺片�����、2018年上市的羅沙司他膠囊和艾博韋泰注射液,其余65款國產(chǎn)新藥僅在本土獲批�����;相比之下�,日本在這方面的新藥多達35款。可見�����,全球首次上市的新藥以誕生在歐洲�����、美國的居多���,雖然由中國首批全球上市的新藥具有一定比例�����,但其中能走出國門獲得其他國家批準上市的新藥卻少之又少���。在全球一體化的大背景下,國產(chǎn)新藥“出海”是本土醫(yī)藥企業(yè)謀求國際化發(fā)展的一個重要方向���,但近年來卻屢屢受阻�。如2022年5月國內(nèi)某藥企的治療胰腺和非胰腺神經(jīng)內(nèi)分泌瘤新藥因臨床研究數(shù)據(jù)不足被美國FDA拒絕批準上市���,美國FDA在回復函中表明�,需要納入更多代表美國患者人群的國際多中心臨床試驗來支持美國獲批[25];同一時間國內(nèi)另外一藥企的腫瘤免疫新藥以需要進行質(zhì)控流程變更為理由被美國FDA拒絕[26]�����。由于各國藥品監(jiān)管法律法規(guī)體系不一且復雜�,國內(nèi)企業(yè)想要立足國際化市場,必須要熟悉各國家的法律法規(guī)�����、緊跟當?shù)刈钚碌脑u審要求并依照國際標準行事�����,如布局全球多區(qū)域多中心臨床試驗���、踐行ICH E17指導原則�、與監(jiān)管部門開展及時�、充分的溝通,這樣在一定程度上可以減少各國藥監(jiān)體系差異帶來的不確定性�,為新藥“出海”鋪平道路���,提高國產(chǎn)新藥的國際認可度���。
3.3 抗腫瘤新藥研發(fā)火熱���,滯后問題有待進一步改善
本研究中,無論是在中國首批還是國外首批�����,抗腫瘤及免疫用藥(115個)是中國新藥上市最活躍治療領域���,相比于其他熱門的治療領域如消化及代謝系統(tǒng)(4.6年)�、神經(jīng)系統(tǒng)(7.2年)�,抗腫瘤及免疫用藥的新藥總體滯后時間雖然較短(3.5年),但仍長于抗感染藥領域(2.2年)���。近年來�����,抗腫瘤及免疫用藥類新藥擁有比其他治療領域藥物更多的研發(fā)資源和更高的優(yōu)先地位�。惡性腫瘤是慢性病患者的主要死因之一[27]���,21世紀以來逐漸成為世界新藥研發(fā)的焦點[28]�,國內(nèi)抗腫瘤類新藥更是備受國際醫(yī)藥投資人的關注,2013—2018年間中國新藥熱點投資在抗腫瘤及免疫用藥治療領域占據(jù)了半壁江山[29]���。自2016年2月實行優(yōu)先審評審批制度以來�,至2017年底為止���,抗腫瘤及免疫用藥領域類藥物在所有納入優(yōu)先審評審批的藥物類型中占比最大[30]�����,原CFDA于2017年12月發(fā)布的《關于鼓勵藥品創(chuàng)新實行優(yōu)先審評審批的意見》中也正式把具有明顯臨床優(yōu)勢且用于惡性腫瘤的藥物納入優(yōu)先審評審批的范圍[31]���。巨大的市場空間、政策扶持力度以及資本的推動讓2019—2021年抗腫瘤及免疫用藥類新藥的滯后中位時長減少至2.5年�,但也導致了目前抗腫瘤及免疫用藥類新藥存在靶點高度集中、重復過度申報�����、新藥同質(zhì)化等問題[32]�����。因此�����,企業(yè)應該貫徹《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則》[33]�,堅持以“臨床價值為導向”進行抗腫瘤新藥的研發(fā),投入到真正意義上的創(chuàng)新而非低效同質(zhì)的“偽創(chuàng)新”�����,減少不必要的資源浪費�,從而提升臨床試驗的質(zhì)量和申報審評的效率,以進一步減少抗腫瘤新藥的上市滯后時間�。此外,抗腫瘤新藥研發(fā)難度大�����,對方法學和臨床觀點的審評可能因監(jiān)管機構(gòu)而異�,針對少數(shù)目標患者群體的招募困難、臨床研究設計困難以及復雜的醫(yī)學倫理等問題也可能是這類新藥的上市滯后時長未能進一步下降的原因[34-35]���。
3.4 孤兒藥滯后問題較嚴重�����,現(xiàn)行激勵政策作用不明顯
多元回歸分析的結(jié)果表明�����,中國新藥上市滯后時間的增加與新藥具備“孤兒藥資格認定”有顯著相關性(P≤0.01)�����。雖然過去10年中國采取了如優(yōu)先審評���、減輕增值稅�、減免臨床試驗等一系列激勵政策以加快孤兒藥上市[36-38]�����,但是回歸結(jié)果表明具備孤兒藥資格的新藥上市滯后時長仍會增加���,現(xiàn)有激勵措施對改善孤兒藥上市滯后的作用尚不明顯���。罕見病相關政策以及企業(yè)研發(fā)起步較晚可能是主要原因之一。一方面�,企業(yè)的研發(fā)決策可能是影響孤兒藥上市滯后的一個因素。對于孤兒藥而言�����,罕見病的患病率越低,市場潛力就越低�����,加上高昂的研發(fā)成本���,導致企業(yè)對孤兒藥研發(fā)的積極性不高。在Nakayama等[20]關于日本與美國的孤兒藥滯后研究結(jié)果表明�����,日本與美國之間的孤兒抗癌藥上市滯后中位時長為727d�����,其中上市滯后的主要影響因素是企業(yè)提交審評的時間滯后而非審評過程的時間滯后���,企業(yè)提交審評的時間與企業(yè)與外部合作以及研發(fā)策略相關���。另一方面,雖然中國早在1999年便提出了將孤兒藥納入特殊審批�����,但直到2018年國家衛(wèi)生健康委員會才制定了罕見病種的納入標準和目錄,針對罕見病用藥的法律法規(guī)���、管理規(guī)定及實施辦法仍有待建立���;相比之下,美國�、歐盟和日本分別于1983,1999�,1993年就已建立了相對完善的孤兒藥認定標準、審批監(jiān)管程序以及法律制度[39-40]�����。此外���,中國孤兒藥主要依賴進口�����,本研究中具有國內(nèi)外孤兒藥資格的品種占28.6%�,幾乎全部為進口藥�����,國產(chǎn)孤兒藥數(shù)量為1,加強國內(nèi)企業(yè)的孤兒藥研發(fā)能力同樣是改善孤兒藥上市滯后的關鍵�����。
4�、結(jié)論
本研究表明�����,中國藥品審評審批監(jiān)管改革效果顯著���,過去2011—2021年中國藥物滯后問題得到明顯改善,具體表現(xiàn)為每年批準新藥的數(shù)量上升���、相對藥物滯后中位時長自改革后下降�,但是各個治療領域類型的新藥上市仍存在藥物滯后現(xiàn)象�,包括孤兒藥和生物制品。此外�,提升新藥審評審批的質(zhì)量和效率、加強政府審批機構(gòu)與申報企業(yè)的溝通交流�、對接國際通行規(guī)則、鼓勵企業(yè)開展國際多中心臨床試驗是減少新藥批準上市滯后的重要手段,對于新藥“走進來”或是“走出去”都可能有積極影響�����。
參考文獻
《中國新藥雜志》 2023年第32卷第11期