編者按
光療法因時空可尋址性��、微創(chuàng)性和臨床相對安全性而受到了廣泛關(guān)注��;光療法在生物醫(yī)學(xué)工程中不斷發(fā)展����,以對抗皮膚病以及情緒和睡眠障礙��。由光療劑的非特異性分布導(dǎo)致的靶向效率低是一個必須解決的重要問題�����。
天津大學(xué)常津教授研究團隊在中國工程院院刊《Engineering》2022年第6期發(fā)表《光響應(yīng)納米材料在腫瘤治療領(lǐng)域的應(yīng)用》�����。文章指出光療具有獨特的優(yōu)勢�����,包括微創(chuàng)性和臨床相對安全性�����,所以被認(rèn)為是一種有前途的癌癥治療方法��,但是光療的治療效果往往受到光穿透深度有限和光療劑靶向作用低的限制����。光響應(yīng)納米材料的出現(xiàn)為實現(xiàn)增強的光療效力提供了一種可能的方法����。文章綜述了光響應(yīng)納米材料在癌癥治療中的生物醫(yī)學(xué)應(yīng)用進展,包括光熱療法����、光動力療法、光響應(yīng)分子遞送和光控聯(lián)合療法�����;文章旨在論證光響應(yīng)納米材料在癌癥治療中的重要性,并為擴大光療的應(yīng)用提供策略�����。
一�����、引言
近年來��,光療法因時空可尋址性��、微創(chuàng)性和臨床相對安全性而受到了廣泛關(guān)注�����。早在1903年�����,現(xiàn)代光療法的創(chuàng)始人Niels Ryberg Finsen就因使用陽光和紫外線(UV)輻射治療皮膚?����。▽こ@钳彛┒@得諾貝爾獎。從那時起�����,光療法在生物醫(yī)學(xué)工程中不斷發(fā)展�����,以對抗皮膚?���。ㄈ鐫裾?�、銀屑病和皮膚瘙癢)以及情緒和睡眠障礙(如季節(jié)性情感障礙��、非季節(jié)性抑郁癥和晝夜節(jié)律睡眠障礙)�����。在光治療劑如光敏劑和光熱轉(zhuǎn)換劑(PTCA)的幫助下��,光療法也被證明是消融腫瘤的有效方法�����。
癌癥光療中常用的光源包括紫外線(100~400 nm)����、可見光(400~760 nm)和近紅外(NIR)線(760~1350 nm)。然而����,由于對生物組織的吸收,廣泛使用的紫外線和可見光的組織穿透深度有限��,使得傳統(tǒng)的光療法局限于淺表腫瘤�����,并可能導(dǎo)致腫瘤復(fù)發(fā)和轉(zhuǎn)移��。此外����,由光療劑的非特異性分布導(dǎo)致的靶向效率低是一個必須解決的重要問題。光療劑在治療過程中的非靶向遞送不僅會導(dǎo)致生物利用度低����、療效差����,還會引起副作用����。
隨著納米技術(shù)的發(fā)展����,各種基于多功能納米材料的光療納米制劑已被開發(fā)用于克服上述癌癥光療中的局限性�����。由于增強的滲透和滯留(EPR)效應(yīng)�����,具有特定尺寸范圍(20~200 nm)的納米制劑在腫瘤組織中富集����。因此��,納米材料具有作為載體將光敏劑�����、PTCA、藥物和基因等治療性分子遞送至腫瘤組織��,從而實現(xiàn)靶向治療和聯(lián)合治療的潛力����。為了解決光療中光穿透深度有限的問題,NIR光響應(yīng)納米材料已被開發(fā)應(yīng)用�����。例如����,可以直接吸收NIR光并產(chǎn)生熱量的PTCA已被用于NIR觸發(fā)的光熱治療(PTT)。上轉(zhuǎn)換納米粒子(UCNP)可以吸收長波長的NIR光��,并發(fā)射特定的短波長紫外線或可見光����,以實現(xiàn)更深的穿透。因此�����,光響應(yīng)納米材料提供了克服光療障礙和擴大光療應(yīng)用的可能性。
文章總結(jié)了用于癌癥治療的光響應(yīng)納米材料的最新進展(表1)��。這些納米材料可用于光熱治療�����、光動力療法(PDT)��、光響應(yīng)分子遞送和光控組合療法(圖1)��;還討論了光療法當(dāng)前面臨的挑戰(zhàn)和前景。文章旨在強調(diào)光響應(yīng)納米材料在癌癥光療中的重要作用����,并為進一步擴大其應(yīng)用提供方向����。
表1 光響應(yīng)納米材料在癌癥治療中的應(yīng)用概述
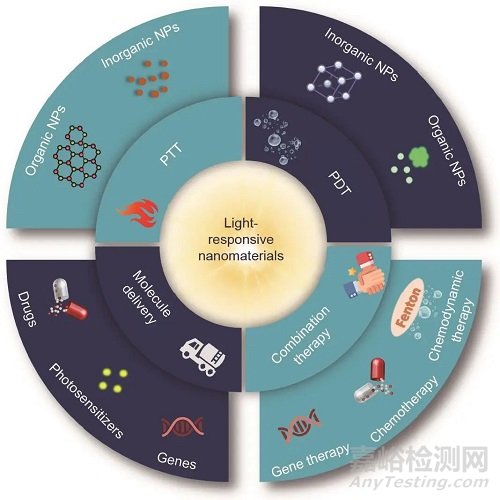
圖1. 光響應(yīng)納米材料在癌癥治療中的應(yīng)用示意圖。
NP:納米粒子�����。
二��、光響應(yīng)納米材料
用于癌癥光療的光響應(yīng)納米材料包括PTCA、納米光敏劑和含有光響應(yīng)部分的納米平臺�����。PTCA是一種可以吸收光能并將其轉(zhuǎn)化為熱量以引發(fā)癌細胞死亡的物質(zhì)��。一般來說����,PTCA可以分為有機材料和無機材料兩大類。常見的有機PTCA材料包括有機染料分子 [如吲哚菁綠(ICG)] 和有機納米顆粒(如半導(dǎo)體聚合物納米顆粒)��。無機PTCA材料包括貴金屬材料 [如金(Au)納米材料]��、過渡金屬硫化物和氧化物 [如硫化銅(CuS)NP] 以及碳基材料(如氧化石墨烯)��。
光敏劑可以被特定波長的光激活����,產(chǎn)生活性氧(ROS),并通過局部氧化應(yīng)激損傷癌細胞�����。光敏劑還分為有機光敏劑和無機光敏劑�����。有機光敏劑包括有機染料分子,如卟啉和吡咯硼(BODIPY)�����;而無機光敏劑包括二氧化鈦(TiO2)�����、氧化鋅(ZnO)�����、石墨氮化碳(g-C3N4)等��。
許多光響應(yīng)納米平臺是通過利用光響應(yīng)連接體設(shè)計和開發(fā)的��,如偶氮苯��。這些納米平臺可作為高效的納米載體����,用以實現(xiàn)光響應(yīng)分子的遞送����。除了通過設(shè)計這種納米平臺來直接響應(yīng)光之外�����,還可以通過級聯(lián)策略進行響應(yīng)����。例如�����,由光熱劑(PTA)和熱敏連接劑組成的納米材料可以對光照射做出響應(yīng)��。此外�����,光誘導(dǎo)的ROS的產(chǎn)生會導(dǎo)致一些化學(xué)鍵的斷裂��,如縮硫酮(TK)鍵��,從而實現(xiàn)光觸發(fā)的藥物釋放�����。
三��、光熱療法
PTT是一種很有前途的治療方法�����,在癌癥治療中具有微創(chuàng)和高治療效果�����。在外部光線的照射下�����,PTCA吸收光能并將其轉(zhuǎn)化為熱量�����,從而殺死癌細胞��。PTCA通常需要具有高NIR吸收和高光熱轉(zhuǎn)換效率��。在過去的幾十年里�����,各種基于納米材料的PTCA��,如金納米材料��、黑磷(BP)��、碳化鈮��、石墨烯����、金屬/非金屬化合物和有機染料,已被開發(fā)用于PTT��。例如�����,El-Sayed等報道了金納米棒(GNR)輔助的等離子體PTT是傳統(tǒng)手術(shù)的潛在且有效的替代方案�����。此外����,GNR輔助的PTT可以通過調(diào)節(jié)和重塑肌動蛋白絲和細胞連接蛋白來減少癌細胞的集體遷移����。De Sio等報道了一種角蛋白涂層仿生金NP(Ker-AuNP)�����,可用作等離子體PTT的高效PTCA����。
Zhang等基于釓(Gd)整合的硫化銅(CuS)NP開發(fā)了一種無機納米診療劑 [Gd∶CuS @牛血清白蛋白(BSA)NP] [圖2(a)]。由于Gd∶CuS N的強NIR吸收和BSA修飾實現(xiàn)了良好的生物相容性�����,因此納米診療劑(Gd∶CuS@BSA NP)可作為一種優(yōu)異的診療劑用于體內(nèi)光聲(PA)/磁共振成像(MRI)指導(dǎo)的高效PTT�����。如圖2(b)所示�����,在NIR激光照射下�����,Gd∶CuS@BSA納米顆粒的溫度明顯升高,表明Gd∶CuS具有良好的光熱效應(yīng)����。此外��,Gd∶CuS@BSA NP在荷瘤小鼠體內(nèi)24 h內(nèi)顯示出PA/MRI成像信號的持續(xù)增強 [圖2(c)]��。雙模態(tài)成像促進了成像引導(dǎo)的光療����,導(dǎo)致有效的腫瘤消除。為了在體外驗證Gd∶CuS@BSA NP的PTT效應(yīng)����,對SK-OV-3細胞進行了細胞毒性研究和活/死細胞共染色。如圖2(d)����、(e)所示,在激光照射下�����,腫瘤細胞的相對存活率明顯降低�����,證明了Gd∶CuS@BSA的腫瘤消融效果。Gd∶CuS@BSA的光熱效應(yīng)也在體內(nèi)得到了證實�����。如實時熱圖像 [圖2(f)]所示��,當(dāng)用Gd∶CuS@BSA NP治療時�����,腫瘤部位的溫度升高了21 ℃��,顯著高于對照組的溫度升高(6 ℃)�����。在NIR激光照射下����,腫瘤顯著消退,隨后被完全消除 [圖2(g)]����,這證明了PTT的顯著腫瘤消融效果�����。
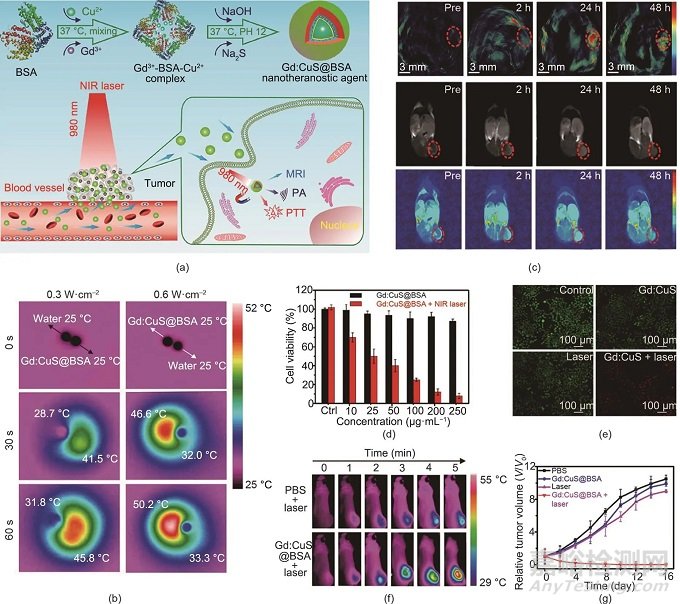
圖2. (a)用于成像引導(dǎo)腫瘤PTT的Gd∶CuS@BSA納米診療劑的示意圖�����。MRI:磁共振成像。(b)用NIR激光照射(980 nm)的Gd∶CuS@BSA NP的水相Gd∶CuS @ BSA NP液滴和去離子水液滴的紅外熱圖像����。(c)在Gd∶CuS@BSA治療前后SK-OV-3腫瘤的PA/MR雙模態(tài)成像。(d)用Gd∶CuS@BSA NP和激光照射(980 nm, 0.6 W?cm-2, 5 min)處理的SK-OV-3細胞的生存率�����。Ctrl:對照組(用0 μg mL-1 Gd∶CuS @ BSA NP處理)��。(e)用不同制劑處理后活/死SK-OV-3細胞的熒光染色�����。(f)注射不同制劑并進行激光照射(980 nm, 5 min)的SK-OV-3腫瘤的體內(nèi)熱成像�����。(g)用不同制劑治療的SK-OV-3腫瘤的生長曲線。經(jīng)American Chemical Society許可����,© 2016。
除了無機納米材料外�����,有機納米制劑在癌癥PTT中也發(fā)揮著重要作用�����。例如��,美國食品藥品監(jiān)督管理局(FDA)批準(zhǔn)的ICG是一種高度生物相容的NIR有機染料�����,由于其在NIR光激發(fā)下的各種能級轉(zhuǎn)換途徑����,已被廣泛應(yīng)用于PTT。此外����,Pu等報道了具有用于增強癌癥治療的NIR光熱效應(yīng)的半導(dǎo)體聚合物納米酶(SPN)����。如圖3(a)所示����,SPN包含作為光熱納米傳感器的半導(dǎo)體兩親性聚合物(PCB)和作為溫度敏感酶的菠蘿蛋白酶(Bro)。在NIR激光照射下�����,由于SPN的光熱轉(zhuǎn)換活性����,局部溫度升高��,導(dǎo)致Bro的光熱激活����。因此,膠原蛋白(腫瘤細胞外基質(zhì)中最豐富的蛋白質(zhì))被原位消解��,導(dǎo)致SPN的腫瘤富集量提升和PTT增強����。在808 nm激光照射下����,PCB1-Bro基團的溫度在體外 [圖3(b)]和體內(nèi) [圖3(c)]均明顯升高����,這證實了PCB1-Bro的高光熱轉(zhuǎn)換效率。此外�����,與沒有激光照射的滲透深度相比�����,用NIR激光照射的PCB1-Bro的滲透深度明顯增加����,表明光熱增強的膠原蛋白消解已經(jīng)發(fā)生。如圖3(d)所示�����,在Bro酶光熱激活后����,PCB1-Bro處理組的腫瘤熒光信號高于其他組����,表明膠原蛋白的消解增強了PCB1-Bro的腫瘤富集����。PCB1-Bro的有效積累進一步導(dǎo)致更高的腫瘤溫度和更強的腫瘤生長抑制 [圖3(c)、(e)]�����。
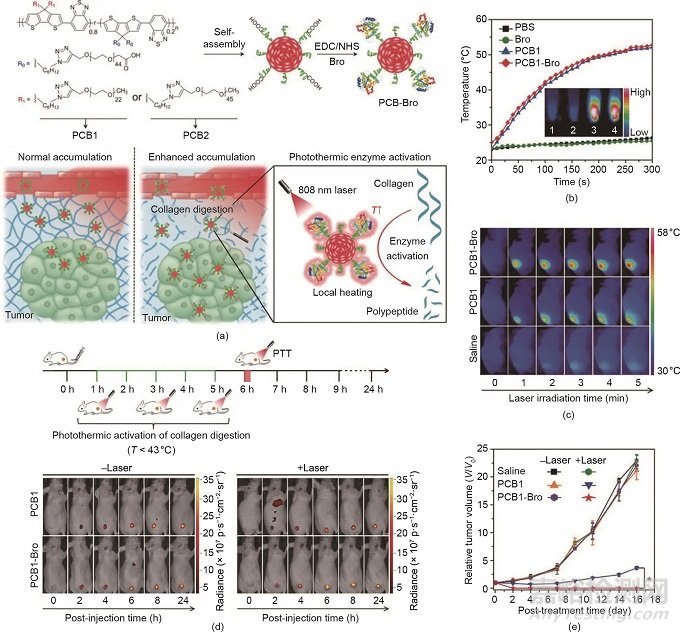
圖3. (a)PCB 1-Bro在光熱增強NP腫瘤中富集的示意圖��。EDC/NHS:1-乙基-3-(3-二甲基氨基丙基)碳二亞胺/N-羥基琥珀酰亞胺��。(b)激光照射時不同樣品的溫度變化�����。(c)用不同制劑和激光照射(808 nm, 5 min)處理的4T1荷瘤小鼠的紅外熱圖像��。(d)用有/無激光照射的不同制劑處理的4T1荷瘤小鼠的實時熒光圖像��。(e)采用不同治療方式的4T1腫瘤的生長曲線�����。經(jīng)Wiley-VCH Verlag GmbH & Co. KGaA許可��,© 2018����。
由于PTT的優(yōu)勢,一些PTCA已經(jīng)進入臨床試驗����。2019年,一期試驗的結(jié)果證明了一種涉及金-二氧化硅納米殼的方法用于前列腺腫瘤的局部PTT消融的可行性�����。此外��,為了進一步提高光穿透深度����,NIR-II光響應(yīng)PTCA越來越受關(guān)注。例如�����,Yang等開發(fā)了一種聚乙二醇接枝聚乙烯亞胺修飾的中空碳納米球用于NIR-II激光激活的癌癥PTT。
四�����、光動力治療
PDT是一種經(jīng)臨床批準(zhǔn)的療法����,用于癌癥(包括淺表皮膚病變、食管腫瘤和肺部腫瘤)治療已有40多年�����。PDT包含三個基本要素:氧氣�����、光敏劑和光����。數(shù)百種光敏劑已在臨床或臨床前被應(yīng)用于PDT����,包括卟啉、二氫卟酚和酞菁衍生物��。在傳統(tǒng)的PDT過程中,光敏劑將光能傳遞給周圍的分子��,以產(chǎn)生用于癌癥治療的細胞毒性ROS�����。有兩種主要類型的光動力反應(yīng)——I型和II型����。在I型反應(yīng)的機理中,三重態(tài)光敏劑通過電子轉(zhuǎn)移直接與細胞底物反應(yīng)�����,從而產(chǎn)生自由基����。然后,生成的自由基與氧氣(O2)反應(yīng)產(chǎn)生氧化產(chǎn)物��,包括超氧陰離子(O2?)�����、過氧化氫(H2O2)和羥基自由基(·OH)����?����;蛘?����,在II型反應(yīng)的機制中����,三重態(tài)光敏劑將能量直接轉(zhuǎn)移到氧(3O2)以產(chǎn)生高反應(yīng)性的單線態(tài)氧(1O2)����。大多數(shù)現(xiàn)有的PDT系統(tǒng)采用氧依賴的II型機制。
與其他常規(guī)治療方法相比����,PDT具有創(chuàng)傷小、操作空間準(zhǔn)確��、副作用小�����、無耐藥性和恢復(fù)期短等優(yōu)點�����。然而��,PDT也有很大的局限性��,包括腫瘤的乏氧狀態(tài)�����、光敏劑的靶向效率低����、光穿透深度有限等。此外��,光敏劑的非特異性分布導(dǎo)致正常組織的光毒性����,這必須加以考慮。由于對生物相容性和分子基序前沿軌道的嚴(yán)格要求��,有效分子光敏劑的選擇仍然有限。為了解決這些問題��,已經(jīng)開發(fā)了許多具有多種特性的新型光敏劑來增強PDT的功效��。例如��,通過連接ROS惰性分子基序�����,已經(jīng)開發(fā)出具有優(yōu)異ROS產(chǎn)生效率的多孔共價有機框架(COF)��。為了增強PDT在深層組織中的效果��,UCNP和光敏劑的組合是一種有效的方法����。Xing等提出了一種通過將UCNP與石墨烯量子點(GQD)整合來實現(xiàn)高效PDT的策略。UCNP可以作為光傳感器將NIR光轉(zhuǎn)化為可見光用于光敏劑的激活����,從而大大擴展了PDT的應(yīng)用。
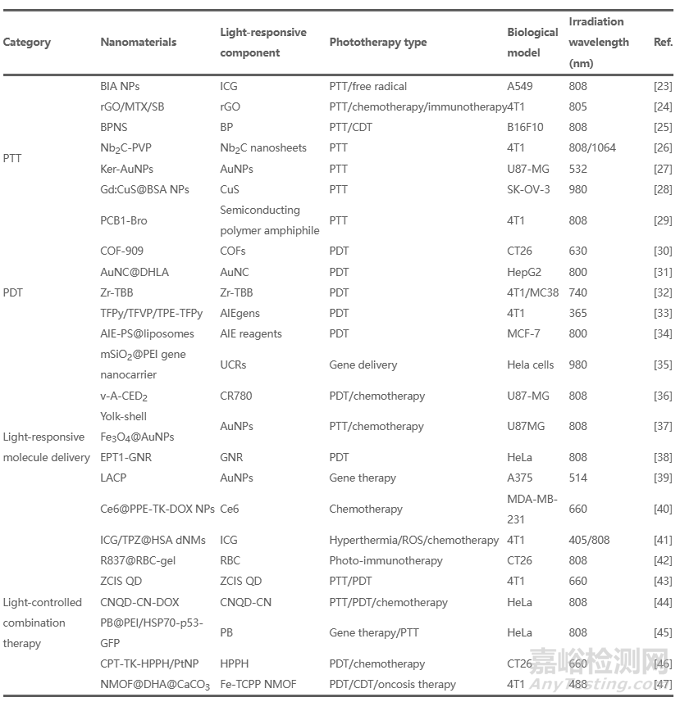
此外����,一些研究表明����,通過I型光反應(yīng)產(chǎn)生的自由基可以放大PDT反應(yīng)����,特別是在乏氧條件下��?�;诖?����,Yoon等報道了一種納米結(jié)構(gòu)酞菁組裝體(NanoPcA)��,這種組裝體通過增強的I型PDT具有良好的抗菌效果�����。Jiang的研究小組開發(fā)了一種I型納米劑�����,即二氫硫辛酸包覆的金納米團簇(AuNC@DHLA)�����,用于雙光子抗癌PDT。在這種納米制劑中��,金納米團簇由于優(yōu)異的生物相容性和長的熒光三重態(tài)壽命而被用作有前途的光敏劑�����。在另一項研究中�����,Lin等道了一種基于5,10,15,20-四(對苯并甲酸)菌綠素(TBB)配體的納米級金屬有機框架(NMOF)��,用于通過I型和II型機制增強PDT [圖4(a)]����。作為一種納米光敏劑,NMOF具有高光敏劑負載效率����、多孔結(jié)構(gòu)和固有生物降解性的獨特性質(zhì)。菌綠素在NIR區(qū)(700~850 nm)具有出色的吸收效果��,可用于乏氧條件下的I型PDT��。然而,菌綠素的PDT功效受到其對氧和光的不穩(wěn)定性的顯著限制����。NMOF的結(jié)構(gòu)有利于穩(wěn)定菌綠素的配體,從而防止單分子光解和自猝滅����。如圖4(b)中的共聚焦激光掃描顯微鏡(CLSM)圖像所示����,Zr-TBB組產(chǎn)生了4種類型的ROS(O2?、H2O2�����、·OH和1O2)�����,證實了光誘導(dǎo)的I型和II型PDT過程的存在����。因此,Zr-TBB對皮下4T1和MC38腫瘤顯示出優(yōu)異的體內(nèi)抗腫瘤功效 [圖4(c)]��。
圖4. (a)用于I型和II型PDT的在Zr-TBB中穩(wěn)定的菌綠素配體示意圖。(b)光照射后用不同配方處理的4T1細胞中ROS生成的CLSM圖像��。比例尺:20 μm��。(c)用不同制劑治療的4T1腫瘤和MC38腫瘤的生長曲線����。經(jīng)American Chemical Society許可,© 2020��。
傳統(tǒng)的光敏劑�����,如卟啉衍生物是疏水性的����,并且傾向于在水溶液中聚集。光敏劑的聚集狀態(tài)導(dǎo)致熒光猝滅����,從而降低ROS的產(chǎn)生效率,并極大地限制PDT治療的結(jié)果��。為了解決這個問題����,Chen等開發(fā)了一種基于卟啉納米籠的單分子納米光敏劑����。由于納米籠的剛性結(jié)構(gòu)����,光敏劑之間的π-π堆積相互作用被抑制,從而促進光敏效應(yīng)��。
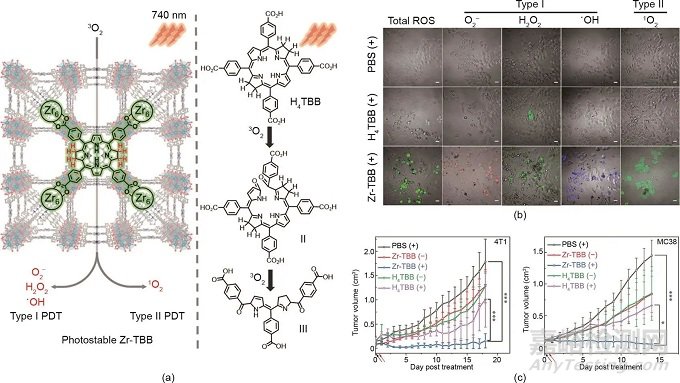
聚集誘導(dǎo)發(fā)射(AIE)光敏劑的發(fā)展為克服傳統(tǒng)光敏劑的猝滅效應(yīng)提供了另一種策略�����。最近����,Tang等提出了一種基于三種聚集誘導(dǎo)發(fā)光體的“1 + 1 + 1 > 3”協(xié)同策略����。AIEgens具有相同的光敏劑骨架,但具有不同的靶向基團��,分別靶向線粒體��、細胞膜和溶酶體 [圖5(a)]。如圖5(b)所示����,在4T1細胞攝取后,這三種AIEgens表現(xiàn)出與相應(yīng)細胞器的良好共定位��。研究發(fā)現(xiàn)協(xié)同治療組的腫瘤抑制效果優(yōu)于每種光敏劑單獨使用的效果����,這歸因于協(xié)同PDT策略 [圖5(c)]。
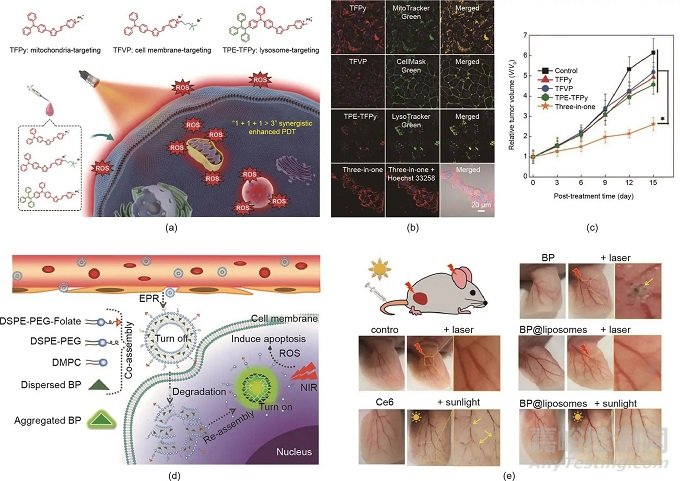
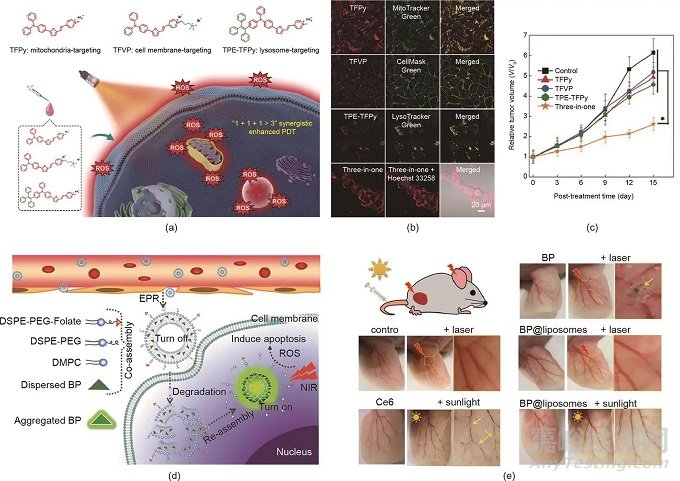
圖5. (a)三種聚集誘導(dǎo)光敏劑的化學(xué)結(jié)構(gòu)和協(xié)同增強PDT的示意圖�����。(b)在用不同制劑處理的4T1細胞的CLSM圖像中AIEgens的共定位��。比例尺:20 μm��。(c)用不同制劑處理的4T1腫瘤的生長曲線����。(d)用于可活化PDT的AIE-PS脂質(zhì)體的示意圖。DSPE-PEG:二硬脂酰磷脂酰乙醇胺聚乙二醇2000��;DMPC:1,2-二肉豆蔻酰-sn-甘油-3-磷酸膽堿。(e)用不同制劑處理的耳朵中的血管��。(a)~(c)經(jīng)Wiley-VCH Verlag GmbH & Co. KGaA許可����,© 2020;(d)�����、(e)經(jīng)American Chemical Society許可����,© 2019。
由于光敏劑的非特異性生物分布��,大多數(shù)光敏劑在患者暴露在陽光下時會引發(fā)光毒性�����。為了降低光毒性��,可活化的PDT是一種有前途的策略����。例如��,Li等開發(fā)了一種載有光敏劑的脂質(zhì)體(AIE-PS@脂質(zhì)體)以實現(xiàn)受控的光敏化。如圖5(d)所示����,包裹在脂質(zhì)雙層中的AIE-PS的光敏性處于“關(guān)閉”狀態(tài);然而��,一旦AIE-PS脂質(zhì)體到達腫瘤部位��,AIE-PS被釋放用于原位再聚集����,導(dǎo)致活化的PDT。正如預(yù)期的那樣����,與對照組 [包括AIE-PS納米聚集體和商業(yè)光敏劑二氫卟吩e6(Ce6)]相比,AIE-PS脂質(zhì)體在激光和日光照射下表現(xiàn)出較低的光毒性 [圖5(e)]�����。
五����、光響應(yīng)分子遞送
癌癥治療中治療劑的低靶向性導(dǎo)致在正常組織中不令人滿意的療效和嚴(yán)重的副作用。隨著刺激響應(yīng)型給藥系統(tǒng)的發(fā)展,越來越多的基于聚合物和無機納米材料的納米載體已被開發(fā)用于實現(xiàn)藥物�����、光敏劑��、基因等的靶向給藥����。作為一種外部刺激,光具有獨特的功能����,用于控制治療劑在精確位置的釋放行為,并避免個體差異�����。例如����,熱響應(yīng)納米材料可以通過光熱誘導(dǎo)的連接鍵斷裂、納米載體的結(jié)構(gòu)變化��、自由基生成和其他途徑實現(xiàn)光觸發(fā)藥物輸送����。光敏劑在光照射下產(chǎn)生的ROS也可以通過觸發(fā)ROS敏感化學(xué)鍵(如TK化學(xué)鍵)的裂解而實現(xiàn)按需給藥。
Liang等開發(fā)了二氮嗪(DA)修飾的人血清白蛋白(HSA)納米藥物(稱為HAS dNM)�����,用于通過靜電和疏水相互作用共同封裝光敏劑(ICG)和前藥替拉扎明(TPZ)[圖6(a)]��。如圖6(b)所示�����,在405 nm激光照射下����,DA基團轉(zhuǎn)化為反應(yīng)性卡賓部分,并與相鄰的HSA dNM反應(yīng)交聯(lián)����,導(dǎo)致ICG/TPZ@HSA dNM在腫瘤部位增強的富集和滯留。接下來�����,808 nm激光照射觸發(fā)了高溫和ROS的產(chǎn)生��,用于腫瘤PTT和PDT。此外�����,PDT過程中的耗氧導(dǎo)致腫瘤乏氧加重和TPZ激活�����,從而實現(xiàn)協(xié)同治療�����。體外和體內(nèi)結(jié)果都證實了HSA dNM的光響應(yīng)遞送。在暴露于405 nm的激光后,具有DA修飾的HSA dNM的尺寸明顯增加 [圖6(c)]�,驗證了紫外線觸發(fā)的聚集行為���。ICG/TPZ@HSA dNM在體內(nèi)的腫瘤富集量由腫瘤與組織的熒光信號比率計算的成像對比指數(shù)(CI)來表示�����。紫外激光治療組的CI值明顯高于沒有激光照射的對照組��,證實了ICG/TPZ@HSA dNM的激光增強腫瘤富集行為 [圖6(d)]���?�;谏锓植紵晒鈭D像,獲得了一致的結(jié)果�����。如圖6(e)所示���,激光治療后腫瘤的熒光強度顯著增加���。這種精心設(shè)計的ICG/TPZ@HSA dNM通過光誘導(dǎo)聚集和級聯(lián)光療/化療,增強了ICG/TPZ的靶向輸送��,提高了抗癌療效�����。
圖6. 用于癌癥治療的光響應(yīng)藥物/光敏劑遞送系統(tǒng)���。
(a)通過激光(405 nm和808 nm)照射觸發(fā)級聯(lián)協(xié)同癌癥治療的ICG/TPZ@HSA dNM示意圖���。CT:化療。(b)ICG/TPZ @ HSA dNM的405 nm激光誘導(dǎo)聚集的方案��。(c)HSA dNM的尺寸隨不同的連續(xù)激光照射時間的變化。(d)ICG/TPZ @ HSA dNM的腫瘤富集�����,由CI值表示�����。(e)ICG/TPZ @ HSA dNM在4T1荷瘤小鼠體內(nèi)的生物分布��。T/N:腫瘤與組織的熒光信號比��;p.i.:注射后���。經(jīng)Wiley-VCH Verlag GmbH & Co. KGaA許可�����,© 2018��。
除了藥物和光敏劑的輸送�����,納米材料還可以用于基因治療中基因表達的光控選擇性激活���。例如�����,光遺傳學(xué)是光學(xué)和遺傳學(xué)方法的結(jié)合,以精確控制特定細胞中蛋白質(zhì)的表達��,從而控制細胞內(nèi)的生物過程和行為�����。與大多數(shù)依賴紫外線/可見光照射的光觸發(fā)遞送系統(tǒng)一樣���,光遺傳學(xué)中光致動器的激活受到光穿透深度的嚴(yán)重限制��。為了解決這個問題���,UCNP可以作為一種納米轉(zhuǎn)換器,將具有較深穿透深度的外部NIR光轉(zhuǎn)化為局部紫外線/可見光��,用于體內(nèi)光感受器的無創(chuàng)激活�����。
Chang等開發(fā)了一種上轉(zhuǎn)換光遺傳納米系統(tǒng),由UCNP��、擬南芥黃素蛋白隱色素2(Cry2)及其相互作用伙伴Cib1質(zhì)粒組成��。UCNP在質(zhì)粒DNA(pDNA)遞送和光轉(zhuǎn)化中都起作用��。外部NIR光觸發(fā)的局部藍光發(fā)射非侵入性地誘導(dǎo)光感受器Cry2和Cib1相互作用���,激活了癌細胞的凋亡信號通路�����。在另一項工作中�����,Chang的研究小組報道了一種基于介孔二氧化硅(mSiO2)@聚乙烯亞胺(PEI)納米載體共軛上轉(zhuǎn)換棒(UCR)的NIR控制基因遞送系統(tǒng) [圖7(a)]��。在NIR光照射下��,外部NIR光被UCR轉(zhuǎn)化為紫外線��,從而引發(fā)鄰硝基芐基的裂解 [圖7(b)]���。隨后��,載有基因的mSiO2@PEI納米載體被釋放用于基因遞送 [圖7(c)]�����。這項基因表達研究報告了基因在NIR光照射下被釋放和表達�����,證實了在高空間和時間分辨率下光控精確調(diào)節(jié)的基因表達已經(jīng)實現(xiàn)。
圖7. 光響應(yīng)基因的遞送和表達��。
(a)mSiO2@PEI基因納米載體和UCR底物的合成步驟���。APTES:3-氨丙基三乙氧基硅烷��;TEOS:原硅酸四乙酯���;PPA:聚丙烯酸。(b)由于鄰硝基芐基的光裂解�����,mSiO2@PEI基因納米載體從UCR底物的光觸發(fā)釋放的示意圖。(c)在有或沒有NIR激光(980 nm, 8.9 W·cm-2, 12 min)的情況下���,用負載羅丹明的mSiO2@PEI納米載體固定的基質(zhì)的熒光圖像�����。經(jīng)Wiley-VCH Verlag GmbH & Co. KGaA許可�����,© 2015���。
六、光控聯(lián)合療法
雖然近年來光療技術(shù)得到了發(fā)展��,但單一模式光療(僅依賴于一種治療方法)的一些缺點仍有待解決���,如治療持續(xù)性腫瘤的復(fù)發(fā)或轉(zhuǎn)移�����。為了解決這一問題���,將光療與免疫療法、基因療法、化學(xué)療法���、化學(xué)動力學(xué)療法(CDT)和其他治療方法相結(jié)合�����,可以最大程度地發(fā)揮每種治療模式的優(yōu)勢���,實現(xiàn)互補的多模式治療效果。
光免疫療法可以消除原發(fā)性腫瘤并誘導(dǎo)宿主免疫以控制遠處轉(zhuǎn)移��,被認(rèn)為是治療轉(zhuǎn)移性癌癥的一種有前途的策略�����。例如�����,Wang等開發(fā)了一種用于癌癥光免疫療法的基于可注射紅細胞(RBC)的凝膠���。在皮下注射咪喹莫特(R837)佐劑工程化紅細胞后,由于滲透的血小板和凝血酶���,自發(fā)形成水凝膠樣組合物���。原位形成的RBC凝膠的光熱效應(yīng)導(dǎo)致腫瘤的光消融和腫瘤相關(guān)抗原的產(chǎn)生�����,從而啟動對癌癥的適應(yīng)性免疫反應(yīng)���。此外,釋放的免疫佐劑R837可誘導(dǎo)強大且持久的免疫反應(yīng)���,以抑制癌癥轉(zhuǎn)移/復(fù)發(fā)�����。
Liang的研究小組開發(fā)了一種基于CuInS/ZnS(ZCIS)量子點(QD)的“一體化”納米藥物��,用于PTT/PDT協(xié)同治療�����。量子點因其高熒光強度和寬激發(fā)光譜而被廣泛用于腫瘤診斷和治療���。ZCIS量子點在650~750 nm范圍內(nèi)的高吸收效應(yīng)使得無創(chuàng)熒光/多光譜光學(xué)層析成像成為可能���。此外,ZCIS量子點的光熱和光動力效應(yīng)可用于癌癥治療 [圖8(a)]���。
圖8. 光控組合癌癥療法�����。
(a)在PTT和PDT的組合治療中ZCIS QD的示意圖�����。FL:熒光��;MSOT:多光譜光聲層析成像:US:超聲波���;?T:溫度升高。(b)基因治療和PDT聯(lián)合治療中PB@PEI/HSP70‐p53‐GFP NP的示意圖���。(c)MPEG-(TK-CPT)-PPa在化療和PDT聯(lián)合治療中的示意圖。(a)經(jīng)American Chemical Society許可���,© 2016��;(b)經(jīng)Wiley-VCH Verlag GmbH & Co. KGaA許可��,© 2018���;(c)經(jīng)Wiley-VCH Verlag GmbH & Co. KGaA許可��,© 2020��;(d)經(jīng)Wiley-VCH Verlag GmbH & Co. KGaA許可�����,© 2019�����。
Chang等報道了一種基于人類HSP70啟動子的普魯士藍(PB)納米立方體的多功能納米治療劑(PB@PEI/HSP70-p53-GFP NP)���,用于NIR光觸發(fā)的PTT/基因聯(lián)合治療。如圖8(b)所示���,由于PB納米立方體的光熱特性�����,HSP70啟動子在溫和的NIR激光(約41 ℃)照射下被激活�����,導(dǎo)致腫瘤抑制因子p53依賴性細胞凋亡�����。在強NIR激光照射下(約50 ℃)�����,PTT和基因治療都被激活�����。因此��,協(xié)同抗腫瘤功效可以通過NIR激光照射來調(diào)節(jié)��。
化療與光療相結(jié)合是實現(xiàn)協(xié)同治療的另一個重要途徑�����。Qian等開發(fā)了一種ROS反應(yīng)性前藥遞送納米平臺���,用于化療和PDT的組合��。如圖8(c)所示�����,化療藥物喜樹堿(CPT)和光敏劑焦脫鎂葉綠素-a(PPa)與甲氧基聚乙二醇(MPEG)連接制備聚合物前藥���,進一步自組裝成納米藥物。熒光PPa精確定位腫瘤部位并引導(dǎo)激光照射���。接下來�����,由PPa介導(dǎo)的PDT過程產(chǎn)生的ROS破壞了聚合物和CPT之間的ROS響應(yīng)TK鍵��,導(dǎo)致CPT藥物的受控釋放���。這種化學(xué)療法和PDT的組合表現(xiàn)出比單一療法更有效的抗腫瘤作用。
與PDT類似���,CDT涉及產(chǎn)生用于腫瘤治療的高氧化性羥基自由基���。Tang等基于負載DHA的鐵(Fe)-[4,4,4,4-(卟吩-5,10,15,20-四?��;┧模ū郊姿幔(TCPP)NMOF和CaCO3礦化涂層構(gòu)建了程序釋放系統(tǒng) [NMOF @雙氫青蒿素(DHA)@碳酸鈣(CaCO3)] [圖8(d)]。腫瘤微環(huán)境的弱酸性導(dǎo)致CaCO3層溶解及Ca2+釋放���。一旦NMOF@DHA進入癌細胞��,細胞內(nèi)的高谷胱甘肽(GSH)水平導(dǎo)致Fe3+還原和TCPP活化�����;這是由NMOF骨架崩潰導(dǎo)致的�����。因此��,NMOF@DHA@CaCO3能夠?qū)崿F(xiàn)Ca2+-DHA介導(dǎo)的腫瘤治療��、Fe2+-DHA介導(dǎo)的CDT和TCPP介導(dǎo)的PDT�����。
七��、結(jié)論和未來展望
光誘導(dǎo)光療由于微創(chuàng)性和輕微副作用而被廣泛用于對抗癌癥�����。然而�����,光療的功效受到光穿透深度和光療劑非靶向分布的限制��。光響應(yīng)納米材料的出現(xiàn)為解決這些問題提供了一種有前途的方法�����,因為這種納米材料具有特殊的性質(zhì)�����,包括納米尺寸��、多功能表面修飾和可控合成���。因此,通過光響應(yīng)納米材料的合理設(shè)計,增強了光療效果�����。
文章綜述了近年來用于癌癥治療的光響應(yīng)納米材料的研究進展���,包括PTT���、PDT、光響應(yīng)分子遞送和光控聯(lián)合治療��。要實現(xiàn)精準(zhǔn)的癌癥光療�����,加速臨床轉(zhuǎn)化��,應(yīng)考慮以下幾個方面�����。
(1)光穿透深度的限制�����。光的穿透深度依賴于光的波長。紫外線和可見光由于有限的穿透深度而主要用于治療淺表性皮膚病��。此外���,當(dāng)光與組織相互作用時�����,光在很大程度上出現(xiàn)衰減,阻礙了光療的應(yīng)用���,特別是在治療深層組織腫瘤中��。雖然碳納米管的應(yīng)用提供了一種增加光穿透深度的方法���,但碳納米管仍然具有轉(zhuǎn)換效率低的缺點。與NIR-I窗口(750~1000 nm)相比��,NIR-II窗口(1000~1350 nm)表現(xiàn)出較低的光散射��、最小化的組織吸收和更高的最大允許激光暴露��;因此��,NIR-II窗口似乎是實現(xiàn)深層組織穿透深度的潛在候選。因此��,NIR響應(yīng)納米材料在擴大光療應(yīng)用方面顯示出巨大的潛力��。
(2)潛在毒性風(fēng)險���。在光療的光觸發(fā)分子遞送過程中���,藥物從納米載體中不受控制地爆發(fā)式釋放會導(dǎo)致短期毒性,而納米材料緩慢和不完全代謝可能會導(dǎo)致長期毒性��。此外�����,光響應(yīng)納米治療劑的非靶向生物分布可能導(dǎo)致陽光照射誘導(dǎo)的全身毒性�����。為了實現(xiàn)精確可控的癌癥光療���,理想的納米藥物應(yīng)該只在腫瘤部位被激活���,在正常組織中應(yīng)該保持“關(guān)閉”狀態(tài)���。因此,開發(fā)能夠響應(yīng)腫瘤微環(huán)境的典型特征的可活化的光治療劑是解決光毒性問題的有效方法���。
(3)臨床轉(zhuǎn)化��。為了實現(xiàn)多功能癌癥治療�����,納米材料通常在設(shè)計和組成上都很復(fù)雜,這無疑給臨床轉(zhuǎn)化帶來了困難�����。此外��,由于一些新開發(fā)的納米材料的未知毒性機制���,這些納米材料的臨床應(yīng)用需要復(fù)雜的毒性評估程序���。
改編原文:
Xu Zhang, Sheng Wang, Guohui Cheng, Peng Yu, Jin Chang. Light-Responsive Nanomaterials for Cancer Therapy [J]. Engineering,2022,13:18?30.