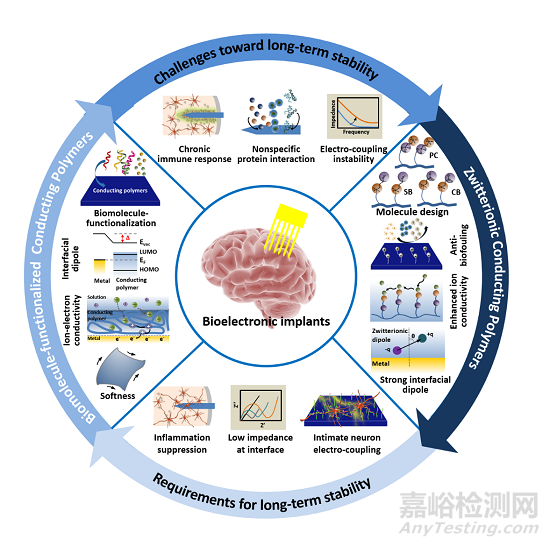
近期�,上海大學(xué)朱波教授和東華大學(xué)何勇教授在科愛創(chuàng)辦的期刊Bioactive Materials上聯(lián)合發(fā)表綜述文章:用于生物電子親密電耦合且抗炎癥反應(yīng)的功能化導(dǎo)電高分子的最新進(jìn)展�。本文從導(dǎo)電高分子在生物電子器件領(lǐng)域的重要優(yōu)勢(shì):具有優(yōu)異的混合離子-電子導(dǎo)電性,可調(diào)諧的金屬界面勢(shì)壘�,組織匹配的柔軟性以及可化學(xué)改性出發(fā)�,詳細(xì)總結(jié)了化學(xué)改性的導(dǎo)電高分子在制造長期生物電子植入物�,解決慢性免疫反應(yīng)方面的研究進(jìn)展�,并指出化學(xué)改性的導(dǎo)電高分子與神經(jīng)元的相互作用弱以及在長期電通信穩(wěn)定性差的問題�。進(jìn)而�,重點(diǎn)介紹了兩性離子導(dǎo)電高分子在生物電子植入器件中的應(yīng)用進(jìn)展�,并對(duì)其在選擇性神經(jīng)偶聯(lián)和可再植入功能方面的進(jìn)展進(jìn)行了綜述�。最后�,對(duì)兩性離子導(dǎo)電高分子在體內(nèi)生物電子器件中的應(yīng)用前景進(jìn)行了展望�。
研究內(nèi)容簡介
生物電子植入器件已廣泛應(yīng)用于神經(jīng)假體、腦機(jī)接口和其他生物集成設(shè)備來進(jìn)行檢測(cè)和記錄生物信號(hào)�。然而目前商業(yè)植入電極�,由金屬或硅制成�,這些材料的剛性性質(zhì)�,使得電極和組織之間的機(jī)械性能不匹配�,導(dǎo)致異物反應(yīng)甚至器件故障�。且這些電極材料的表面可能通過非特異性相互作用吸附蛋白質(zhì)�,觸發(fā)異物反應(yīng)�。此外�,這類材料表現(xiàn)為化學(xué)惰性,難以與生物分子之間形成穩(wěn)定的相互作用�。
導(dǎo)電高分子(CPs)具有優(yōu)于無機(jī)材料和金屬材料的優(yōu)點(diǎn):1.CPs的彈性模量遠(yuǎn)低于無機(jī)材料和金屬材料,從而最大限度地減少了機(jī)械失配�,減少了設(shè)備-組織界面處的應(yīng)力集中。2.將CPs涂覆在電極上�,通過顯著降低整體設(shè)備阻抗,顯著改善了體外和體內(nèi)組織記錄部位的電偶聯(lián)�。且CP電極由于其巨大的體積電容�,為生物安全刺激也提供了高電荷存儲(chǔ)和注入能力�。3.生物分子改性的CPs能夠增強(qiáng)與神經(jīng)元界面的相互作用并減少炎癥反應(yīng)�。然而�,生物分子的表面修飾通常不能解決非特異性蛋白質(zhì)吸附問題�。這將增加界面阻抗,甚至引發(fā)免疫反應(yīng)�。
最近�,兩性離子CPs在減少非特異性細(xì)胞/蛋白質(zhì)相互作用方面表現(xiàn)突出�,并能在低阻抗下實(shí)現(xiàn)與細(xì)胞/組織有效電通信�。兩性離子CPs除了具有CPs的混合離子-電子電導(dǎo)率外,其兩性離子成分還增強(qiáng)的離子電導(dǎo)率和金屬-導(dǎo)電高分子的電偶聯(lián)�,進(jìn)一步促進(jìn)電極與細(xì)胞/組織之間的電荷轉(zhuǎn)移。兩性離子CPs與其他親水性CPs相比�,在防污�、水穩(wěn)定性�、低炎癥和電化學(xué)性能方面也具有優(yōu)勢(shì)�,并已廣泛應(yīng)用于體內(nèi)和體外生物電子器件中�。此外�,兩性離子CPs可以通過耦合的細(xì)胞識(shí)別分子為細(xì)胞提供附著點(diǎn)。鑒于這些優(yōu)勢(shì)�,兩性離子CPs有望解決上述導(dǎo)電高分子的局限性�。
圖1. 本綜述的思路
一、生物電子器件用CPs
CPs由于具有柔軟性�、優(yōu)異的電化學(xué)特性和可表面生物功能修飾被認(rèn)為是下一代人工耳蝸植入物�、神經(jīng)探針、仿生眼和腦機(jī)接口的替代材料�。
1.1 CPs的生物相容性和柔性
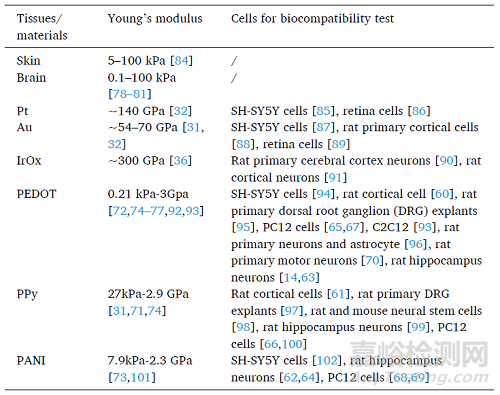
電子材料的生物相容性是生物電子植入物在復(fù)雜生物條件下發(fā)揮作用的關(guān)鍵因素之一�。CPs已被證實(shí)與神經(jīng)細(xì)胞系兼容,如皮質(zhì)細(xì)胞�、海馬神經(jīng)元�、PC12細(xì)胞和運(yùn)動(dòng)神經(jīng)元等。此外�,由于CPs的彈性模量比較小�,用作可植入電極的涂層可以作為軟組織和硬質(zhì)金屬之間的緩沖層�,顯著降低神經(jīng)植入物的界面機(jī)械應(yīng)力�,顯著提高可植入裝置的性能和壽命�。
表1 總結(jié)了導(dǎo)電材料的楊氏模量和生物相容性
1.2 CPs的電學(xué)性能
1.2.1 CPs的混合離子-電子電導(dǎo)率
CPs同時(shí)傳導(dǎo)離子和電子載流子,從而使得CPs具有較高的離子電導(dǎo)率和電容�。生物電子器件的電荷傳輸主要涉及四個(gè)過程:1.CP/電解質(zhì)界面的摻雜離子傳輸�,2.CP內(nèi)部通過摻雜離子(陰離子)來平衡電子載流子(空穴)�,3.電子載流子跳躍�,4.金屬電極與CP之間的電荷轉(zhuǎn)移�。在電荷輸運(yùn)過程中,離子與電子傳導(dǎo)的相互作用對(duì)導(dǎo)電高分子器件的運(yùn)行起著至關(guān)重要的作用�。因此,在電子和離子電導(dǎo)率之間進(jìn)行權(quán)衡通常是優(yōu)化電子器件性能所必需的�。本綜述僅簡要介紹了CPs的離子-電子相互作用和耦合輸運(yùn)性質(zhì),以幫助讀者理解CP的導(dǎo)電性�。
1.2.2 CPs的低阻抗性能
為了使神經(jīng)電極具有高信噪比和高空間分辨率,需要小尺寸和低阻抗的電極�。在神經(jīng)電極上沉積CPs可實(shí)現(xiàn)小尺寸微電極具有大的電極電容和低的阻抗。許多研究證實(shí)�,與IrOx、鉑�、金和ITO等傳統(tǒng)電極材料相比�,CPs在1 kHz時(shí)的電化學(xué)阻抗要低得多。當(dāng)CPs作為神經(jīng)電極時(shí)�,它們的低阻抗抑制了電噪聲�,減少了信號(hào)損失�,產(chǎn)生更明顯的神經(jīng)網(wǎng)絡(luò)反應(yīng)。CPs阻抗的大幅降低主要?dú)w功于其獨(dú)特的混合離子-電子導(dǎo)電性�,這有助于電極襯底和電解質(zhì)之間的電耦合,促進(jìn)離子或電子載流子的界面交換�。
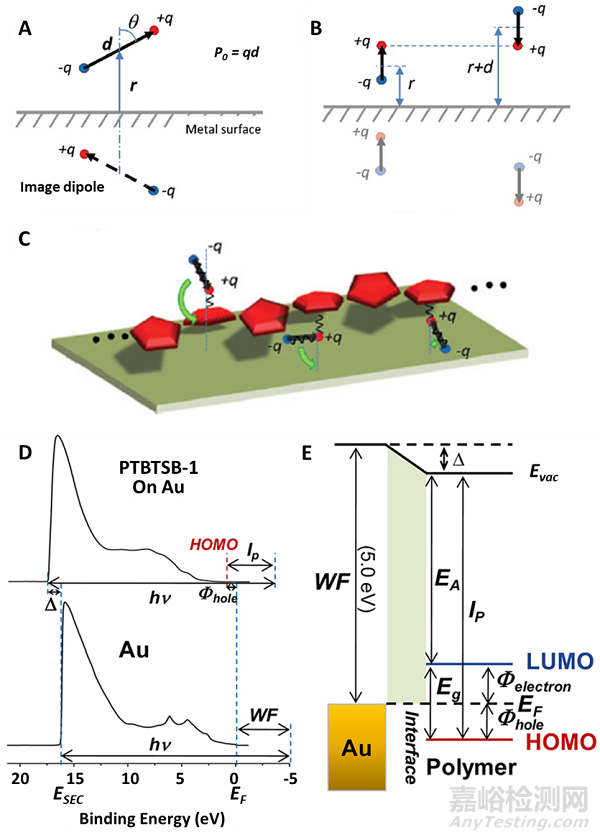
1.2.3金屬-導(dǎo)電高分子的界面作用
CPs與金屬的界面對(duì)CPs電極至關(guān)重要,因?yàn)樗鼪Q定了CPs與金屬的接觸是歐姆接觸還是整流接觸�。金屬和半導(dǎo)體層之間良好的歐姆接觸對(duì)于通過界面注入高密度電流和制造高性能半導(dǎo)體器件至關(guān)重要。CP和金屬的功函數(shù)的差異在它們之間建立了熱力學(xué)平衡和界面勢(shì)壘(肖特基勢(shì)壘)。p型CPs可以幫助實(shí)現(xiàn)與高功函數(shù)金屬的歐姆接觸�。并且通過改變CPs的化學(xué)結(jié)構(gòu)來降低界面勢(shì)壘。此外�,增加p型CPs的摻雜水平可以進(jìn)一步有利于CPs與金屬之間形成良好的歐姆接觸�。此外�,金屬和CPs在遇到水分子時(shí)會(huì)改變它們的功函數(shù)�。因此�,仍然需要進(jìn)一步地研究水對(duì)CP/金屬界面的影響�。
1.3 生物功能化CPs
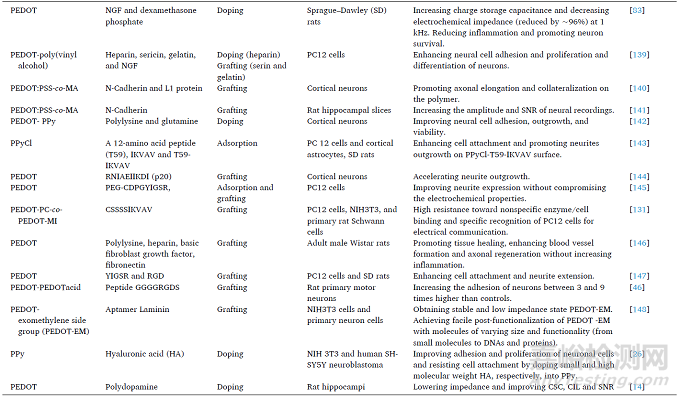
在生物系統(tǒng)中工作時(shí)�,電極的性能經(jīng)常隨著時(shí)間的推移而下降�,其主要與植入物誘導(dǎo)的炎癥反應(yīng)有關(guān)。異物反應(yīng)可能造成神經(jīng)膠質(zhì)瘢痕形成�,導(dǎo)致神經(jīng)探針周圍形成致密的細(xì)胞鞘�,并將電極與附近的神經(jīng)元隔離開來�。在這種情況下,從電極到神經(jīng)細(xì)胞/組織的電荷轉(zhuǎn)移將受到阻礙�,導(dǎo)致記錄電信號(hào)的強(qiáng)度減弱和質(zhì)量降低。在目標(biāo)神經(jīng)元和電極之間建立選擇性相互作用可以抑制組織反應(yīng)�,從而可以提高記錄質(zhì)量和慢性電極性能。將生物分子與CPs結(jié)合在一起�,可以保證電極與神經(jīng)元之間的緊密電偶聯(lián)�,促進(jìn)神經(jīng)元的增殖和分化�,提高神經(jīng)記錄的質(zhì)量�。目前,神經(jīng)營養(yǎng)因子�、細(xì)胞粘附生物分子(聚賴氨酸�、鈣粘蛋白�、YIGSR和IKVAV多肽)以及其他一些親水性生物分子,如透明質(zhì)酸�、硫酸軟骨素和硫酸葡聚糖等已廣泛應(yīng)用于CPs神經(jīng)電極。
表2 總結(jié)了生物功能化CPs的相關(guān)研究成果
雖然生物功能化方法可以有效地增強(qiáng)CPs與神經(jīng)元的相互作用�,但在生物功能化CPs植入器件植入后仍然誘導(dǎo)炎癥反應(yīng)。因此�,常采用抗炎藥摻雜到CPs中來減輕早期植入器件的炎癥反應(yīng)。
1.4生物功能化導(dǎo)電聚合物的挑戰(zhàn)
生物功能化CPs作為植入式材料仍有幾個(gè)關(guān)鍵性問題尚未解決�。
首先,制備生物分子功能化CPs的方法存在局限性�。物理吸附和分子包埋的方法無法控制生物分子的數(shù)量?;瘜W(xué)偶聯(lián)的方法會(huì)使得CPs的導(dǎo)電性受到損害�,生物分子的活性也可能會(huì)在化學(xué)反應(yīng)中受損�。
其次,雖然生物分子修飾方法可以提高CPs電極的生物相容性�,但可能會(huì)影響CPs的機(jī)械、電化學(xué)�、穩(wěn)定性和生物學(xué)特性。
此外,生物分子功能化的CPs不能阻止長期植入的膠質(zhì)瘢痕的形成�。
二�、生物電子器件用兩性離子CPs
2.1兩性離子CPs
防污CPs具有抵抗非特異性蛋白質(zhì)/細(xì)胞相互作用和抑制免疫反應(yīng)的潛力�。這些防污CPs的共同結(jié)構(gòu)特征是它們接枝親水性基團(tuán)或聚合物�。根據(jù)化學(xué)結(jié)構(gòu)的不同,開發(fā)了三種主要的生物電子防污CPs�。第一種是低聚乙二醇(OEG)或聚乙二醇(PEG)功能化CPs�,它們是最早報(bào)道的防污CPs�。第二種是兩性離子功能化的CPs,它們由兩性離子基團(tuán)或具有相同數(shù)量的相反電荷基團(tuán)的聚合物鏈接枝�。兩性離子基團(tuán)和兩性離子聚合物通常具有很強(qiáng)的親水性和中性電荷�,這有助于CPs阻止蛋白質(zhì)/細(xì)胞通過非特異性相互作用(包括疏水-疏水�,靜電�,偶極-偶極或范德華相互作用)接近其表面�。第三種是親水生物分子修飾的CPs�,如親水肽和植酸也被用于功能化具有防污性能的CPs。
PEG或OEG功能化的CPs易受氧化降解�,而且具有免疫原性,不適用于長期植入器件�。研究表明兩性離子聚合物在化學(xué)上更穩(wěn)定�,防污性能更優(yōu)越。其中磷酸膽堿(PC)�、磺胺甜菜堿(SB)和羧基甜菜堿(CB)是最常用的用于CPs功能化的兩性離子�。本綜述我們重點(diǎn)研究了兩性離子CPs的合成、性質(zhì)及其生物電子應(yīng)用�。
2.2兩性離子導(dǎo)電聚合物的防污性能
2.2.1兩性離子的水合作用
防污界面的水合作用對(duì)細(xì)胞/蛋白質(zhì)的抗性至關(guān)重要�。兩性離子修飾界面上形成的水化層來源于離子相互作用�。這使得水化層比在PEG/OEG修飾的界面上形成的水化層更加致密和穩(wěn)定??拷鼉尚噪x子表面的水分子的遷移率降低,偶極子取向分布更寬�,停留時(shí)間更長�。因此,兩性離子聚合物強(qiáng)烈排斥蛋白質(zhì)的非特異性吸附。
2.2.2 pH�、間隔長度、組成�、化學(xué)結(jié)構(gòu)效應(yīng)
三種常用兩性離子CPs都有相同的帶正電的單位�,即銨基�,但帶負(fù)電的結(jié)構(gòu)單元不同�。它們帶負(fù)電單元的不同會(huì)導(dǎo)致不同的表面電荷,從而在相同的酸環(huán)境下產(chǎn)生不同的防污性能�。此外�,由于兩性離子結(jié)構(gòu)的不同,其陰陽離子的電荷密度也不同�,從而會(huì)影響兩性離子的自締合性�,影響其結(jié)構(gòu)的穩(wěn)定性�。兩性離子中兩個(gè)帶相反電荷基團(tuán)之間的距離也會(huì)影響兩性離子聚合物的防污性能。聚合物組成對(duì)CPs抵抗蛋白質(zhì)/細(xì)胞粘附性能也會(huì)產(chǎn)生比較大的影響�。
2.3 兩性離子導(dǎo)電聚合物的低阻抗
2.3.1離子電導(dǎo)率增強(qiáng)
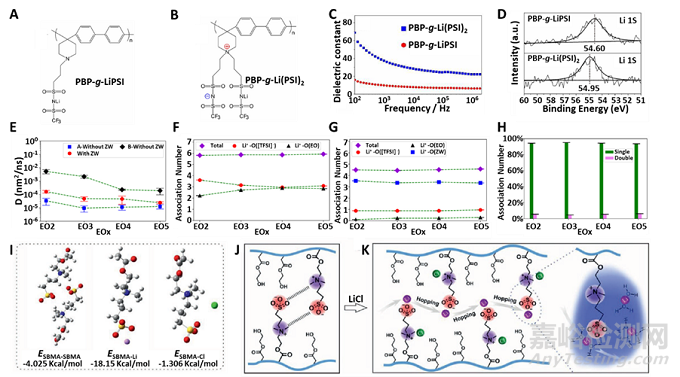
對(duì)于生物電子植入物,電極的低阻抗是確保其與細(xì)胞/組織有效電偶聯(lián)的關(guān)鍵�。高阻抗通常會(huì)導(dǎo)致神經(jīng)記錄中的噪聲增加和信號(hào)丟失�。此外�,植入器件需要具備高CSC和CIC從而防止組織/細(xì)胞在高電位下被電化學(xué)副反應(yīng)損傷�。研究表明,兩性離子功能化的CPs�,其阻抗與未功能化的導(dǎo)電高分子相同或者甚至更低。其可能的原因是兩性離子增強(qiáng)了離子電導(dǎo)率�。此外,兩性離子修飾的CPs電極�,其CSC和CIC值高于OEG功能化的CPs電極�。這應(yīng)該是由于與非離子低聚物(乙二醇)相比�,兩性離子促進(jìn)了離子的解離和運(yùn)輸。
圖1. 兩性離子增強(qiáng)離子電導(dǎo)率
2.3.2金屬與兩性離子CPs的界面
兩性離子CPs涂層電極由多層結(jié)構(gòu)組成,其中兩性離子聚合物直接與金屬接觸�,并作為金屬和水性緩沖液之間的界面層�。兩性離子不能遷移�,在金屬附近表現(xiàn)出很強(qiáng)的偶極子。當(dāng)在金屬表面涂覆一層兩性離子共軛聚合物時(shí)�,由于界面偶極子的存在�,兩性離子懸垂的基團(tuán)會(huì)顯著改變金屬電極的功函數(shù)�。
圖2. 兩性離子CPs改變金屬電極的功函數(shù)
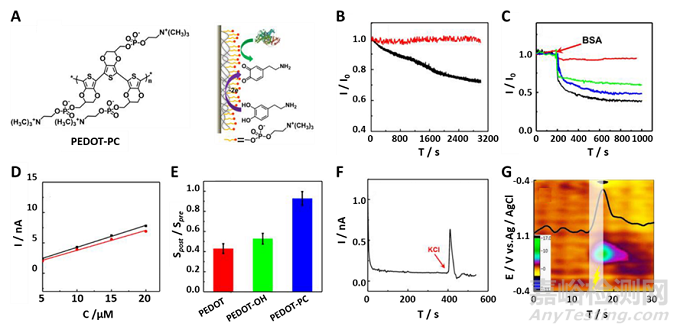
2.3.3兩性離子結(jié)構(gòu)及間隔長度
對(duì)于兩性離子CPs來說�,兩性離子結(jié)構(gòu)以及主鏈與兩性離子之間的間隔對(duì)兩性離子CPs的電化學(xué)性能起著至關(guān)重要的作用。研究發(fā)現(xiàn)�,PC功能化的PEDOT與SB�、CB修飾的PEDOT相比具有最低的阻抗和最高的電容�。此外,增加兩性離子與主鏈間的間隔�,并不會(huì)影響兩性離子CPs抵抗蛋白的粘附能力�。然而�,隨著間隔的增加,CPs的界面阻抗顯著降低�。
2.4兩性離子CPs的生物電子學(xué)應(yīng)用
賦予植入器件防污性能是減少植入物誘導(dǎo)炎癥的有效方法。許多研究證實(shí)兩性離子聚合物涂層可以顯著提高種植入器件的抗炎癥�、抗感染和抗增生性能。
兩性離子CPs制備的電極具有低阻抗�、大電荷存儲(chǔ)容量和高電荷注入能力,植入后能很好地保持良好的靈敏度和反應(yīng)率�,并在植入后電極可以抑制疤痕組織形成。這些結(jié)果為兩性離子CPs在生物電子植入物中的應(yīng)用提供了廣闊的前景�??寡装Y和低阻抗的獨(dú)特結(jié)合使兩性離子導(dǎo)電聚合物有望成為長期的生物電子植入物�。
圖3. PEDOT-PC/碳纖維微電極植入后保持高檢測(cè)靈敏度
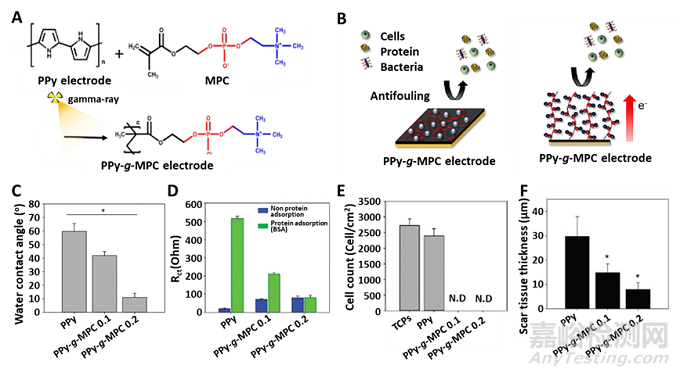
圖4. 2-甲基丙烯酰氧乙基磷酸膽堿(MPC)修飾的PPy電極實(shí)現(xiàn)抗非特異性黏附及抑制疤痕組織
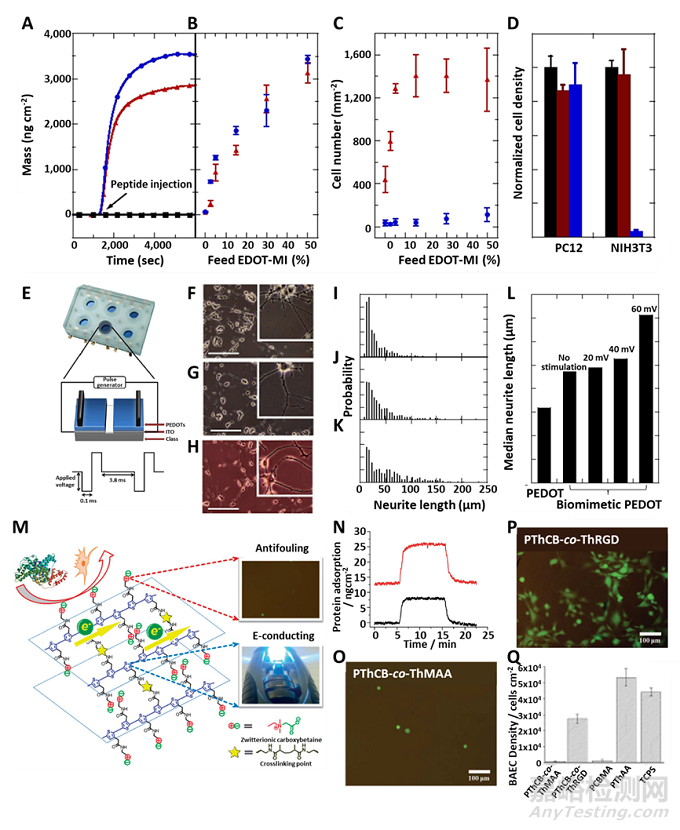
此外�,通過在兩性離子CPs上構(gòu)建神經(jīng)細(xì)胞/組織耦合位點(diǎn)�,能夠?qū)崿F(xiàn)電極與生物分子或神經(jīng)細(xì)胞/組織相互作用,同時(shí)保持兩性離子電極的防污特性�。兩性離子CPs與神經(jīng)特異性肽結(jié)合能夠?qū)崿F(xiàn)與神經(jīng)元穩(wěn)定而密切的相互作用�。
圖5. IKVAV多肽與兩性離子CPs結(jié)合實(shí)現(xiàn)與神經(jīng)細(xì)胞的特異性粘附
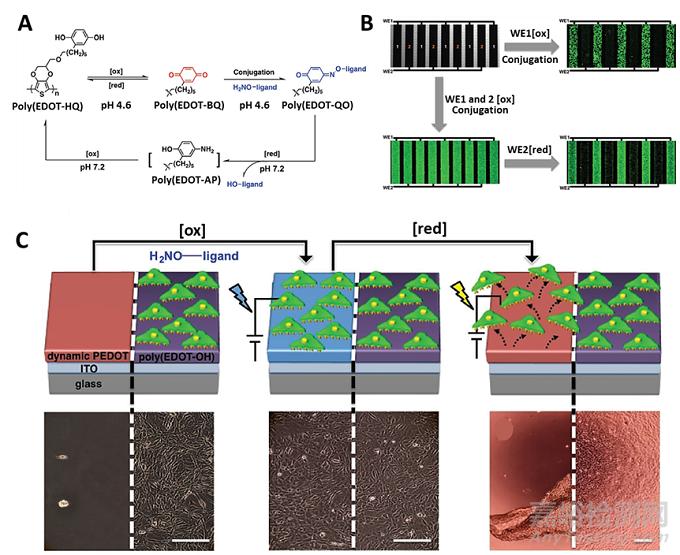
目前�,臨床實(shí)驗(yàn)中�,植入器件停止功能或治療完成后,往往面臨著重新植入或移除的問題�。然而,器件的再植入比最初的植入更復(fù)雜�,因?yàn)榈诙问中g(shù)可能會(huì)導(dǎo)致組織損傷�,并削弱再植入后的身體功能。研究者通過模擬自然界整合素-細(xì)胞外基質(zhì)的動(dòng)態(tài)相互作用�,開發(fā)了一種動(dòng)態(tài)兩性離子EDOT共聚物�,可實(shí)現(xiàn)可控地控制細(xì)胞的粘附和釋放。
圖6.一種動(dòng)態(tài)控制細(xì)胞粘附和釋放的兩性離子聚合物
三�、結(jié)果和展望
未來的電子植入電子器件應(yīng)該具有抑制炎癥反應(yīng)�,高信噪比�,并能與神經(jīng)元緊密電偶聯(lián)。生物功能化CPs已被廣泛用于修改神經(jīng)元-電極相互作用或調(diào)節(jié)表面免疫反應(yīng)�。兩性離子CPs具有優(yōu)異的電化學(xué)性能,且能顯著抑制疤痕組織的形成�,保持器件靈敏度。
然而�,為了開發(fā)一種可長期應(yīng)用的生物電子植入器件,幾個(gè)關(guān)鍵問題仍有待解決�。首先,兩性離子CP電極在腦內(nèi)的長期植入需要進(jìn)一步探索�。其次,了解兩性離子如何調(diào)節(jié)混合離子-電子傳輸以及CP-金屬和CP-水界面的電荷傳輸�,對(duì)組織電偶聯(lián)植入器件至關(guān)重要。第三�,開發(fā)化學(xué)方法來制備可溶性兩性離子CPs將使制造電極植入器件具有成本效益。此外�,將生物功能化的CPs與兩性離子CPs結(jié)合,有望與植入器件的目標(biāo)神經(jīng)細(xì)胞/組織形成緊密的選擇性電偶聯(lián)�。進(jìn)一步在體內(nèi)驗(yàn)證和優(yōu)化這種方法將使生物電子植入器件在大腦中長期穩(wěn)定地發(fā)揮作用。兩性離子CPs與生物分子的結(jié)合將賦予生物電子植入物抑制炎癥的特性�,并同時(shí)促進(jìn)與神經(jīng)細(xì)胞/組織在低阻抗下的緊密電偶聯(lián),顯著推進(jìn)神經(jīng)細(xì)胞/組織的長期監(jiān)測(cè)�、刺激和記錄。
原文信息
Sihao Qian,‡ Hsing-An Lin,‡ Qichao Pan, Shuhua Zhang, Yunhua Zhang, Zhi Geng, Qing Wu, Yong He,* Bo Zhu*.
Chemically revised conducting polymers with inflammation resistance for intimate bioelectronic electrocoupling.
Bioactive Materials, 26 (2023) 24-51.