您當(dāng)前的位置:檢測資訊 > 法規(guī)標(biāo)準(zhǔn)
嘉峪檢測網(wǎng) 2023-07-13 17:13
|
日期 |
No. |
名稱 |
文章鏈接 |
|
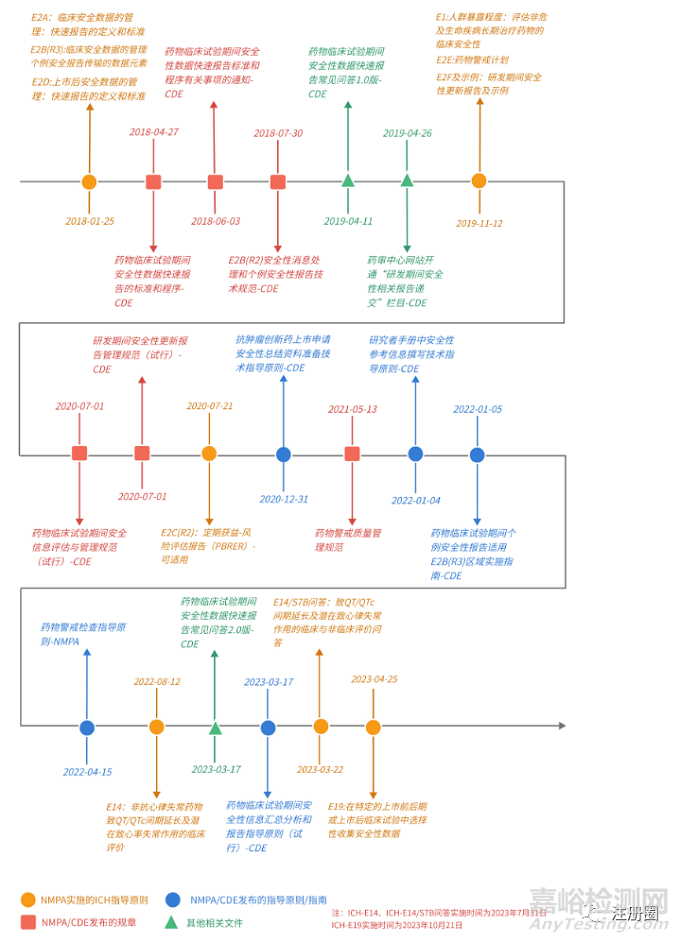
2018/1/25 |
1 |
E2A:臨床安全數(shù)據(jù)的管理:快速報告的定義和標(biāo)準(zhǔn) |
食品藥品監(jiān)管總局關(guān)于適用國際人用藥品注冊技術(shù)協(xié)調(diào)會二級指導(dǎo)原則的公告 (2018年第10號)(nmpa.gov.cn)https://www.nmpa.gov.cn/yaopin/ ypggtg/ypqtgg/20180125175101686.html |
|
2 |
E2B(R3):臨床安全數(shù)據(jù)的管理個例安全報告?zhèn)鬏數(shù)臄?shù)據(jù)元素 |
||
|
3 |
E2D:上市后安全數(shù)據(jù)的管理:快速報告的定義和標(biāo)準(zhǔn) |
||
|
2018/4/27 |
4 |
藥物臨床試驗期間安全性數(shù)據(jù)快速報告的標(biāo)準(zhǔn)和程序-CDE |
關(guān)于發(fā)布《藥物臨床試驗期間安全性數(shù)據(jù)快速報告的標(biāo)準(zhǔn)和程序》的通知(cde.org.cn)https://www.cde.org.cn/main/news/ viewInfoCommon/f86be6d655db5c711fe660bef22c3bf1 |
|
2018/6/3 |
5 |
藥物臨床試驗期間安全性數(shù)據(jù)快速報告標(biāo)準(zhǔn)和程序有關(guān)事項的通知-CDE |
關(guān)于《藥物臨床試驗期間安全性數(shù)據(jù)快速報告標(biāo)準(zhǔn)和程序》有關(guān)事項的通知(cde.org.cn)https://www.cde.org.cn/main/news/viewInfoCommon/ 1293f7c3d511225fadbab12a209d152c |
|
2018/7/30 |
6 |
E2B(R2)安全性消息處理和個例安全性報告技術(shù)規(guī)范-CDE |
關(guān)于發(fā)布《E2B(R2)安全性消息處理和個例安全性報告技術(shù)規(guī)范》的通知(cde.org.cn)https://www.cde.org.cn/main/news/viewInfoCommon/ a80202f164ba3f3f48ea8885c1f84456 |
|
2019/4/11 |
7 |
藥物臨床試驗期間安全性數(shù)據(jù)快速報告常見問答1.0版-CDE |
關(guān)于發(fā)布《藥物臨床試驗期間安全性數(shù)據(jù)快速報告常見問答(1.0版)》的通知(cde.org.cn)https://www.cde.org.cn/main/news/viewInfoCommon/ b214ff397320e00befbd1a10db5136d1 |
|
2019/4/26 |
8 |
藥審中心網(wǎng)站開通“研發(fā)期間安全性相關(guān)報告遞交”欄目-CDE |
關(guān)于藥品審評中心網(wǎng)站開通“研發(fā)期間安全性相關(guān)報告遞交”欄目的通知(cde.org.cn)https://www.cde.org.cn/main/news/ viewInfoCommon/39eeea099eeef308531fe32531efe2c9 |
|
2019/11/12 |
9 |
E1:人群暴露程度:評估非危及生命性疾病長期治療藥物的臨床安全性 |
國家藥監(jiān)局關(guān)于適用《E1:人群暴露程度: 評估非危及生命性疾病長期治療藥物的臨床安全性》 等15個國際人用藥品注冊技術(shù)協(xié)調(diào)會指導(dǎo)原則的公告(2019年第88號) (nmpa.gov.cn)https://www.nmpa.gov.cn /yaopin/ypggtg/ypqtgg/20191112094101469.html |
|
10 |
E2E:藥物警戒計劃 |
||
|
11 |
E2F及示例:研發(fā)期間安全性更新報告及示例 |
||
|
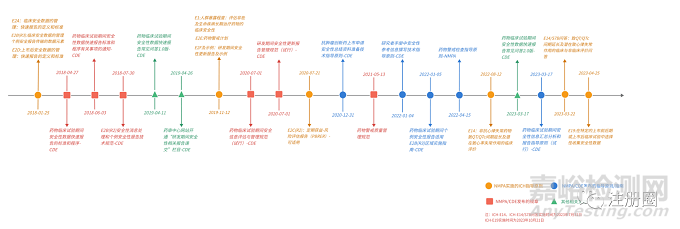
2020/7/1 |
12 |
藥物臨床試驗期間安全信息評估與管理規(guī)范(試行)-CDE |
國家藥監(jiān)局藥審中心關(guān)于發(fā)布 《藥物臨床試驗期間安全信息評估與管理規(guī)范(試行)》的通告 (2020年第5號)(cde.org.cn)https:// www.cde.org.cn/main/news/viewInfoCommon/ a1d42f512a341bc079ffb79df91f9cc7 |
|
13 |
研發(fā)期間安全性更新報告管理規(guī)范(試行) |
國家藥監(jiān)局藥審中心關(guān)于發(fā)布 《研發(fā)期間安全性更新報告管理規(guī)范(試行)》的通告(2020年第7號)(cde.org.cn)https://www.cde.org.cn/main/news/ viewInfoCommon/afced30f3c45431f04b47a7f3faee971 |
|
|
2020/7/21 |
14 |
E2C(R2):定期獲益-風(fēng)險評估報告(PBRER)-可適用 |
國家藥監(jiān)局關(guān)于可適用《E2C(R2):定期獲益-風(fēng)險評估報告(PBRER)》 國際人用藥品注冊技術(shù)協(xié)調(diào)會指導(dǎo)原則的公告(2020年 第86號)(nmpa.gov.cn)https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/ 20200721172101743.html |
|
2020/12/31 |
15 |
抗腫瘤創(chuàng)新藥上市申請安全性總結(jié)資料準(zhǔn)備技術(shù)指導(dǎo)原則-CDE |
國家藥監(jiān)局藥審中心關(guān)于發(fā)布《抗腫瘤創(chuàng)新藥上市申請安全性總結(jié)資料準(zhǔn)備技術(shù)指導(dǎo)原則》 的通告(2020年第56號)(cde.org.cn)https://www.cde.org.cn/main/news/ viewInfoCommon/6539f28b92b2d7b57579b760062ed75a |
|
2021/5/13 |
16 |
藥物警戒質(zhì)量管理規(guī)范 |
國家藥監(jiān)局關(guān)于發(fā)布《藥物警戒質(zhì)量管理規(guī)范》的公告(2021年 第65號) (nmpa.gov.cn)https://www.nmpa.gov.cn/ xxgk/fgwj/xzhgfxwj/20210513151827179.html |
|
2022/1/4 |
17 |
研究者手冊中安全性參考信息撰寫技術(shù)指導(dǎo)原則-CDE |
國家藥監(jiān)局藥審中心關(guān)于發(fā)布 《研究者手冊中安全性參考信息撰寫技術(shù)指導(dǎo)原則》的通告(2021年第60號)(cde.org.cn)https://www.cde.org.cn/main/news/ viewInfoCommon/7a46f5d526a64bb53c53e50c6afb9215 |
|
2022/1/5 |
18 |
藥物臨床試驗期間個例安全性報告適用E2B(R3)區(qū)域?qū)嵤┲改?CDE |
藥審中心藥物臨床試驗期間個例安全性報告適用E2B(R3)區(qū)域?qū)嵤┲改系耐ㄖ?cde.org.cn)https://www.cde.org.cn/main/news/ viewInfoCommon/42e09b0e50e86c46b38f1f93f983222c |
|
2022/4/15 |
19 |
藥物警戒檢查指導(dǎo)原則 |
國家藥監(jiān)局關(guān)于印發(fā) 《藥物警戒檢查指導(dǎo)原則》的通知(nmpa.gov.cn)https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/ 20220415102743184.html |
|
2022/8/12 |
20 |
E14:非抗心律失常藥物致QT/QTc間期延長及潛在致心率失常作用的臨床評價 |
國家藥監(jiān)局關(guān)于適用《E8(R1):臨床研究的一般考慮》和 《E14:非抗心律失常藥物致QT/QTc間期延長及潛在致心律失常作用的臨床評價》 國際人用藥品注冊技術(shù)協(xié)調(diào)會指導(dǎo)原則的公告(2022年第61號)(nmpa.gov.cn)https://www.nmpa.gov.cn/yaopin/ypggtg/ 20220812151143165.html |
|
2023/3/17 |
21 |
藥物臨床試驗期間安全性數(shù)據(jù)快速報告常見問答2.0版-CDE |
國家藥監(jiān)局藥審中心關(guān)于發(fā)布《藥物臨床試驗期間安全性數(shù)據(jù)快速報告常見問答(2.0版)》 的通告(2023年第17號)(cde.org.cn)https://www.cde.org.cn/main/news/ viewInfoCommon/ddea289e856a539aa70121ae04ec38ac |
|
2023/3/17 |
22 |
藥物臨床試驗期間 安全性信息匯總分析和報告指導(dǎo)原則(試行)-CDE |
國家藥監(jiān)局藥審中心關(guān)于發(fā)布 《藥物臨床試驗期間安全性信息匯總分析和報告指導(dǎo)原則(試行)》 的通告(2023年第16號) (cde.org.cn) https://www.cde.org.cn/main/news/viewInfoCommon /837db9784c3a549973c34d9ca16624f6 |
|
2023/3/22 |
23 |
E14/S7B問答:致QT/QTc間期延長及潛在致心律失常作用的臨床與非臨床評價問答 |
國家藥監(jiān)局關(guān)于適用《S1B(R1):藥物致癌性試驗》和 《E14-S7B問答:致QT/QTc間期延長及潛在致心律失常作用的臨床與非臨床評價問答》 國際人用藥品注冊技術(shù)協(xié)調(diào)會指導(dǎo)原則的公告(2023年第33號)(nmpa.gov.cn)https://www.nmpa.gov.cn/yaopin/ypggtg/ 20230322150341152.html |
|
2023/04/25 |
24 |
E19:在特定的上市前后期或上市后臨床試驗中選擇性收集安全性數(shù)據(jù) |
國家藥監(jiān)局關(guān)于適用 《E19:在特定的上市前后期或上市后臨床試驗中選擇性收集安全性數(shù)據(jù)》 國際人用藥品注冊技術(shù)協(xié)調(diào)會指導(dǎo)原則的公告(2023年第56號)(nmpa.gov.cn)https://www.nmpa.gov.cn/ yaopin/ypggtg/20230424171952130.html |

來源:注冊圈