2023年6月30日,周五了�����,國家藥監(jiān)局是不是會布置作業(yè)呢���?果不其然�,國家藥監(jiān)局官網(wǎng)發(fā)布“公開征求《藥品檢查管理辦法(試行)》部分條款修訂意見”(成文日期:2023年6月29日)�����,征求截止日期:2023年7月10日�����。此辦法為貫徹《藥品管理法》《疫苗管理法》���,進(jìn)一步規(guī)范藥品檢查行為���,推動藥品監(jiān)管工作盡快適應(yīng)新形勢。本文為大家梳理了本辦法中與藥企有關(guān)條款內(nèi)容并結(jié)合自己的解讀與大家分享�����。
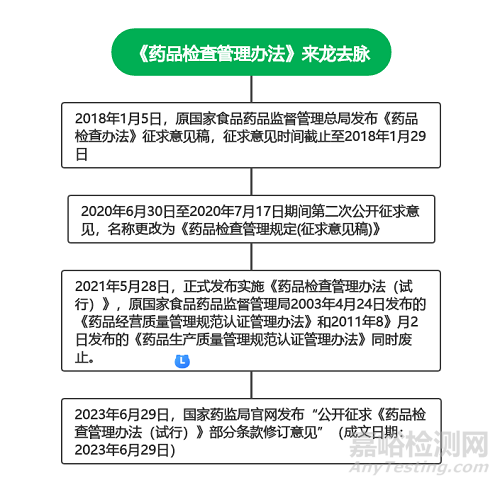
一、《藥品檢查管理辦法》來龍去脈
新版《藥品管理法》第九十九條明確藥品監(jiān)督管理部門應(yīng)當(dāng)依照法律���、法規(guī)的規(guī)定對藥品研制���、生產(chǎn)、經(jīng)營和藥品使用單位使用藥品等活動進(jìn)行監(jiān)督檢查�,必要時可以對為藥品研制、生產(chǎn)�����、經(jīng)營�、使用提供產(chǎn)品或者服務(wù)的單位和個人進(jìn)行延伸檢查,為了進(jìn)一步規(guī)范藥品檢查行為�����,推動藥品監(jiān)管工作盡快適應(yīng)新形勢�����,國家局有必要出臺相關(guān)藥品檢查管理制度,政策來龍去脈梳理如下:
二�����、藥品檢查相關(guān)法規(guī)要求
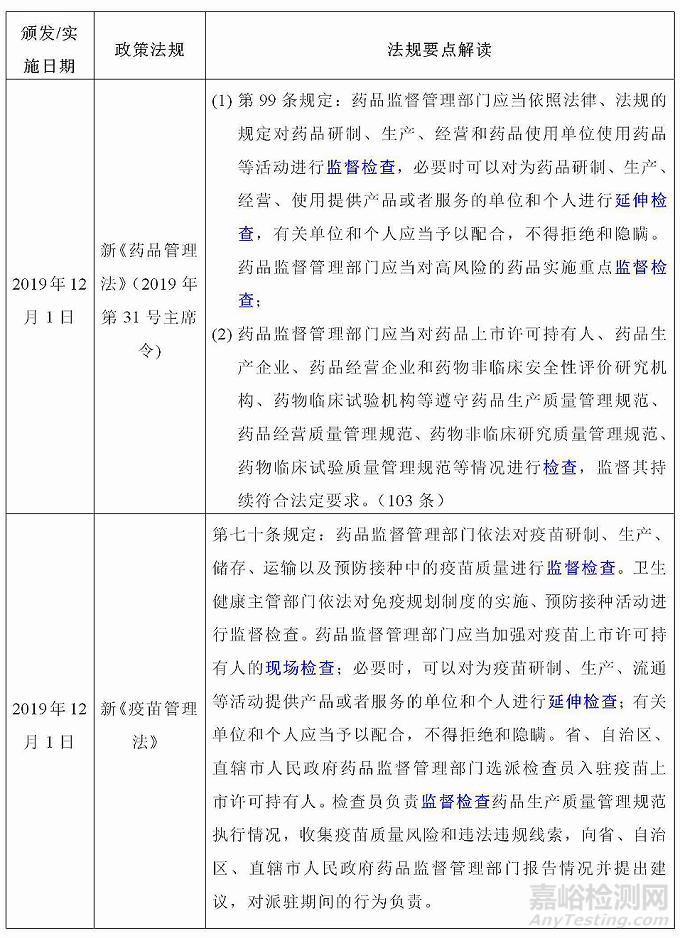
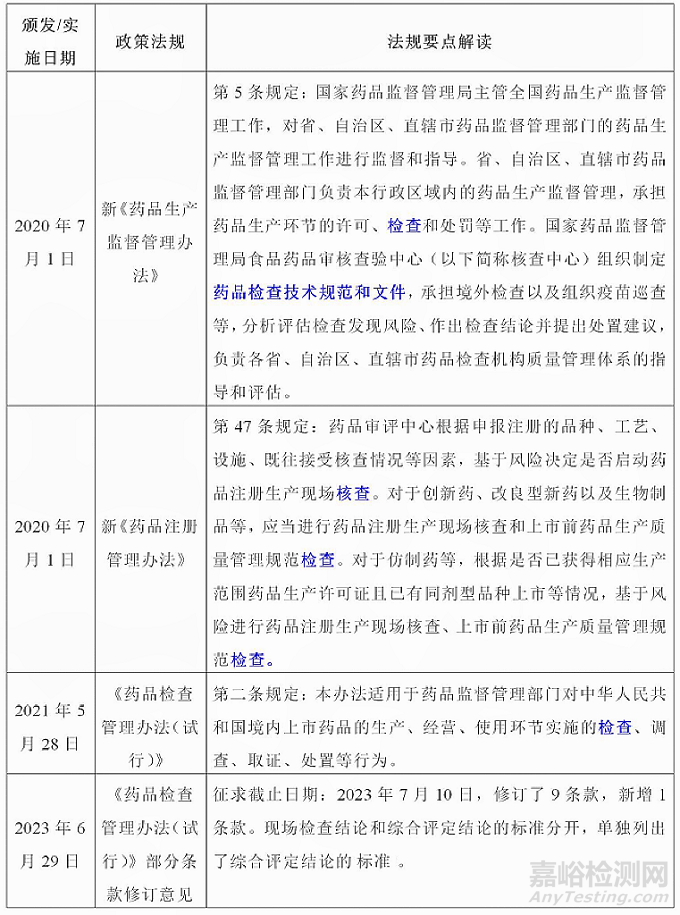
藥品檢查是藥品監(jiān)督管理部門對藥品生產(chǎn)�、經(jīng)營���、使用環(huán)節(jié)相關(guān)單位遵守法律法規(guī)�、執(zhí)行相關(guān)質(zhì)量管理規(guī)范和藥品標(biāo)準(zhǔn)等情況進(jìn)行檢查的行為���,新發(fā)布實施的兩法(《藥品管理法》《疫苗管理法》)和兩辦法(《藥品生產(chǎn)監(jiān)督管理辦法》《藥品注冊管理辦法》)藥品檢查相關(guān)內(nèi)容�,梳理如下:
三���、藥品檢查規(guī)則有哪些新變化���?
2021年5月28日正式發(fā)布實施《藥品檢查管理辦法(試行)》后2年多,為貫徹落實《藥品管理法》《藥品生產(chǎn)監(jiān)督管理辦法》�����,進(jìn)一步規(guī)范藥品檢查行為�����,國家藥監(jiān)局組織對《藥品檢查管理辦法(試行)》部分條款進(jìn)行修訂,修訂部分以對照表形式給出�����,其中�����,現(xiàn)場檢查結(jié)論和綜合評定結(jié)論的標(biāo)準(zhǔn)分開�,單獨列出了綜合評定結(jié)論的標(biāo)準(zhǔn),新舊版如下表:
參考文獻(xiàn)
[1] www.nmpa.gov.cn