人工智能進入醫(yī)藥領(lǐng)域后,對監(jiān)管的要求又更上一層樓�����。
AI對于醫(yī)藥的促進作用毋庸置疑�����,但是如何在促進的情況下���,對于算法的透明度以及數(shù)據(jù)進行保護�����,是近年來重要的議題。
美國食品藥品管理局(FDA)�、歐洲藥品管理局(EMA)等都已經(jīng)把AI作為藥品監(jiān)管科學(xué)研究的重點領(lǐng)域。
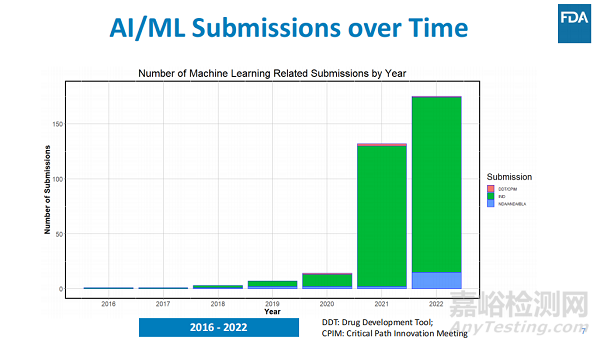
FDA表示�����,在過去幾年中使用 AI/ML 軟件提交的藥物和生物申請數(shù)量顯著增加,僅在2021年就有132份申請���。
近段時間以來�����,F(xiàn)DA對于AI藥物研發(fā)的討論以及文件在密集發(fā)布�,未來針對該領(lǐng)域的監(jiān)管有望出臺�。
關(guān)于人工智能/機器學(xué)習(xí)定義
此處FDA沿用了國際醫(yī)療器械監(jiān)管者論壇(International Medical Device Regulators Forum,IMDRF)此前所發(fā)布的技術(shù)文件《Machine Learning-enabled Medical Devices:Key Terms and Definitions》中的定義。
而該文件主要參考國際標(biāo)準(zhǔn)化組織(ISO)及國際電工委員會(IEC)相關(guān)標(biāo)準(zhǔn)和其他文件�,對人工智能(AI)和機器學(xué)習(xí)(ML)相關(guān)概念進行了概述�����。
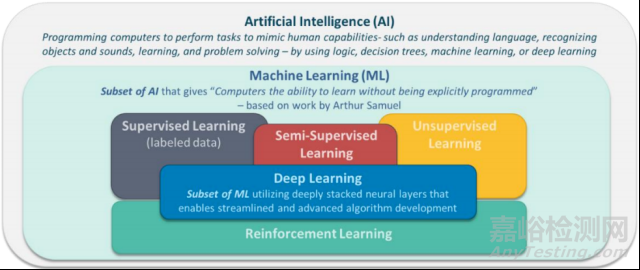
圖:AI和ML概念的概述
關(guān)于人工智能,文件中認(rèn)為其是計算機科學(xué)�、統(tǒng)計學(xué)和工程學(xué)的一個分支�,它使用算法或模型來執(zhí)行任務(wù)并展示學(xué)習(xí)���、決策和預(yù)測等行為�。而機器學(xué)習(xí)被認(rèn)為是人工智能的一個子集�,它使計算機具有無需明確編程的學(xué)習(xí)能力�。
FDA中的AI+藥物研發(fā)數(shù)據(jù)
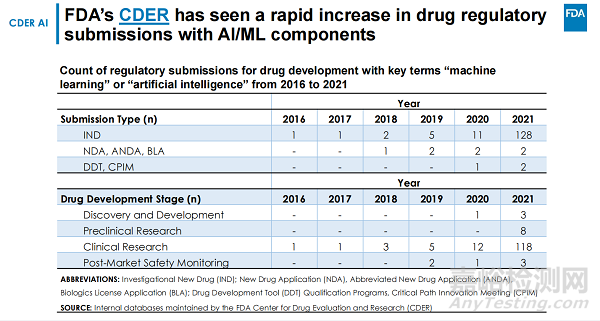
通過在藥物評估與研究中心(CDER)內(nèi)部數(shù)據(jù)庫中搜索關(guān)鍵術(shù)語“機器學(xué)習(xí)”或“人工智能”的提交文件�����,這些提交包括研究性新藥申請(IND)���、新藥申請(NDA)���、生物許可申請(BLA)�����、關(guān)鍵路徑創(chuàng)新會議(CPIM)和藥物開發(fā)工具計劃(DDT)���。
FDA發(fā)現(xiàn)過去幾年中,使用 AI/ML 組件提交的提交數(shù)量迅速增加���。在 2016 年和 2017 年,每年只能確定一份此類提交�����。從 2017 年到 2020 年�,提交的數(shù)量大幅增加,2021年是2016年的132倍���。�。
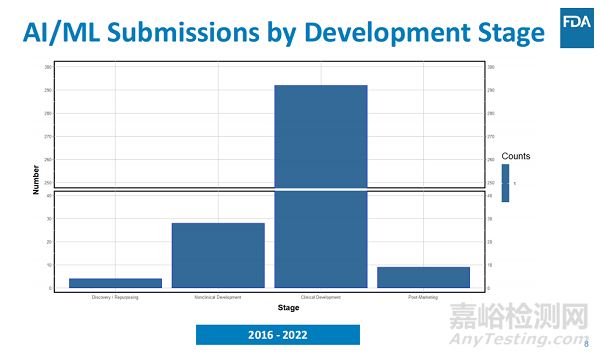
其中有關(guān)臨床許可的占比最高���,可以看到絕大多數(shù)AI賦能的藥物研發(fā)仍然處于臨床前至臨床階段�����,另外2022年NDA/ANDA/BLA的提交正在增加���。使用 AI/ML 組件增加提交的趨勢符合FDA的預(yù)期,基于觀察到的制藥和技術(shù)行業(yè)之間越來越多的合作���。
按治療開發(fā)生命周期階段的分布來看�,在這些提交中�����,大多數(shù)AI/ML應(yīng)用發(fā)生在臨床藥物開發(fā)階段�,但它們也發(fā)生在藥物發(fā)現(xiàn)���,臨床前藥物開發(fā)和上市后階段�����。值得注意的是�,在向FDA提交的監(jiān)管文件中提及AI/ML的頻率可能僅代表其在藥物發(fā)現(xiàn)中日益廣泛使用的一小部分���。
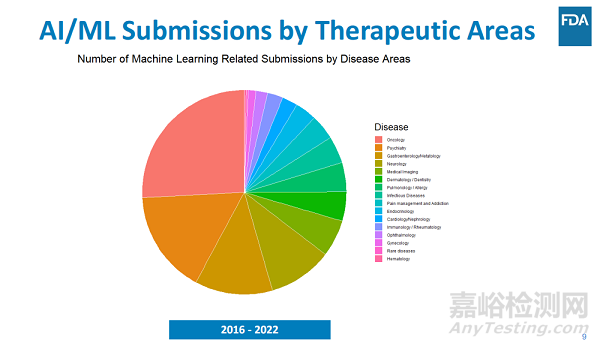
腫瘤學(xué)仍然是AI藥物研發(fā)的主要領(lǐng)域,其次是精神病學(xué)�����、腸胃領(lǐng)域以及神經(jīng)病學(xué)也是重點關(guān)注領(lǐng)域�����。
最后,F(xiàn)DA的專家也提到了���,底層數(shù)據(jù)從根本上決定了AL方法優(yōu)劣與否�,AI一樣有非常大的局限性。
o 缺乏用于開發(fā)和測試的數(shù)據(jù)
o 識別和緩解數(shù)據(jù)集中的偏差
o 由于數(shù)據(jù)集偏移導(dǎo)致的泛化不佳���,過度擬合混雜因素
• 黑盒算法
• 確保對用戶的透明度
• 為自適應(yīng)算法提供監(jiān)督/治理
• 需要在某些領(lǐng)域明確監(jiān)管
我國的進展
近年來,美國食品藥品管理局(FDA)���、歐洲藥品管理局(EMA)等都已經(jīng)把AI作為藥品監(jiān)管科學(xué)研究的重點領(lǐng)域�����。
藥物研發(fā)是我國AI應(yīng)用領(lǐng)域的關(guān)鍵場景之一�。近年來�����,相關(guān)法律法規(guī)的陸續(xù)出臺,彰顯了我國積極迎接數(shù)字化轉(zhuǎn)型變革�,不斷探索科學(xué)監(jiān)管新工具�、新標(biāo)準(zhǔn)和新方法的決心。
2020年12月�����,國家藥監(jiān)局藥品審評中心(CDE)發(fā)布《模型引導(dǎo)的藥物研發(fā)技術(shù)指導(dǎo)原則》�;2021年4月���,CDE發(fā)布《用于產(chǎn)生真實世界證據(jù)的真實世界數(shù)據(jù)指導(dǎo)原則(試行)》, 這兩個指導(dǎo)原則分別針對藥物研發(fā)模型開發(fā)和真實世界數(shù)據(jù)治理兩個重要AI應(yīng)用場景進行規(guī)范�����。
2021年7月�,CDE發(fā)布了《以臨床價值為導(dǎo)向的抗腫瘤藥物臨床研發(fā)指導(dǎo)原則》,進一步明確和提高了國內(nèi)創(chuàng)新藥的研發(fā)定位和上市要求�����。同時�,國家不斷出臺人工智能產(chǎn)業(yè)的相關(guān)規(guī)劃,鼓勵人工智能技術(shù)與實體經(jīng)濟的融合�。
2022年1月工信部等九部門聯(lián)合印發(fā)的《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》指出,立足新發(fā)展階段���,完整���、準(zhǔn)確���、全面貫徹新發(fā)展理念���,構(gòu)建新發(fā)展格局,落實制造強國戰(zhàn)略���,全面推進健康中國建設(shè)�,加快創(chuàng)新驅(qū)動發(fā)展轉(zhuǎn)型�����,培育新發(fā)展新動能�����,推動產(chǎn)業(yè)高端化、智能化和綠色化�,構(gòu)筑國際競爭新優(yōu)勢,健全醫(yī)藥供應(yīng)保障體系,更好滿足人民群眾多元化���、多層次的健康需求�����。
2023年2月�,中共中央�、國務(wù)院印發(fā)《數(shù)字中國建設(shè)整體布局規(guī)劃》(以下簡稱《規(guī)劃》)�����?��!兑?guī)劃》提出�,到2025年,基本形成橫向打通�、縱向貫通�����、協(xié)調(diào)有力的一體化推進格局,數(shù)字中國建設(shè)取得重要進展�。數(shù)字基礎(chǔ)設(shè)施高效聯(lián)通�,數(shù)據(jù)資源規(guī)模和質(zhì)量加快提升���,數(shù)據(jù)要素價值有效釋放�,數(shù)字技術(shù)創(chuàng)新實現(xiàn)重大突破,應(yīng)用創(chuàng)新全球領(lǐng)先等一系列規(guī)劃目標(biāo)。
參考鏈接:
《Application of Artificial Intelligence and Machine Learning in Drug Development and Precision Medicine》Hao Zhu, Ph.D., Mstat Division of Pharmacometrics,F(xiàn)DA/CDER/OTS/OCP
深入開展監(jiān)管科學(xué)研究 積極迎接數(shù)字化轉(zhuǎn)型 “人工智能+藥物研發(fā)”推動監(jiān)管領(lǐng)域創(chuàng)新