摘 要 / Abstract
擁有獨立、完善的疫苗國家監(jiān)管體系(NRA)并且通過世界衛(wèi)生組織(WHO)正式評估是一個國家疫苗能夠參與聯(lián)合國全球疫苗采購計劃的必要條件����。全球基準(zhǔn)工具(GBT)修訂Ⅵ第1 版于2018 年最終敲定并發(fā)布,是WHO 進(jìn)行疫苗NRA 評估的主要依據(jù)����。本文將結(jié)合我國疫苗市場監(jiān)管現(xiàn)狀重點分析GBT 修訂Ⅵ第1 版市場監(jiān)管板塊指標(biāo)����,以期用國際疫苗市場監(jiān)管理念促進(jìn)我國疫苗市場監(jiān)管工作。
To participate in the United Nations Vaccine Procurement Plans, a country must have an independent and complete National Regulatory Authority (NRA) for vaccines and pass the official NRA assessment of the World Health Organization (WHO). The Global Benchmarking Tool (GBT) Revision VI, finalized and published in 2018, is the primary foundation for the NRA assessment. Based on the current status of vaccine market supervision in China, this article focuses on analyzing the indicators of the market supervision and control sector in GBT Revision VI, and expects to promote vaccine market supervision in China according to international standards.
關(guān) 鍵 詞 / Key words
疫苗����;國家監(jiān)管體系����;全球基準(zhǔn)工具����;市場監(jiān)管
vaccine; national regulatory authority; global benchmarking tool; market surveillance and control
疫苗作為一種預(yù)防性生物制品類藥品,其主要接種對象為健康人群和嬰幼兒����,一旦出現(xiàn)安全隱患將會對社會造成難以估量的影響。與其他普通商品不同����,消費者一般無法自主判斷疫苗的質(zhì)量,只能依靠負(fù)責(zé)疫苗全生命周期監(jiān)管的國家管理機(jī)構(gòu)對疫苗質(zhì)量進(jìn)行管控����。
世界衛(wèi)生組織(World Health Organization,WHO)的疫苗國家監(jiān)管體系(national regulatory authority����,NRA) 評估是對一個國家疫苗監(jiān)管機(jī)構(gòu)或體系監(jiān)管能力的全面評估[1]。一個國家生產(chǎn)的疫苗具備聯(lián)合國全球采購資格的2 個基礎(chǔ)條件:一是疫苗生產(chǎn)國擁有獨立����、完善的疫苗NRA 并且通過WHO 正式評估����;二是疫苗生產(chǎn)企業(yè)通過WHO 預(yù)認(rèn)證(prequalification����,PQ)[2]。
WHO 曾于1999 年����、2001年和2005 年分別對我國疫苗NRA 進(jìn)行評估,遺憾的是����,評估結(jié)果均為“不通過”[3]。隨著我國疫苗監(jiān)管體系的不斷健全完善����,我國于2011 年首次通過NRA 評估,并于2014 年順利通過復(fù)評估[4]����。
2022 年8 月23 日����,WHO宣布我國第三次通過疫苗NRA評估[5]����。新一輪評估采用《WHO醫(yī)療產(chǎn)品國家監(jiān)管體系評估全球基準(zhǔn)工具(GBT)》修訂Ⅵ 第1版( 以下簡稱GBT 修訂Ⅵ 第1版)作為評估依據(jù)[6]����。本文將對WHO 疫苗NRA 評估進(jìn)行簡要介紹,結(jié)合我國疫苗市場監(jiān)管現(xiàn)狀解析GBT 修訂Ⅵ第1 版市場監(jiān)管(market supervision and control����,MC)板塊指標(biāo),并在此基礎(chǔ)上提出促進(jìn)我國疫苗市場監(jiān)管工作的建議����。
1、WHO 疫苗NRA 評估介紹
WHO 的職能包括監(jiān)測區(qū)域和全球衛(wèi)生狀況和趨勢����,參與評價不同國家疫苗的可接受性[7-8]。世界上大多數(shù)國家的監(jiān)管機(jī)構(gòu)仍在努力達(dá)到WHO 成熟度水平要求����,期望擁有穩(wěn)定、運轉(zhuǎn)良好和一體化的監(jiān)管體系����。WHO 疫苗NRA 評估的實質(zhì)是對一個國家疫苗監(jiān)管體系的定期外審職能評估����,通常每3~7 年進(jìn)行一次����,以保證其提供的疫苗質(zhì)量連續(xù)可控。通過NRA 評估����,WHO 可以清楚地了解成員國的疫苗監(jiān)管能力,判定其已達(dá)到成熟度水平����,促進(jìn)各國疫苗監(jiān)管機(jī)構(gòu)制定機(jī)構(gòu)發(fā)展計劃[6, 9-11]。
GBT 作為第一個全球公認(rèn)的客觀評估和加強(qiáng)國家疫苗監(jiān)管機(jī)構(gòu)能力的評估工具����,可以幫助NRA 進(jìn)行自我評估和改進(jìn),是WHO 進(jìn)行疫苗NRA 評估的主要依據(jù)����。為持續(xù)保持GBT 合法性、獨立性、公正性����、靈活性����、有效性等方面特質(zhì),WHO 會根據(jù)以往的使用經(jīng)驗����、成員國相關(guān)反饋以及NRA 的發(fā)展情況等對其定期進(jìn)行修訂,逐步改進(jìn)評估相關(guān)要求[11]����。
目前GBT 最新版本為修訂Ⅵ 第1 版, 該版本根據(jù)ISO9004 納入了“成熟度水平”的概念����,允許WHO 從1 級到4 級對NRA 的整體成熟度進(jìn)行劃分,等級越高代表NRA 成熟度水平越高����,成熟度達(dá)到3 級及以上水平意味著通過NRA 評估。
相比于舊版����,GBT 修訂Ⅵ第1 版整體評估標(biāo)準(zhǔn)更加嚴(yán)格����,內(nèi)容更加豐富����,評估指標(biāo)項大幅度增加。包括提供監(jiān)管框架的國家監(jiān)管體系(RS)與8 項NRA 核心監(jiān)管職能(注冊和上市許可����、藥物警戒、市場監(jiān)管����、機(jī)構(gòu)許可、監(jiān)督檢查����、實驗室檢驗、臨床試驗監(jiān)管����、批簽發(fā)),共九大板塊����。其中����,市場監(jiān)管和機(jī)構(gòu)許可兩大板塊為新增板塊����,對質(zhì)量管理體系建設(shè)����、部門協(xié)調(diào)配合提出更高要求。
市場監(jiān)管作為疫苗質(zhì)量控制的關(guān)鍵領(lǐng)域之一����,在確保醫(yī)療產(chǎn)品消費者安全方面起著至關(guān)重要的作用,因為它的目標(biāo)是確保投放市場的疫苗產(chǎn)品符合預(yù)設(shè)的質(zhì)量標(biāo)準(zhǔn)����、安全性和有效性(即驗證是否符合營銷授權(quán)和GXP 指南),著眼于解決不合格和偽造疫苗產(chǎn)品問題的能力����,主要涉及疫苗全生命周期管理環(huán)節(jié)中流通環(huán)節(jié)的監(jiān)管。結(jié)合我國疫苗市場監(jiān)管現(xiàn)狀解析GBT 修訂Ⅵ第1 版市場監(jiān)管板塊評估要求����,查漏補(bǔ)缺����,能夠使我國疫苗市場監(jiān)管水平對標(biāo)國際標(biāo)準(zhǔn)����,更快推動我國疫苗產(chǎn)品走向國際市場。
2����、GBT 市場監(jiān)管板塊指標(biāo)分析
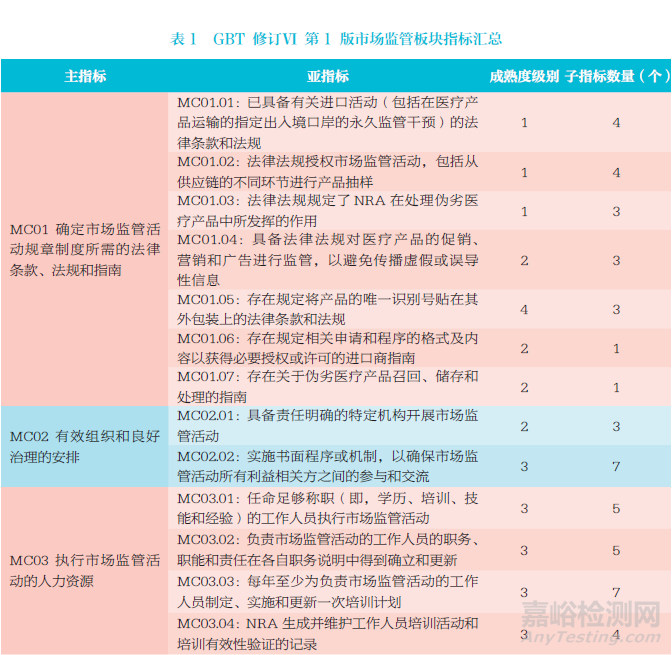
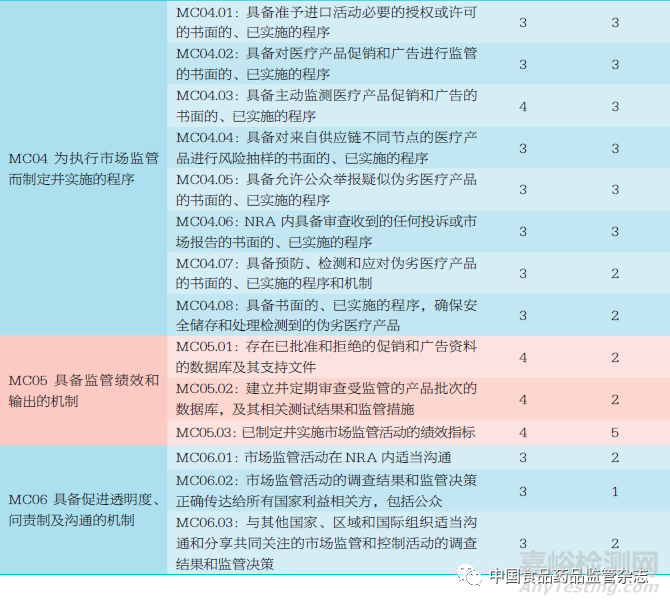
GBT 修訂Ⅵ第1 版市場監(jiān)管板塊涵蓋6 個方面評估指標(biāo)要求:①法律條款、法規(guī)和指南����。旨在確保具備一套完整的法律框架支持疫苗相關(guān)市場監(jiān)管活動,能夠為NRA 開展有關(guān)進(jìn)口活動����、廣告營銷、偽劣醫(yī)療產(chǎn)品召回����、儲存和處理等市場監(jiān)管活動提供必要法律授權(quán)。②組織和治理����。具有責(zé)任明確的監(jiān)管機(jī)構(gòu)����,各組織或利益相關(guān)方之間具有良好規(guī)范的溝通交流合作機(jī)制����,有助于疫苗市場監(jiān)管活動高效運作。③人力資源����。NRA 內(nèi)部擁有數(shù)量充足且技能熟練的人力資源����,能夠確保市場監(jiān)管流程與活動按照國際最佳規(guī)范執(zhí)行。監(jiān)管人員需具備履行市場監(jiān)管活動所需的特定專業(yè)知識與專業(yè)技能����;監(jiān)管機(jī)構(gòu)需定期為監(jiān)管人員制定、實施和更新培訓(xùn)計劃����,建立相應(yīng)的培訓(xùn)效果評價機(jī)制。④監(jiān)管程序����。按照書面的已實施的標(biāo)準(zhǔn)程序或工作機(jī)制開展疫苗市場監(jiān)管工作����,以保證監(jiān)管流程的一致性����、有效性、公正性和相稱性����。⑤流程監(jiān)控及結(jié)果和影響評估。建立數(shù)據(jù)庫并定期評估NRA 進(jìn)行市場監(jiān)管活動的有效性����,有助于NRA 進(jìn)行任何必要的調(diào)整優(yōu)化或問題追溯。⑥透明度����、問責(zé)制和溝通。建立NRA 內(nèi)部市場監(jiān)管活動及相關(guān)信息有效溝通的機(jī)制����,促進(jìn)工作透明度和向公眾宣傳,以鼓勵NRA對其監(jiān)管任務(wù)負(fù)責(zé)����。
市場監(jiān)管板塊涵蓋主指標(biāo)����、亞指標(biāo)����、子指標(biāo)3 個指標(biāo)層次,主要涉及4 個主題:①進(jìn)口活動的監(jiān)管����。②偽劣醫(yī)療產(chǎn)品的預(yù)防、檢測和應(yīng)對����。③監(jiān)測整個供應(yīng)鏈中醫(yī)療產(chǎn)品質(zhì)量的市場監(jiān)督計劃����。④促銷、營銷和廣告活動的監(jiān)管����。這4 個主題貫穿整個市場監(jiān)管板塊指標(biāo)要求,構(gòu)成子指標(biāo)證據(jù)審查的主要元素����。
市場監(jiān)管板塊包括6 個主指標(biāo)����,27 個亞指標(biāo)����,涵蓋了法律法規(guī)、組織和治理����、人力資源、監(jiān)管程序����、監(jiān)管評估、透明度����、問責(zé)制和溝通等多方面評估指標(biāo)要求。每個亞指標(biāo)項下有相應(yīng)的子指標(biāo)評估項����,其中1 級成熟度指標(biāo)11 個,2 級成熟度指標(biāo)8 個����,3 級成熟度指標(biāo)52 個����,4 級成熟度指標(biāo)15 個����,共計86 個。1級����、2 級成熟度指標(biāo)全部通過并且90% 的3 級成熟度指標(biāo)通過,即可達(dá)到WHO 要求的3 級成熟度水平����,也就意味著通過了NRA評估[12]。GBT 修訂Ⅵ第1 版市場監(jiān)管板塊指標(biāo)匯總見表1����。
3����、我國疫苗NRA 建設(shè)分析
3.1 法律、法規(guī)與部門規(guī)章
NRA 履行疫苗市場監(jiān)管職能需要一套完整的����、書面的法律����、法規(guī)與指南性文件等作為支持和授權(quán)����。只有明確界定NRA的疫苗監(jiān)管職能和權(quán)力范圍,疫苗市場監(jiān)管機(jī)構(gòu)才能順利開展監(jiān)管活動����,保障人民用藥安全。WHO 認(rèn)為����,其成員國應(yīng)發(fā)揮政治領(lǐng)導(dǎo)的作用, 奠定堅實的疫苗市場監(jiān)管法律基礎(chǔ)����, 建立一套完整的疫苗市場安全監(jiān)管法律法規(guī)體系[11]。
疫苗市場監(jiān)管法律法規(guī)體系多涉及疫苗的儲存����、運輸、召回等流通環(huán)節(jié)。本文通過查閱相關(guān)文獻(xiàn)資料將我國主要的����、與疫苗市場監(jiān)管相關(guān)的法律法規(guī)及規(guī)范性文件進(jìn)行匯總,見表2����。
3.2 市場監(jiān)管機(jī)構(gòu)
疫苗監(jiān)管機(jī)構(gòu)的職責(zé)明確,利益相關(guān)方間進(jìn)行良好的溝通交流有利于疫苗市場監(jiān)管活動高效開展����。GBT 修訂Ⅵ第1 版中將“利益相關(guān)方”定義為個人、團(tuán)體或組織����,涉及范圍較為廣泛,如疫苗市場監(jiān)管機(jī)構(gòu)����、疫苗接種單位、疾病預(yù)防控制中心����、衛(wèi)生健康部門、WHO����、疫苗生產(chǎn)企業(yè)、實驗室����、公眾等均可納入利益相關(guān)方的定義范圍。
市場監(jiān)管板塊更偏向于上市后監(jiān)管工作����,不僅涉及國家藥監(jiān)局、國家市場監(jiān)管總局����、國家衛(wèi)生健康委、國家疾控局����、海關(guān)總署等國家級監(jiān)管部門,還涉及省����、市、縣等多級監(jiān)管部門聯(lián)動����,評估范圍較為廣泛����。目前我國已建立起覆蓋疫苗“研發(fā)- 生產(chǎn)-流通- 接種”全生命周期的監(jiān)管體系����, 衛(wèi)生健康部門負(fù)責(zé)預(yù)防接種的監(jiān)管工作, 藥品監(jiān)管部門負(fù)責(zé)疫苗從生產(chǎn)到使用所有環(huán)節(jié)的全程監(jiān)管����, 兩者通力合作,共同保障疫苗質(zhì)量安全����。當(dāng)疫苗流通后期進(jìn)入疾病預(yù)防控制機(jī)構(gòu)后,雖然疫苗仍處于流通階段����, 但主要由衛(wèi)生健康部門進(jìn)行監(jiān)管, 藥品監(jiān)管部門監(jiān)督力度較弱����, 因此兩部門存在一定的消息閉塞。目前兩部門信息交流途徑較為單一且交流制度過于形式化����,缺少定期的����、書面性的溝通交流機(jī)制����, 面對新突發(fā)性事件����, 無法及時將監(jiān)管信息互通共享。
3.3 人力資源
擁有足夠的經(jīng)驗豐富����、專業(yè)技能過硬的工作人員是NRA 履行市場監(jiān)管職能的必要條件。評估工具從人員數(shù)量����、人員技能、人員職務(wù)說明以及人員培訓(xùn)計劃和培訓(xùn)有效性驗證等方面對疫苗市場監(jiān)管機(jī)構(gòu)提出了要求����。實施疫苗市場監(jiān)管活動需要足夠的專業(yè)人員,負(fù)責(zé)當(dāng)前監(jiān)管活動的工作人員的工作資質(zhì)如學(xué)歷����、專業(yè)知識等必須符合當(dāng)前工作職位的需求����。
我國按照統(tǒng)一市場監(jiān)管的思路成立了市場監(jiān)督管理局����,越來越多的監(jiān)管任務(wù)下沉到基層部門,基層部門已成為保障疫苗質(zhì)量的中堅力量����。人民公共衛(wèi)生意識的提高使得我國疫苗市場主體不斷擴(kuò)大,疫苗監(jiān)管面臨新的挑戰(zhàn):一方面����,基層一線執(zhí)法人員緊缺,執(zhí)法力量遠(yuǎn)遠(yuǎn)不能滿足疫苗市場監(jiān)管主體的需求����;另一方面,市場監(jiān)督管理局大多數(shù)采用“ 工商”“質(zhì)監(jiān)”“食藥”三局合一模式����,人員職業(yè)素養(yǎng)和專業(yè)技能參差不齊,與疫苗等藥品監(jiān)管專業(yè)對口的人員較少����,無法滿足疫苗專業(yè)性監(jiān)管需求[13]����。在疫苗市場監(jiān)管人才缺失的背景下����,基層人員編制不足����、晉升空間狹小、“事多責(zé)任大”等現(xiàn)實問題又導(dǎo)致現(xiàn)有疫苗市場監(jiān)管體系內(nèi)基層人才資源流失嚴(yán)重����。在如此多現(xiàn)實社會因素的影響下,我國疫苗市場監(jiān)管體系開始出現(xiàn)不合理的人員結(jié)構(gòu)“倒金字塔”現(xiàn)象����,即頂層監(jiān)管專業(yè)人員充實而基層一線疫苗市場監(jiān)管執(zhí)法專業(yè)人員匱乏現(xiàn)象。
3.4 市場監(jiān)管程序
GBT 修訂Ⅵ 第1 版MC04指標(biāo)部分圍繞“程序”這一關(guān)鍵詞展開����。可用的規(guī)范性書面程序即標(biāo)準(zhǔn)操作程序(standard operation procedure����,SOP)一方面可以確保疫苗市場監(jiān)管活動的一致性����、有效性和公正性����,另一方面可以保證各項疫苗市場監(jiān)管活動有據(jù)可依、有據(jù)可查����、有據(jù)可證,從而確保最終監(jiān)管決定的科學(xué)合理性����。監(jiān)管人員在憑借標(biāo)準(zhǔn)操作程序辦事時需要留有監(jiān)管記錄和相應(yīng)文件來證明是按程序執(zhí)行,做到“有痕監(jiān)管”����。
文件的上傳下達(dá)方式及方法是反映一個部門或單位工作條理性、程序性的重要指標(biāo)����。我國系統(tǒng)化、程序化觀念相比于發(fā)達(dá)國家有一定的差距����,市場監(jiān)管單位上下級之間進(jìn)行文件����、通知轉(zhuǎn)發(fā)等信息傳遞時����,往往通過微信群、電話����、工作郵箱等方式實現(xiàn)。這種傳遞方式在操作方便的同時也會帶來材料混亂����、重要文件丟失����、后續(xù)工作梳理較繁瑣等風(fēng)險。部分單位無專屬操作程序或文件多年未曾更新����,監(jiān)管記錄多以紙質(zhì)文件儲存、流通����,未能及時分門別類進(jìn)行系統(tǒng)匯總����,證據(jù)留存較為分散����。
3.5 監(jiān)管部門績效
監(jiān)管部門績效機(jī)制的建立旨在確保疫苗市場監(jiān)管活動的持續(xù)有效,后續(xù)可以對疫苗監(jiān)管流程以及監(jiān)管結(jié)果進(jìn)行評估����。主指標(biāo)“MC05 具備監(jiān)管績效和輸出的機(jī)制”成熟度水平為4 級,這一指標(biāo)對NRA 提出了更高的要求����。WHO 認(rèn)為,僅僅依靠NRA 的成熟度水平無法提供足夠的績效信息����,實施數(shù)據(jù)庫和關(guān)鍵績效指標(biāo)(key performance indicator,KPI)有助于建立監(jiān)管部門績效考核機(jī)制����。數(shù)據(jù)庫的建立可以儲存和整合分析疫苗市場監(jiān)管活動的相關(guān)信息,能夠可視化����、數(shù)據(jù)跟蹤后續(xù)監(jiān)管活動����。量化的關(guān)鍵績效指標(biāo)有助于監(jiān)管績效的監(jiān)測����,指導(dǎo)監(jiān)管部門定向調(diào)整或優(yōu)化。需要特別注意的是����,MC05 指標(biāo)是對整個疫苗市場監(jiān)管部門績效評價而非監(jiān)管人員個人的績效評估。目前我國尚未建立針對疫苗市場監(jiān)管部門規(guī)范科學(xué)的績效評估機(jī)制����,績效考核指標(biāo)尚無統(tǒng)一的標(biāo)準(zhǔn)。
3.6 信息透明度
NRA 內(nèi)部以及利益相關(guān)方之間進(jìn)行有效溝通����,有助于提高疫苗市場監(jiān)管活動的透明度����,增強(qiáng)利益相關(guān)方對監(jiān)管體系的信心。為提高溝通效率和信息透明度����,評估工具對NRA 提出了3 點要求:① NRA 內(nèi)部針對市場監(jiān)管活動進(jìn)行溝通����。②與不同利益相關(guān)方溝通����,包括公眾。③與其他國家以及區(qū)域和國際組織共享市場監(jiān)管信息����。目前我國為公眾提供了免費疫苗信息查詢服務(wù),通過“中國藥品監(jiān)管”����,“E 藥云搜”等官方服務(wù)平臺,公眾可以查詢疫苗的生產(chǎn)廠家����、有效期、批次����、批簽發(fā)等相關(guān)信息[14]。但與其他發(fā)達(dá)國家相比����,我國疫苗信息公開力度尚待加強(qiáng)����,普通群眾難以識別疫苗特有專業(yè)名詞����,無法正確理解和辨別疫苗真?zhèn)魏童熜А?/span>
4、啟示與建議
作為疫苗生產(chǎn)的第一梯隊����,今后WHO 對于我國疫苗NRA評估要求必然會更加嚴(yán)格。必須更加注重自身疫苗市場監(jiān)管體系建設(shè)����,將我國疫苗市場監(jiān)管實際與國際標(biāo)準(zhǔn)相聯(lián)系,做到“以外促內(nèi)”����,推動我國疫苗市場監(jiān)管體系朝著規(guī)范化、程序化����、國際化方向發(fā)展����?���;贕BT 修訂Ⅵ第1版市場監(jiān)管板塊指標(biāo)要求����,本文將從以下幾個方面提出促進(jìn)我國疫苗市場監(jiān)管工作的建議。
4.1 建好外部專家?guī)?/span>
疫苗市場監(jiān)管涉及預(yù)防醫(yī)學(xué)����、基礎(chǔ)醫(yī)學(xué)、藥學(xué)����、生物科學(xué)等多個專業(yè)領(lǐng)域,在遇到某些專業(yè)性極強(qiáng)的突發(fā)事件時����,僅僅依靠體系內(nèi)部專家很難解決所有問題。因此建議各單位之間可以聯(lián)合設(shè)置外部專家?guī)?���,在條件允許的情況下給予專家?guī)煲欢ǖ馁Y金配套,以便于在遇到突發(fā)性緊急事件時快速從專家?guī)熘羞x定人員進(jìn)行會商����,提高風(fēng)險應(yīng)對的效率與科學(xué)性����。
4.2 健全內(nèi)部溝通交流機(jī)制
現(xiàn)代疫苗生產(chǎn)工藝的高度專業(yè)性����、對特殊疾病的有效治療性,導(dǎo)致僅依靠藥品監(jiān)管部門無法完成對疫苗全方位的有效監(jiān)管����。多部門聯(lián)合監(jiān)管成為解決當(dāng)前疫苗市場監(jiān)管難題的有效方法之一。疫苗的市場監(jiān)管涉及衛(wèi)生健康����、藥品監(jiān)管、市場監(jiān)管����、司法等部門,在不良反應(yīng)監(jiān)測����、產(chǎn)品抽查檢驗、行政執(zhí)法����、刑事案件移送等各具體工作環(huán)節(jié)中均存在交叉與溝通。因此各部門之間需建立定期的溝通交流機(jī)制����,如疫苗管理聯(lián)席會議制度、定期開展聯(lián)合監(jiān)管工作計劃等����,堅持多方聯(lián)動,將藥品監(jiān)管����、衛(wèi)生健康、公安����、司法、財政����、醫(yī)保等相關(guān)部門聯(lián)系起來,統(tǒng)籌研究疫苗供應(yīng)儲備����、補(bǔ)償賠償����、流通秩序等重大問題����,并及時通報工作進(jìn)展情況,協(xié)同應(yīng)對公共衛(wèi)生等突發(fā)事件����,共同保障人民群眾生命安全和身體健康。
4.3 重視基層疫苗市場監(jiān)管
基層疫苗市場監(jiān)管作為面向群眾的終端直接影響著人民用藥安全����,各區(qū)縣疫苗市場監(jiān)管執(zhí)法環(huán)境復(fù)雜,監(jiān)管對象眾多����,而我國疫苗市場監(jiān)管體系存在人員結(jié)構(gòu)欠合理現(xiàn)象。因此我國應(yīng)重視基層疫苗市場監(jiān)管人才需求����,優(yōu)化基層人員配置,通過暢通人才發(fā)展渠道����、規(guī)范人員培訓(xùn)機(jī)制以及建立外部專家?guī)斓确绞轿{和培養(yǎng)優(yōu)秀人才以緩解現(xiàn)有基層疫苗市場監(jiān)管人員短缺現(xiàn)狀����。其次����,通過定期開展培訓(xùn)工作提升監(jiān)管人員個人業(yè)務(wù)水平����,應(yīng)用信息技術(shù)監(jiān)管手段,優(yōu)化監(jiān)管流程����,也可減少人力投入成本,一定程度上緩解基層監(jiān)管人員工作壓力����。另外,建議加大基層疫苗常規(guī)����、應(yīng)急設(shè)備的資金投入,確?���;鶎釉O(shè)施配備齊全����。
4.4 確保公眾行使監(jiān)督權(quán)
為確保公眾可以舉報疑似偽劣疫苗產(chǎn)品����,MC04.05 亞指標(biāo)要求NRA 應(yīng)具備允許公眾舉報疑似偽劣醫(yī)療產(chǎn)品的書面的、已實施的程序����,在理想情況下,舉報程序應(yīng)簡單易操作����。人民群眾知曉疫苗詳細(xì)信息可促進(jìn)其行使監(jiān)督權(quán),壯大我國疫苗市場監(jiān)管力量����。建議借助媒體、官網(wǎng)等公共信息服務(wù)平臺宣傳公眾舉報偽劣疫苗平臺或通道����,加大對疫苗生產(chǎn)企業(yè)安全信用評級、疫苗采購����、招標(biāo)信息����、效用情況以及公眾舉報偽劣疫苗案件調(diào)查結(jié)果等信息的公開力度����,公開內(nèi)容要盡可能廣泛全面并且使用通俗易懂的語言?���?梢赃M(jìn)一步規(guī)范公眾舉報辦理程序����,做到“三及時”(及時告知受理情況,及時跟進(jìn)查辦進(jìn)度����,及時反饋調(diào)查處理結(jié)果),全過程接受群眾監(jiān)督����。此舉可打消部分群體對疫苗安全的顧慮,逐步建立起公眾對我國疫苗市場監(jiān)管體系的信心����。
4.5 推行標(biāo)準(zhǔn)化����、程序化監(jiān)管
標(biāo)準(zhǔn)化簡單地說就是能夠?qū)崿F(xiàn)“整齊劃一”����,提倡材料電子信息化管理,做到上傳下達(dá)有條理����,材料分類有目錄,監(jiān)管記錄及時匯總����。標(biāo)準(zhǔn)化并不等同于“雷同”,一項程序因部門職能或地區(qū)不同并不適用于所有同類型單位����,因此可以按照自身特色對程序文件適當(dāng)進(jìn)行修正和轉(zhuǎn)化,形成部門專屬程序指南����。在潛移默化中逐步培養(yǎng)監(jiān)管人員“程序化”理念,以最少的成本消耗換取同樣多的法律公正����,向社會昭示其行為并不是恣意的產(chǎn)物����,切實增強(qiáng)監(jiān)管可信度����。
4.6 督促疫苗上市許可持有人落實質(zhì)量主體責(zé)任
“好疫苗”是設(shè)計和生產(chǎn)出來的,而不是監(jiān)管出來的����。因此NRA 在履行市場監(jiān)管義務(wù)的同時,也要做好企業(yè)的服務(wù)者和引導(dǎo)者����,充分發(fā)揮政策導(dǎo)向的積極作用����,督促企業(yè)主動承擔(dān)疫苗質(zhì)量安全主體責(zé)任。在為企業(yè)解決“共性問題”的同時����,也要重視企業(yè)的“個性問題”,深入了解企業(yè)需求和顧慮����,必要時給予一定政策幫扶����,讓企業(yè)不害怕解決問題����,主動加強(qiáng)與藥品監(jiān)管部門的聯(lián)系與合作,及時報告收集到的疫苗不良反應(yīng)信息����。NRA 可定期與企業(yè)開展疫苗質(zhì)量安全風(fēng)險交流會,督促企業(yè)建立疫苗儲運����、預(yù)防接種監(jiān)管檔案和臺賬,鼓勵企業(yè)開發(fā)疫苗上市后安全性檢測網(wǎng)絡(luò)和數(shù)據(jù)分析系統(tǒng)����,利用信息化手段有效預(yù)防、積極應(yīng)對疫苗質(zhì)量安全風(fēng)險����,最大限度減小疫苗產(chǎn)品質(zhì)量安全事件的危害。
4.7 建立疫苗市場監(jiān)管體系內(nèi)審機(jī)制
WHO 鼓勵其成員國開展自我評估以加強(qiáng)國家疫苗監(jiān)管體系����,各國可在WHO 的支持下進(jìn)行自查以確定現(xiàn)有監(jiān)管體系的優(yōu)勢并改正缺陷����。我國開展內(nèi)審工作既是迎接WHO 疫苗NRA 評估的預(yù)演����,也是對現(xiàn)有體系的梳理和優(yōu)化。建議我國制定高效完善的機(jī)構(gòu)內(nèi)自查工作程序����,建立起“自上而下”的部門績效考核制度,根據(jù)各監(jiān)管部門職能合理制定關(guān)鍵績效指標(biāo)����,充分發(fā)揮疫苗監(jiān)管系統(tǒng)如疫苗追溯監(jiān)管系統(tǒng)、藥品抽檢系統(tǒng)����、電子政務(wù)系統(tǒng)等的作用����,及時識別、分析和評價體系內(nèi)部潛在工作風(fēng)險����,高度重視內(nèi)審發(fā)現(xiàn)的問題����,利用機(jī)構(gòu)內(nèi)部自查進(jìn)一步優(yōu)化升級現(xiàn)有疫苗市場監(jiān)管體系����。
4.8 加強(qiáng)疫苗市場監(jiān)管國際交流
疫苗安全問題是全球熱點性問題,WHO 已充分意識到各國藥品監(jiān)管當(dāng)局合作性組織在促進(jìn)各國藥品監(jiān)管機(jī)構(gòu)交換信息和開展多方協(xié)作方面的重要作用[15]����。國際藥品監(jiān)管機(jī)構(gòu)聯(lián)盟(International Coalition of Medicines Regulatory Authorities,ICMRA)是一個由來自世界各個地區(qū)的主要藥品監(jiān)管機(jī)構(gòu)組成的國際執(zhí)行層面的聯(lián)盟����,能夠在國際面臨共同監(jiān)管問題和挑戰(zhàn)時發(fā)揮戰(zhàn)略領(lǐng)導(dǎo)作用[16]。我國國家藥品監(jiān)督管理局作為國際藥品監(jiān)管機(jī)構(gòu)聯(lián)盟的成員之一����,應(yīng)充分利用此國際平臺, 根據(jù)WHO 現(xiàn)有指導(dǎo)原則和指南積極參與現(xiàn)有國際和區(qū)域疫苗市場監(jiān)管行動����,及時共享全球疫苗熱點問題,如不合格和偽劣疫苗事件的調(diào)查結(jié)果和監(jiān)管決策����,為保障全球疫苗供應(yīng)鏈安全貢獻(xiàn)力量����。
4.9 吸收國際疫苗市場監(jiān)管理念
第三次NRA 評估并不是WHO 對我國疫苗監(jiān)管體系評估的終點而是我國疫苗“走出去”的一個重要轉(zhuǎn)折點����。GBT 是客觀評估藥品和國家疫苗監(jiān)管能力的全球標(biāo)準(zhǔn),其具有“持續(xù)更新”的特點����。該工具未來迭代會產(chǎn)生Plus 版本,適用范圍進(jìn)一步擴(kuò)展至血液制品及醫(yī)療器械監(jiān)管領(lǐng)域����。我國應(yīng)將WHO 疫苗NRA 評估作為提升我國整體市場監(jiān)管體系的契機(jī),拓寬監(jiān)管思路����,將GBT工具中的指標(biāo)要求結(jié)合我國實際監(jiān)管情況進(jìn)行篩選和修改并推廣至藥品監(jiān)管,建立一套與國際接軌����、與時俱進(jìn)的醫(yī)療產(chǎn)品市場監(jiān)管體系����。
引用本文
張慧茹,宋英杰,臧恒昌*,王鳳山*.WHO 疫苗國家監(jiān)管體系評估中市場監(jiān)管板塊指標(biāo)淺析與啟示[J].中國食品藥品監(jiān)管,2023(06):30-39.



