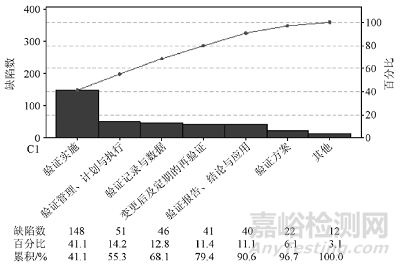
工藝驗(yàn)證在GMP 中的重要地位決定了其必然會(huì)成為全球各類藥品檢查的主要內(nèi)容��。事實(shí)上��,在藥品檢查工作中����,藥品工藝驗(yàn)證也是發(fā)現(xiàn)問(wèn)題較為集中的部分�����。國(guó)家局核查中心的幾位檢查員在2021年發(fā)布的《工藝驗(yàn)證檢查缺陷分析》[1]一文中��,對(duì)我國(guó)境內(nèi)約300 家藥品生產(chǎn)企業(yè)2018—2020 年工藝驗(yàn)證相關(guān)的檢查缺陷進(jìn)行了梳理�����,如圖1�����。
圖1. 近年來(lái)各類檢查發(fā)現(xiàn)工藝驗(yàn)證相關(guān)缺陷排列圖
1.驗(yàn)證實(shí)施
驗(yàn)證實(shí)施方面的內(nèi)容約占工藝驗(yàn)證全部缺陷的 41%����,是問(wèn)題最為集中的部分。常見(jiàn)問(wèn)題包括:驗(yàn)證內(nèi)容未能有效證明生產(chǎn)工藝的穩(wěn)定性和適用性��,涉及未基于風(fēng)險(xiǎn)進(jìn)行 CPP 及CQA 評(píng)估與識(shí)別�����、對(duì)部分 CPP 驗(yàn)證不充分����、缺少部分 CQA 檢測(cè)評(píng)估、未對(duì) CPP 可變空間進(jìn)行驗(yàn)證����、工藝驗(yàn)證不能代表實(shí)際生產(chǎn)情況、未對(duì)最差條件(如除菌過(guò)濾最長(zhǎng)時(shí)間����、滅菌前最長(zhǎng)存放時(shí)間等)進(jìn)行驗(yàn)證、工藝驗(yàn)證未包括全部生產(chǎn)工序(如缺少中藥材前處理與提取����、原料藥粉碎����、內(nèi)包裝等)����、取樣檢測(cè)頻率過(guò)低、取樣代表性不足�����、多臺(tái)生產(chǎn)設(shè)備工藝驗(yàn)證矩陣設(shè)計(jì)不合理��、驗(yàn)證過(guò)程中出現(xiàn)的偏差顯示工藝穩(wěn)定性不足等����。
2.驗(yàn)證管理、計(jì)劃與執(zhí)行
工藝驗(yàn)證的管理����、計(jì)劃與執(zhí)行是驗(yàn)證工作開(kāi)展的基本框架與總體要求,該部分缺陷位列第 2 位�����,占比約 14. 2%��。常見(jiàn)問(wèn)題包括:工藝驗(yàn)證管理程序規(guī)定不合理或不明確����,如未明確工藝驗(yàn)證不可以采用回顧性驗(yàn)證的方式開(kāi)展、未規(guī)定如何基于風(fēng)險(xiǎn)確定關(guān)鍵工藝參數(shù)����、未明確連續(xù)驗(yàn)證三批的要求、直接規(guī)定工藝驗(yàn)證批次為 3 批的合理性�����、未規(guī)定驗(yàn)證批次放行上市的條件與要求等�����。
3.驗(yàn)證記錄與數(shù)據(jù)
驗(yàn)證記錄與數(shù)據(jù)方面最核心的問(wèn)題是數(shù)據(jù)可靠性問(wèn)題�����,主要涉及數(shù)據(jù)管理基本原則: 可溯��、清晰�����、同步、原始����、準(zhǔn)確、完整��、一致��、持久與可獲得��。常見(jiàn)問(wèn)題包括:記錄信息不完整�����,如未記錄工藝驗(yàn)證生產(chǎn)房間��、設(shè)備��、參數(shù)�����、全部操作人員�����、取樣操作、過(guò)程中的偏差等信息����。
4.變更與再驗(yàn)證
由于設(shè)備老化��、需求增加及質(zhì)量改進(jìn)等原因�����,藥品生產(chǎn)條件不可能一直不變����,這就需要做好變更控制和必要的工藝再驗(yàn)證。常見(jiàn)問(wèn)題包括:重大變更未重新進(jìn)行必要的工藝驗(yàn)證�����,如變更關(guān)鍵物料供應(yīng)商�����、原料藥生產(chǎn)工藝及質(zhì)量標(biāo)準(zhǔn)變更����、重大批量變更��、新增或更換關(guān)鍵生產(chǎn)設(shè)備����、調(diào)整生產(chǎn)處方��、同期開(kāi)展的多個(gè)變更共同作用可能對(duì)產(chǎn)品質(zhì)量造成影響等�����。
5.驗(yàn)證報(bào)告����、結(jié)論與應(yīng)用
驗(yàn)證報(bào)告是驗(yàn)證執(zhí)行情況的總結(jié),其中包括工藝驗(yàn)證的全部信息與結(jié)論�����,驗(yàn)證的結(jié)果必須與實(shí)際生產(chǎn)結(jié)合應(yīng)用��。常見(jiàn)問(wèn)題包括:驗(yàn)證報(bào)告信息不全�����,如缺少對(duì)驗(yàn)證前狀態(tài)確認(rèn)情況、批量����、物料加入量、關(guān)鍵操作時(shí)限����、各工序收率、烘干翻盤(pán)次數(shù)����、部分工序參數(shù)及中控結(jié)果等����,未對(duì) CPP 及 CQA 進(jìn)行統(tǒng)計(jì)分析。
6.驗(yàn)證方案
驗(yàn)證方案用于指導(dǎo)��、規(guī)范工藝驗(yàn)證工作的開(kāi)展��,常見(jiàn)問(wèn)題包括:驗(yàn)證方案中對(duì)取樣規(guī)定不明確��,如取樣點(diǎn)����、取樣工具、樣品包裝與儲(chǔ)存、取樣記錄�����。
7.其他
其他方面的問(wèn)題涉及持續(xù)工藝確認(rèn)�����、工藝驗(yàn)證批留樣��、工藝驗(yàn)證中崗位職責(zé)規(guī)定等方面����。常見(jiàn)問(wèn)題包括:持續(xù)工藝確認(rèn)存在不足,如未基于風(fēng)險(xiǎn)確認(rèn)分析的頻次與項(xiàng)目�����,未對(duì) CPP 及 CQA 進(jìn)行統(tǒng)計(jì)學(xué)的趨勢(shì)分析以確認(rèn)工藝處于受控狀態(tài)等��。
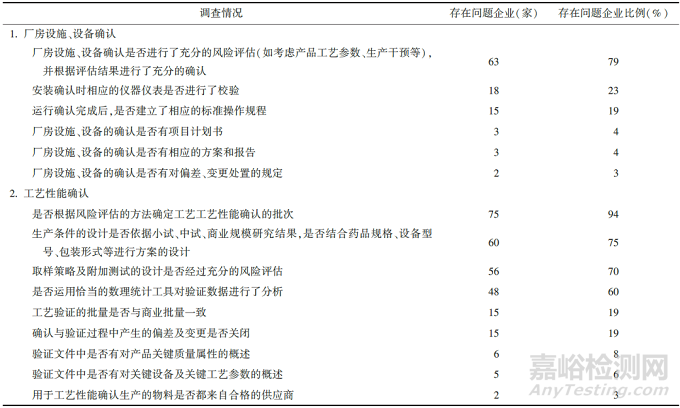
此外��,學(xué)術(shù)界和工業(yè)界的幾位老師�����,也在近年發(fā)表過(guò)文章《我國(guó)藥品首次工藝驗(yàn)證存在問(wèn)題及探討》[2],對(duì)我國(guó)80家藥企執(zhí)行首次工藝驗(yàn)證情況進(jìn)行調(diào)查�����,調(diào)查內(nèi)容和結(jié)果見(jiàn)表1����。
表1. 我國(guó)藥企執(zhí)行首次工藝驗(yàn)證情況調(diào)查表
首次工藝驗(yàn)證在產(chǎn)品生命周期中的驗(yàn)證過(guò)程中起著承上啟下的作用,一方面可以發(fā)現(xiàn)在研發(fā)設(shè)計(jì)階段存在的缺陷并加以改進(jìn)����,另一方面為后續(xù)持續(xù)工藝確認(rèn)階段的開(kāi)展提供數(shù)據(jù)及技術(shù)支持,首次工藝驗(yàn)證的成功����,是產(chǎn)品生命周期的一個(gè)重要的里程碑����。
在剛出版的新版GMP指南中,工藝驗(yàn)證也是討論和修訂的重點(diǎn)話題之一����。如口服固體分冊(cè),強(qiáng)化了生命周期工藝驗(yàn)證管理����,包括工藝設(shè)計(jì)��、工藝確認(rèn)����、持續(xù)工藝確認(rèn)��。以目標(biāo)產(chǎn)品質(zhì)量概況為出發(fā)點(diǎn)�����,建立基于風(fēng)險(xiǎn)管理的工藝驗(yàn)證模式��,取消回顧性驗(yàn)證�����,增加持續(xù)工藝確認(rèn)��,并引入“設(shè)計(jì)空間”的概念�����;質(zhì)量體系分冊(cè)����,強(qiáng)化工藝驗(yàn)證全生命周期理念����,細(xì)化了工藝設(shè)計(jì)和持續(xù)工藝確認(rèn)細(xì)節(jié)描述�����,增加連續(xù)工藝驗(yàn)證��、工藝性能確認(rèn)中括號(hào)法��、矩陣法和分組法的介紹��;原料藥分冊(cè)����,基于生命周期的工藝驗(yàn)證理念,豐富工藝設(shè)計(jì)和持續(xù)工藝確認(rèn)(確證)的內(nèi)容��。
科學(xué)����、有效的工藝驗(yàn)證是確保持續(xù)穩(wěn)定生產(chǎn)出符合預(yù)定用途和注冊(cè)標(biāo)準(zhǔn)藥品的重要措施����,是證明藥品質(zhì)量始終一致的重要證明�����。
參考資料:
[1] 翟鐵偉,顏若曦,王立杰. 工藝驗(yàn)證檢查缺陷分析[J]. 中國(guó)藥物評(píng)價(jià),2021,38(5):380-382.
[2] 賈欣秒,楊悅,趙儉. 我國(guó)藥品首次工藝驗(yàn)證存在問(wèn)題及探討[J]. 中國(guó)藥物評(píng)價(jià), 2018, 35(2):148-153.