歐洲時間7月17日,歐盟發(fā)布《關(guān)于非歐盟/歐洲經(jīng)濟區(qū)國家當(dāng)局醫(yī)療器械和體外診斷醫(yī)療器械的情況說明》《Factsheet for authorities in non-EU/EEA states on medical devices and in vitro diagnostic medical devices》����,具體說明MDR/IVDR過渡期修改的相關(guān)事宜,適用于非歐盟����、非歐洲經(jīng)濟區(qū)主管當(dāng)局����、海關(guān)���、經(jīng)銷商等參考和查閱����。
該情況說明指出:計劃向歐盟市場投放醫(yī)療器械的第三國制造商���,應(yīng)熟悉歐盟法規(guī)關(guān)于過渡期的規(guī)則���、時間表和義務(wù)。
該情況說明書進一步解釋了確切的過渡期時間表����。
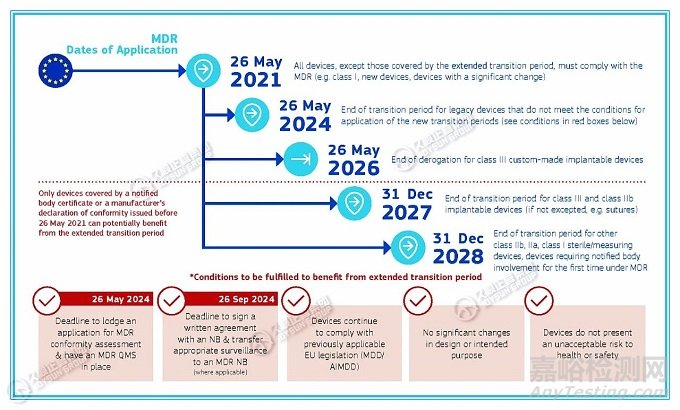
MDR過渡期時間表
2021年5月26日:所有器械,除過渡期延長所覆蓋的器械以外�,必須符合MDR(例如:I類、新器械���、有重大變化的器械);
2024年5月26日:不滿足新過渡期應(yīng)用條件的遺留器械的過渡期結(jié)束���;
2026年5月26日:III類定制植入器械的過渡期終止����;
2027年12月31日:III類、IIb類可植入式器械的過渡期結(jié)束(如縫合線)���;
2028年12月31日:其他類IIb���、IIa、I類無菌/測量器械����、MDR下首次需要公告機構(gòu)參與的器械的過渡期結(jié)束。
注意:僅限于2021年5月26日之前發(fā)布的公告機構(gòu)證書或制造商的合格聲明所涵蓋的器械�,才能從過渡期延長中受益。
*從過渡期延長中受益�,所需滿足的條件:
2024年9月26日:提交MDR合格評定申請并已建立MDR質(zhì)量管理體系的最后期限;
2024年9月26日:與NB簽署書面協(xié)議并將適當(dāng)?shù)谋O(jiān)督轉(zhuǎn)移至MDR公告機構(gòu)(如適用)的最后期限����;
器械繼續(xù)遵守先前適用的歐盟法規(guī)(MDD/ AIMDD);
設(shè)計或預(yù)期目的無重大變化���;
器械不會對健康或安全構(gòu)成不可接受的風(fēng)險���。
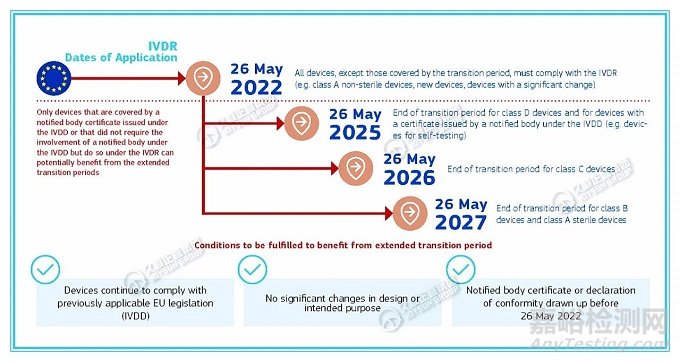
IVDR過渡期時間表
2022年5月26日:除過渡期間所涵蓋的器械外����,所有器械都必須符合IVDR標(biāo)準(zhǔn)(例如:A類非無菌器械���、新器械�、有重大變化的器械)���;
2025年5月26日:D類器械�、具有IVDD下公告機構(gòu)頒發(fā)的證書的器械(例如:用于自我測試的器械)的過渡期結(jié)束�;
2026年5月26日:C類器械的過渡期結(jié)束;
2027年5月26日:B類器械和A類無菌裝置過渡期結(jié)束�。
注意:僅限于IVDD下頒發(fā)的公告機構(gòu)證書所覆蓋器械,或無需IVDD下公告機構(gòu)參與但需要IVDR下公告機構(gòu)參與的器械,才能從過渡期延長中受益。
*從過渡期延長中受益����,所需滿足的條件:
器械繼續(xù)遵守先前適用的歐盟法規(guī)(IVDD);
設(shè)計或預(yù)期目的無重大變化�;
2022年5月26日前起草的公告機構(gòu)證書或符合性聲明。
→歐盟MDR\IVDR拿證難度高\要求嚴(yán)\時間久����,高效高速的合規(guī)準(zhǔn)入服務(wù)是成敗之關(guān)鍵���!
【久順企管集團】愿成為您合規(guī)道路的加速引擎����!始創(chuàng)于1996年,近30年全球合規(guī)技術(shù)專家���、近20年資深歐代���,荷蘭、英國���、美國���、中國均設(shè)公司。
> 呈獻全程高效的歐盟合規(guī)服務(wù):
√ 歐盟CE注冊取證����;
√ 技術(shù)文檔編寫;
√ 合規(guī)策略����;
√ 體系輔導(dǎo)���;
√ 上市后監(jiān)督咨詢;
>已成功布局歐盟臨床試驗渠道���,提供歐盟臨床試驗一站式CRO服務(wù):
√ 臨床方案設(shè)計���、臨床試驗方案的撰寫;
√ 與當(dāng)?shù)貙嶒炇?醫(yī)院合作�,安排客戶試驗產(chǎn)品合規(guī)開展臨床試驗;
√ 包括但不限于:收集\整理\分析試驗原始數(shù)據(jù)并出具臨床試驗報告����。