2023年全國醫(yī)療器械安全宣傳周7月10日在京啟動���。本屆“全國醫(yī)療器械安全宣傳周”為期一周�,以“安全用械 共享健康”為主題�,藥品監(jiān)管系統(tǒng)將圍繞活動主題組織開展一系列宣傳活動。
而飛檢�,作為懸在醫(yī)療器械企業(yè)頭頂?shù)倪_摩克利斯劍,為保證醫(yī)療器械安全發(fā)揮了重要作用����。所以本文小編結合最近在宣傳周學習到的知識,跟大家一起梳理飛檢相關的要點�,供各位參考。
監(jiān)管部門的檢查方式
監(jiān)管部門對于企業(yè)的檢查分為注冊申請階段和上市后階段兩部分���。
注冊核查:在注冊申請階段���,監(jiān)管部門依據(jù)《醫(yī)療器械注冊質量管理體系核查指南》對注冊申請人進行核查�;
飛行檢查:取得注冊證后,監(jiān)管部門則依據(jù)《藥品醫(yī)療器械飛行檢查辦法》《醫(yī)療器械生產(chǎn)質量管理規(guī)范》及其附錄對注冊人進行監(jiān)督檢查�;
飛行檢查簡介
《藥品醫(yī)療器械飛行檢查辦法》對飛檢進行了定義:
醫(yī)療器械飛行檢查,是指藥品監(jiān)督管理部門針對醫(yī)療器械研制�、生產(chǎn)、經(jīng)營�、使用等環(huán)節(jié)開展的不預先告知的監(jiān)督檢查����。
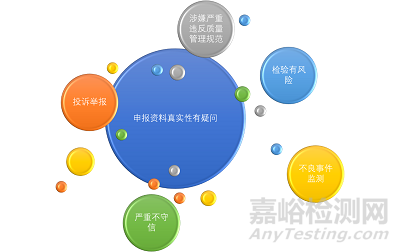
有下列情形之一的���,藥品監(jiān)督管理部門可以開展醫(yī)療器械飛行檢查:
?���。ㄒ唬┩对V舉報或者其他來源的線索表明可能存在質量安全風險的���;
?。ǘz驗發(fā)現(xiàn)存在質量安全風險的���;
?。ㄈ┽t(yī)療器械不良事件監(jiān)測提示可能存在質量安全風險的�;
(四)對申報資料真實性有疑問的���;
?���。ㄎ澹┥嫦訃乐剡`反質量管理規(guī)范要求的�;
?���。┢髽I(yè)有嚴重不守信記錄的�;
(七)其他需要開展飛行檢查的情形����。
飛檢常見6大問題分析
變更控制程序未有效執(zhí)行
從產(chǎn)品研發(fā)到正式生產(chǎn),往往會發(fā)生較多變更���,小到物料供應商的改變���、包裝材料的改變,大到產(chǎn)品性能或預期用途的改變生產(chǎn)場地的改變����,都要履行變更控制程序,按照規(guī)范的要求開展變更情況的風險分析����、評審以及相應的驗證工作�。
但現(xiàn)場檢查發(fā)現(xiàn)企業(yè)發(fā)生變更后,往往都沒有經(jīng)過風險分析和評審過程就直接開始做驗證����,有些甚至連驗證工作都未完成����,就已按變更后的工藝組織生產(chǎn)����。
人員培訓不到位
在質量體系運行情況的檢查過程中,經(jīng)常會發(fā)現(xiàn)人員實際操作與相應作業(yè)指導書規(guī)定不一致�、需要填寫的過程記錄不全、人員對相關崗位的要求不熟悉等等問題����。這些缺陷問題充分暴露企業(yè)培訓工作不到位,存在人員資質考核���、培訓方面重形式輕實踐的現(xiàn)象����。
產(chǎn)品未按經(jīng)批準的技術要求或程序文件規(guī)定組織生產(chǎn)
生產(chǎn)不符合經(jīng)注冊或者備案的產(chǎn)品技術要求的醫(yī)療器械�、生產(chǎn)不符合程序文件規(guī)定工藝規(guī)程的醫(yī)療器械,均屬于違反《醫(yī)療器械監(jiān)督管理條例》的行為�。生產(chǎn)企業(yè)一般不會有明顯的違法違規(guī)行為,現(xiàn)場檢查發(fā)現(xiàn)的一些與技術要求工藝規(guī)程不一致的行為,往往存在于細微處���,如某組成部件的尺寸與批準信息不一致����、某性能的檢驗方式與技術要求不一致����、某生產(chǎn)工藝所用清洗劑的成分與規(guī)程不一致、某工序的個別參數(shù)與規(guī)程不一致等�。
產(chǎn)品生產(chǎn)過程記錄不全,追溯性存在風險
對產(chǎn)品生產(chǎn)過程記錄和追溯性要求���,體現(xiàn)在產(chǎn)品從原材料到成品的每一個物料和每一道工序���,部分生產(chǎn)企業(yè)的生產(chǎn)批記錄表單設置過于簡單,僅有原材料信息和成品信息�,中間品批號、工藝參數(shù)記錄不全����。并且由于對過程記錄的不重視,導致生產(chǎn)批記錄與其他記錄����,如生產(chǎn)設備的運行記錄、中間品倉庫的出入庫記錄�、中間品檢測記錄等,出現(xiàn)批號不一致�、數(shù)量不一致等情況,從而出現(xiàn)追溯性問題���。
產(chǎn)品檢驗原始記錄不全����、未按技術要求或檢驗規(guī)程進行檢驗
檢查發(fā)現(xiàn)部分企業(yè)的檢驗原始記錄不規(guī)范����、追溯性不強,尤其是微生物化學性能等檢驗過程復雜的檢測項目�,缺少關鍵步驟、關鍵試劑等信息有些檢驗方式方法與標準不一致����、檢驗方法未經(jīng)驗證,如微生物試驗平行對照管的數(shù)量���、EO殘留量標準曲線濃度范圍等���;甚至有的還未完成最終檢驗就已出廠銷售���。存在檢驗過程規(guī)范性和真實性問題。
產(chǎn)品狀態(tài)標識不清�,不合格品未按程序進行識別并處理
狀態(tài)標識,尤其是檢驗狀態(tài)標識是區(qū)分一個物料�、中間品或成品是否可以放行到下一道工序的關鍵標識,在飛行檢查中���,發(fā)現(xiàn)企業(yè)對中間品的狀態(tài)標識比較容易忽略���,或者是習慣于完成整批成品后再一次性進行標識,導致在生產(chǎn)過程中�,有部分中間品或成品已完成生產(chǎn),但缺少狀態(tài)標識���。也有不合格品已放置在了不合格品區(qū)域內(nèi)���,但缺少對應的檢驗記錄和不合格處理記錄。
缺陷的類別
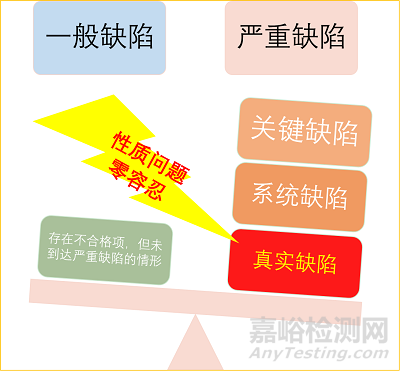
一般缺陷
非標星類的缺陷����,最為常見�,未到達嚴重缺陷的情形�。
嚴重缺陷
(1) 關鍵缺陷:
Ø 未按規(guī)定對特殊過程和關鍵工序進行 (再) 驗證或確認;
Ø 生產(chǎn)、采購����、檢驗���、銷售記錄未滿足追溯性要求
Ø 企業(yè)未根據(jù)強制性標準以及經(jīng)注冊的產(chǎn)品技術要求制定產(chǎn)品的檢驗規(guī)程或檢驗報告和檢驗規(guī)程不致����。
(2) 系統(tǒng)缺陷:
Ø 多個部門或多個生產(chǎn)檢驗環(huán)節(jié)發(fā)現(xiàn)同類不符合項;
Ø 同一部門多次重復發(fā)生同類不符合項�,未采取有效的糾正措施加以消除
Ø 同一生產(chǎn)檢驗工序存在多類別不符合項
(3) 真實缺陷:
隱瞞有關情況,提供虛假資料�。一再強調,真實性問題是性質問題����,態(tài)度是零容忍。
檢查老師的關注點
設計變更
產(chǎn)品生產(chǎn)過程(生產(chǎn)工藝���、生產(chǎn)環(huán)境���、生產(chǎn)設備���、關鍵原材料等等) 是否發(fā)生變更,如有:
企業(yè)是否評價變更可能帶來的風險;
企業(yè)是否采取必要的措施將風險降低到可接受水平;
變更的內(nèi)容和結果涉及到改變醫(yī)療器械注冊證和生產(chǎn)許可證所載明的內(nèi)容時�,企業(yè)是否按相關法規(guī)的要求,辦理變更
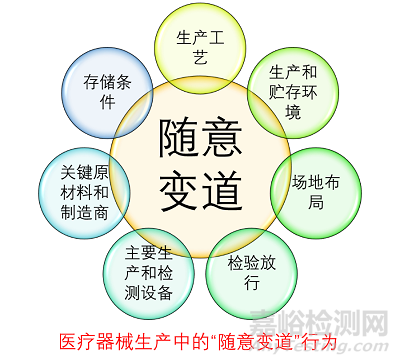
醫(yī)療器械生產(chǎn)中的“隨意變道”行為
能夠識別并開展設計變更���,已經(jīng)是有質量體系意識的了���。更嚴重的,是在體系運行過程中隨意變換�,不進行變更控制。主要涉及的環(huán)節(jié)如下圖:
企業(yè)“迎檢” V.S. 檢查組“反迎檢”
最后進入彩蛋部分�,關于企業(yè)“迎檢”和檢查組“反迎檢”技巧進行交流。
正所謂����,魔高一尺道高一丈,我們坊間流行的迎檢技巧�,在檢查老師那里早已了如指掌,而且都有針對性的應對方案���。比如說:
技巧1: 準備間(侯檢室)每個檢查員都有專門的主答人員���、記錄人���、拿資料人及聯(lián)絡人記錄所有提出的問題、所有看過的資料
應對:面對陣仗比較大的情況����,越是模糊的地方越要查的更清楚;越是熱情的公司查的越狠�;
技巧2:固定陪同人員和路線,避過不希望被看到的地方
應對:越是一塵不染�,越要查到“不干凈”的地方
技巧3:提供資料時間15-30分鐘���,不要快也不要慢
應對:資料提供超時不認�;需要提供的資料落在紙面�,避免遺忘
技巧4:文件、數(shù)據(jù)怎么給�,解釋的時候有引導性
由負責或熟悉的人員來解釋相關文件、數(shù)據(jù)���,并劃出重點�,引導檢查員視線�,不問不說僅提供你要的文件或數(shù)據(jù),當提出需要繼續(xù)關聯(lián)的文件或數(shù)據(jù)���,則又是一個周期
應對:仔細閱讀檢查方案�,不可能面面俱到,抓“西瓜”
技巧5:在企業(yè)擅長的方面多說����,對可能有問題的部分,則提供大量清單����,且不標注,讓檢查員針對性下降�,轉移目標
應對:識破對方的“詭計”,關注實質與本質關注數(shù)據(jù)和證據(jù)
結束語
不論是飛行檢查和是迎接飛行檢查�,企業(yè)和監(jiān)管部門本身不是對立關系,大家是共同奮戰(zhàn)在健康事業(yè)里�,為了人民用械安全、有效這一共同目標而努力�。希望我們能夠打好基本功,多在產(chǎn)品研發(fā)����、安全生產(chǎn)、體系運營這些基本面下功夫����,至于所謂的技巧�,就如跳水動作一樣�,還是越少越安全。