今日頭條
德琪ERK1/2抑制劑上美國Ⅰ期臨床�。德琪醫(yī)藥在美國開展的小分子ERK1/2抑制劑ATG-017聯(lián)合PD-1療法納武利尤單抗治療晚期實體瘤的I期ERASER研究完成首例患者給藥。該項試驗擬評估ATG-017聯(lián)合用藥的安全性/耐受性、藥代動力學(xué)和初步療效�。該項研究的單藥療法部分目前正在澳大利亞順利推進。臨床前研究數(shù)據(jù)顯示�����,ERK1/2抑制劑聯(lián)合免疫檢查點抑制劑(ICI)具有協(xié)同抗腫瘤作用�����。
國內(nèi)藥訊
1.FDA完成替雷利珠單抗生產(chǎn)現(xiàn)場檢查�。百濟神州日前宣布,F(xiàn)DA已完成對其PD-1抑制劑替雷利珠單抗(tislelizumab�,百澤安)的生產(chǎn)檢查,預(yù)期替雷利珠單抗將在今年下半年在美國獲批���,用于二線治療不可切除或轉(zhuǎn)移性食管鱗狀細胞癌(ESCC)���。在全球III期研究RATIONALE 302中,替雷利珠單抗與化療相比平均延長患者2.3 個月的壽命�。如果獲批,替雷利珠單抗將成為首個進入美國市場的國產(chǎn)檢查點抑制劑�����。
2.恒瑞Aβ單抗早期臨床積極。恒瑞醫(yī)藥在2023AAIC會議上公布其Aβ單抗(IgG1 亞型)SHR-1707在中國與澳大利亞健康人中完成的單次劑量遞增的I期研究(NCT04973189�����、NCT04745104)積極結(jié)果�����。數(shù)據(jù)顯示���,在2-60 mg/kg的劑量范圍內(nèi),SHR-1707在年輕人中的暴露量以略大于劑量比例的方式增加���;血漿中Aβ 42水平及較基線變化呈現(xiàn)劑量依賴性�;藥物耐受性良好�。PK、PD數(shù)據(jù)支持進一步臨床研發(fā)�。
3.杭州啟函多位點基因編輯療法獲批臨床。啟函生物1類生物制品QN-019a細胞注射液獲國家藥監(jiān)局臨床試驗?zāi)驹S可�。啟函生物運用多位點基因編輯技術(shù)修改人源多能誘導(dǎo)干細胞(iPSC),并將其分化成為靶向CD19陽性B細胞腫瘤的自然殺傷細胞(NK)產(chǎn)品QN-019a�,擬開發(fā)用于治療CD19陽性的復(fù)發(fā)難治性侵襲性B細胞非霍奇金淋巴瘤(B-NHL)。
4.天澤云泰罕見病基因療法獲批臨床�。天澤云泰自主研發(fā)的1類生物藥VGM-R02b獲國家藥監(jiān)局臨床試驗?zāi)驹S可�����,擬開展用于戊二酸血癥I型(GA-I)治療的臨床研究�����。GA-I是一種罕見的常染色體隱性遺傳性神經(jīng)代謝性疾病���,已被列入我國《第一批罕見病目錄》。VGM-R02b也是該公司第三個獲批進入臨床的基因治療產(chǎn)品�,該產(chǎn)品已被FDA授予用于治療GA-I的罕見兒科疾病認定(RPDD)。
5.科興二價手足口疫苗獲批臨床���。科興生物開發(fā)的1.4類生物制品二價腸道病毒滅活疫苗獲國家藥監(jiān)局臨床試驗?zāi)驹S可���,擬開發(fā)用于接種后刺激機體產(chǎn)生抗EV71與CA16的免疫力,預(yù)防由EV71�、CA16感染所致手足口病。EV71和CA16是20余種手足口病致病病毒中最為常見的兩種病毒�����。此前���,該公司研發(fā)的益爾來福(腸道病毒71型滅活疫苗(Vero細胞))已獲批上市�,用于預(yù)防由EV71引起的手足口病。
國際藥訊
1.強生c-Met/EGFR雙抗肺癌III期臨床積極���。強生旗下楊森EGFR/MET雙抗amivantamab-vmjw(Rybrevant)一線治療EGFR外顯子20插入突變的晚期或轉(zhuǎn)移性非小細胞肺癌(NSCLC)的III期PAPILLON研究結(jié)果達到主要終點�。與單純化療相比���,Rybrevant聯(lián)合化療顯著改善患者的無進展生存期(PFS)���,藥物的安全性與已知研究一致。2021年5月���,F(xiàn)DA已加速批準該新藥上市,用于鉑類化療后進展的EGFR外顯子20插入突變的晚期或轉(zhuǎn)移性NSCLC患者�。
2.KOR拮抗劑抑郁癥Ⅱ期臨床積極。Neumora公司宣布將啟動一項評估新型κ阿片受體(KOR)拮抗劑navacaprant(NMRA-140)單藥治療重度抑郁癥的Ⅲ期臨床���。在Ⅱ期臨床中�����,在第4周和第8周時���,navacaprant治療較安慰劑顯著改善中重度MDD患者的17項漢密爾頓抑郁量表(HAMD-17)評分(-3.0�����,p=0.015�����;-2.8�,p=0.037)和快感缺乏量表(SHAPS)評分(-2.4�,p=0.071;-4.8���,p=0.001)�����;兩組治療伴發(fā)不良反應(yīng)發(fā)生率分別為35.3%和44.1%�����。
3.助聽器可降低認知衰退風險近50%���。科學(xué)家在AAIC2023會議上公布一項評估助聽器用于減少老年人長期認知功能下降的臨床試驗積極結(jié)果���。研究結(jié)果顯示,在具有輕中度聽力損失���,而且認知能力下降風險更高的老年人亞群中���,使用助聽器3年能夠?qū)⒄J知衰退風險降低接近一半(減緩48%)。詳細結(jié)果同時發(fā)表在醫(yī)學(xué)期刊《柳葉刀》上�����。
4.諾華10億美元收購siRNA藥物公司�����。諾華與神經(jīng)科學(xué)領(lǐng)域siRNA藥物公司DTx Pharma達成收購協(xié)議�����,獲得后者擬開發(fā)用于治療1A型Charcot-Marie-Tooth?。–MT1A)的先導(dǎo)候選藥物DTx-1252�����,以及另外兩個用于其他神經(jīng)科學(xué)適應(yīng)癥的臨床前項目。DTx-1252旨在通過靶向PMP22蛋白來解決CMT1A的根本原因,以恢復(fù)髓鞘的正常功能���。根據(jù)協(xié)議���,諾華將支付5億美元的預(yù)付款,最高5億美元的里程碑潛在付款�����。
5.AβO抗體臨床前數(shù)據(jù)積極���。ProMIS公司β-淀粉樣蛋白寡聚體(AβO)抗體PMN310在AAIC會議上公布用于治療阿爾茲海默病(AD)的臨床前積極數(shù)據(jù)�。表面等離子共振(SPR)結(jié)果顯示�,與其它Aβ抗體相比,PMN310能夠選擇性地結(jié)合AD患者腦提取物中的毒性AβO�����;除Acumen公司的Aβ抗體ACU193外���,PMN310對Aβ單體的結(jié)合能力也要小于包括渤健/衛(wèi)材的lecanemab和禮來的donanemab等在內(nèi)的其它Aβ抗體���。此外�,PMN310也顯示出完整保護記憶功能的潛力���。
6.輝瑞聯(lián)手Flagship開發(fā)10個創(chuàng)新候選藥���。輝瑞與Flagship Pioneering公司將利用后者旗下40多家藥物研發(fā)公司和多個生物技術(shù)平臺,針對輝瑞核心戰(zhàn)略興趣領(lǐng)域�����,合作開發(fā)10個創(chuàng)新候選藥物�����。根據(jù)協(xié)議���,F(xiàn)lagship和輝瑞將各自投入5000萬美元款項�����;輝瑞將資助并有選擇權(quán)收購每個選定的開發(fā)項目�����;Flagship及其生物平臺公司將有資格獲得每個產(chǎn)品高達7億美元的里程碑和特許權(quán)使用款項���。
醫(yī)藥熱點
1.美首例機器人肝移植手術(shù)成功。據(jù)美國圣路易斯華盛頓大學(xué)醫(yī)學(xué)院官網(wǎng)報道���,該院一個外科團隊今年5月完成美國首例機器人肝臟移植手術(shù)�����。術(shù)后一個月���,患者不僅行走自如,還恢復(fù)一定的運動能力���。此次成功意味著微創(chuàng)機器人手術(shù)的優(yōu)勢擴展到肝臟移植領(lǐng)域�,可實現(xiàn)更小切口�����、更少疼痛和更快恢復(fù)�,并且具備最有挑戰(zhàn)性的腹部手術(shù)之一所需的精確度。
2.全球首個胰腺保護指南發(fā)布�����。7月16日,由中國抗癌協(xié)會主辦的“中國腫瘤整合診治技術(shù)指南(CACA)-胰腺保護”精讀巡講活動在浙江杭州隆重舉辦�。《CACA技術(shù)指南-胰腺保護》是全球首個全面�、系統(tǒng)闡述如何保護來自多種腫瘤對胰腺損傷的指南。本指南的發(fā)布將為臨床及時發(fā)現(xiàn)腫瘤胰腺損傷并開展規(guī)范化診治提供開創(chuàng)性的重要指導(dǎo)�����。
3.國家高原病醫(yī)學(xué)中心設(shè)置標準發(fā)布���。國家衛(wèi)健委發(fā)布《國家高原病醫(yī)學(xué)中心設(shè)置標準》���。《設(shè)置標準》強調(diào)���,國家高原病醫(yī)學(xué)中心應(yīng)位于或毗鄰高原���,具備豐富的高原病診治經(jīng)驗,綜合診療能力突出�����,具有高水平的高原病學(xué)科帶頭人和專科人才梯隊�。同時�,要求已建立省級以上緊急醫(yī)學(xué)救援隊伍,近5年���,在超高海拔地區(qū)(海拔≥3500米)開展不少于3次高原衛(wèi)生應(yīng)急救援演練���。
評審動態(tài)
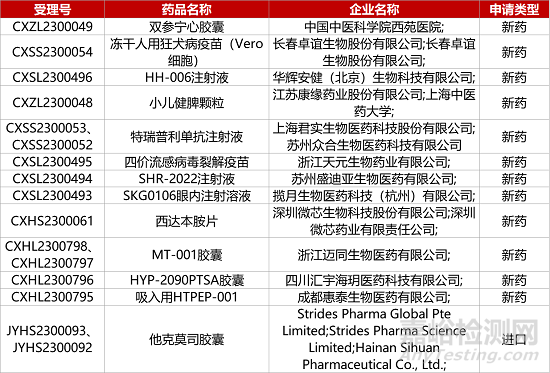
1. CDE新藥受理情況(07月19日)
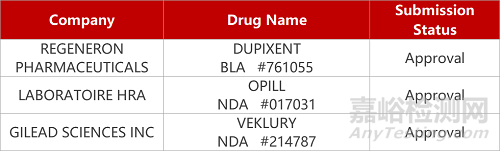
2. FDA新藥獲批情況(北美07月14日)