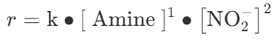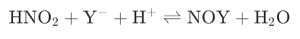前言
近年來(lái)�,關(guān)于藥品中亞硝胺污染物的存在和與致癌風(fēng)險(xiǎn)的關(guān)聯(lián)引起了廣泛的公眾關(guān)注����。特別是自華海制藥事件以來(lái)����,包括Sandoz���、輝瑞公司等國(guó)際大公司在內(nèi)的許多公司都因藥品中的亞硝胺超標(biāo)而被召回��,造成了巨大損失。因此�����,對(duì)亞硝胺的生成機(jī)制進(jìn)行全面了解�,并針對(duì)原料藥進(jìn)行合理的風(fēng)險(xiǎn)評(píng)估顯得尤為必要����。針對(duì)多種的亞硝胺生成機(jī)制�,本文提出了一套全新的符合現(xiàn)有認(rèn)知體系下的亞硝胺形成三要素����,為解決亞硝胺問(wèn)題提供更全面的評(píng)估手段���。
一、 亞硝胺生成的機(jī)制[1]
在進(jìn)行亞硝胺風(fēng)險(xiǎn)評(píng)估時(shí)��,通常認(rèn)為亞硝胺的生成需要三個(gè)要素:亞硝化試劑�、胺和酸性條件����。首先�����,為什么一定需要酸性條件呢�����?亞硝化試劑如亞硝酸鹽本身并不是有效的N-亞硝化試劑�����,但在弱酸性條件下可以形成更具反應(yīng)性的亞硝鎓離子鹽[NO]+或N2O3。
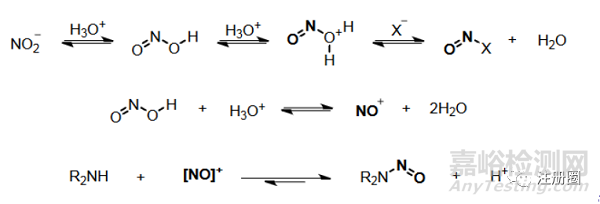
其次�����,如果不滿足這三個(gè)要素���,是否就不會(huì)存在亞硝胺的風(fēng)險(xiǎn)呢?事實(shí)上����,亞硝胺的合成可以通過(guò)多種不同途徑實(shí)現(xiàn)���。
1.胺的亞硝化�。(常見(jiàn)途徑)
(1)伯胺�。伯胺與亞硝酸一般是發(fā)生重氮化反應(yīng)�����,生成極不穩(wěn)定的重氮鹽����。重氮鹽即使在低溫下也會(huì)立即自動(dòng)分解。因此伯胺產(chǎn)生亞硝胺的風(fēng)險(xiǎn)最低��。
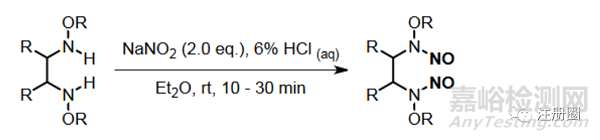
(2)仲胺����。二級(jí)胺(這里特指的是與N連接的R基團(tuán)為烷基或者芳香環(huán))易發(fā)生亞硝化反應(yīng)生成亞硝胺�。如下圖所示:

但其實(shí)任何含有NH基團(tuán)的化合物都可能容易發(fā)生親電性N-亞硝化反應(yīng)���,其中也包括(雜)酰胺�、氨基甲酸酯��、羥胺、羥胺醚��、肼��、肼酮����、肼酰肼���、尿素和鳥(niǎo)氨酸��。通常���,這些體系反應(yīng)性通常比二級(jí)胺低���,因?yàn)镹H官能團(tuán)的親核性較弱。
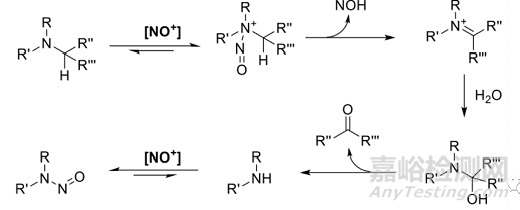
羥胺和肼類化合物是一個(gè)例外�,因?yàn)樗鼈兺ǔEc二級(jí)胺一樣具有親核性。如下圖所示:
(3)叔胺����。僅當(dāng)三級(jí)胺在氮原子α位帶有質(zhì)子時(shí)�����,它們才是適合的N-亞硝化底物����。通常情況下�����,與二級(jí)胺相比�,三級(jí)胺的反應(yīng)性顯著較低(據(jù)報(bào)道,反應(yīng)性低于二級(jí)胺1000倍以上)����,因?yàn)樗鼈冃枰~外的去烷基化步驟,α-CH鍵的斷裂被認(rèn)為是速率決定步驟�����。
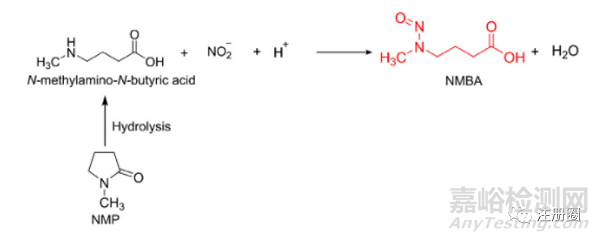
叔胺主要降解為二級(jí)胺后發(fā)生亞硝胺,以NMP為例:
2.不符合亞硝胺三要素的情況:
2.1 肼和肼酮類化合物以及N-硝基衍生物進(jìn)行氧化和還原過(guò)程��。
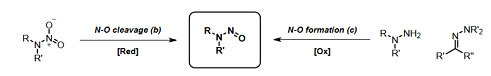
1)硝基胺的還原��;
2)肼的氧化�;
3)腙的臭氧分解
2.2 中性或堿性條件有活性羰基類化合物存在
活性羰基類化合物特別是甲醛�����、吡哆醛和一些苯甲醛可以在NO2−的中性和堿性溶液中從二級(jí)胺中產(chǎn)生亞硝基胺[1] [2]���。反應(yīng)速率隨著對(duì)氮原子的立體位阻而變化�,但所有反應(yīng)速率都比酸性條件下的經(jīng)典N-亞硝基化反應(yīng)慢得多�。如下圖所示:
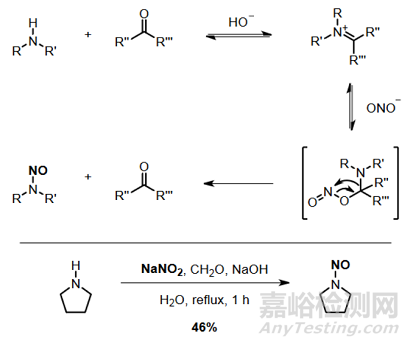
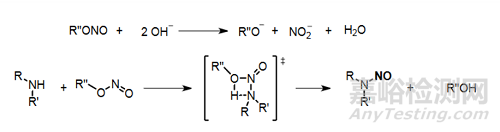
在堿性條件仲胺可以與亞硝酸酯發(fā)生類似酯交換的反應(yīng),在堿性環(huán)境得到亞硝胺的速度小于酸性水環(huán)境�。如下圖所示:
有機(jī)溶液條件下,仲胺也可以直接與亞硝酸酯反應(yīng)生成亞硝酸酯���。
二�����、 亞硝胺風(fēng)險(xiǎn)評(píng)估
言歸正傳�,了解了亞硝胺生成的機(jī)制,我們也明白了光評(píng)估三要素是不夠的�,我們需要設(shè)計(jì)合適的評(píng)估手段,才能降低潛在亞硝胺的風(fēng)險(xiǎn)����。
亞硝化反應(yīng)速率與胺濃度和亞硝酸鹽濃度的平方成正比。研究發(fā)現(xiàn) N-亞硝胺形成速率 (r) 與胺含量成正比����,因此 N-亞硝化反應(yīng)的速率受亞硝酸鹽濃度的影響更大[3]�。[Amine]代表相關(guān)胺的含量,[ NO2−]代表亞硝酸鹽含量���,按下式:
為了更全面地考慮了亞硝胺的生成機(jī)制和潛在風(fēng)險(xiǎn)因素��,筆者提出了新的三要素評(píng)價(jià)體系,具體如下:
要素一:亞硝化試劑或其前體。
1)反應(yīng)中直接使用亞硝化試劑或其前體
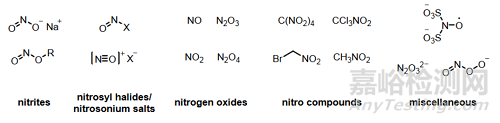
常見(jiàn)的亞硝化試劑或其前體有亞硝酸鈉(NaNO2)和亞硝酸叔丁酯(t-BuONO),亞硝酸(HNO2)����,一氧化氮(NO),亞硝酰鹵化物(XNO�,X=鹵素),三氧化二氮(N2O3)和四氧化二氮(N2O4)�。
2)溶試劑引入����。
亞硝化試劑也不能單單考慮直接添加的,常見(jiàn)的試劑和飲用水中均可能引入亞硝化試劑或其前體����。
在合成過(guò)程中使用的無(wú)機(jī)試劑,如硝酸鹽����、NaCl、NaOH和Na2CO3可以含有低濃度( ppm )的亞硝酸鹽��;硝酸通常含有二氧化氮�����,因此四氧化二氮作為雜質(zhì),也可能產(chǎn)生額外的亞硝酸����,導(dǎo)致亞硝化[4]�����。
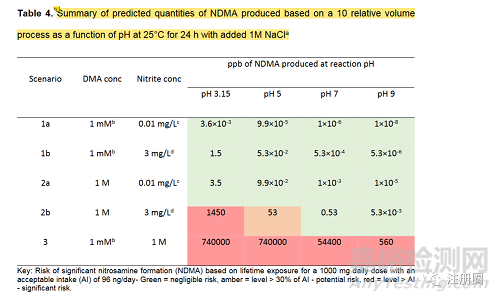
飲用水也是常見(jiàn)的亞硝酸鹽的來(lái)源�。根據(jù)下圖飲用水中NDMA生成速率可以看出��,當(dāng)飲用水中亞硝酸鹽水平在0.01mg/L或以下�����,生成亞硝胺的風(fēng)險(xiǎn)并不大[3]����。這意味著了解所使用的水的亞硝酸鹽含量有可能消除這種風(fēng)險(xiǎn)。
3)反應(yīng)過(guò)程中產(chǎn)生的亞硝化試劑
羥胺(NH2OH)����、氯胺(例如NH2Cl)、臭氧(O3)和硝酸鹽(例如硝酸鈉(NaNO3))在某些條件下可以作為間接亞硝化劑[4]����。如果存在任何還原劑��,硝基烷烴����、鹵代硝基烷烴��、Fremy 's鹽����、亞硝基磺酰胺和硝基芳烴(例如通過(guò)氟化物脫硝)在某些情況下都可以產(chǎn)生亞硝化試劑�����。
因此我們需要對(duì)所用試劑或起始原料的合成過(guò)程進(jìn)行了解����,如果數(shù)量過(guò)于眾多�,盡量對(duì)最后三到五步反應(yīng)的物料合成路線所用試劑進(jìn)行深入了解或?qū)︼L(fēng)險(xiǎn)較大反應(yīng)(酸性�、仲胺條件)用的試劑進(jìn)行亞硝酸鹽殘留的檢測(cè)。
要素二:可能形成亞硝胺的底物;
可能形成亞硝胺的底物不僅僅局限于脂肪胺�、芳香胺還要評(píng)估羥胺和肼類化合物,以及其他可能含有仲胺作為雜質(zhì)或降解產(chǎn)物的化合物包括酰胺溶劑�����,例如二甲基甲酰胺(DMF)�、二甲基乙酰胺(DMAC)和N-甲基-2-吡咯烷酮(NMP)��,季銨鹽�,例如四正丁基氟化銨(TBAF)和四正丁基溴化銨(TBAB)以及伯胺[4]�。
要素三:促進(jìn)反應(yīng)條件
1)酸性條件。
酸性通常是pH 2~5(pH 3左右最佳)����。鹽離子促進(jìn)反應(yīng)進(jìn)行�����。在低pH條件下����,亞硝酸鹽的亞硝化作用在很大程度上是由各種陰離子催化的��,特別是鹵化物或硫氰酸根離子���,也由磷酸鹽���、醋酸鹽和其他離子催化����。但硫酸鹽和高氯酸鹽是明顯的例外�����。
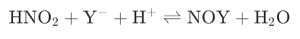
鹵素Y的反應(yīng)活性 I> SCN > Br> CI
2)存在活性羰基化合物。
存在活性羰基化合物(尤其是甲醛、苯甲醛)等催化劑則中性或堿性條件有亞硝化試劑存在下可能導(dǎo)致亞硝化����。
3)存在氧化劑����。
常見(jiàn)氧化劑如氧氣、空氣���、臭氧����、雙氧水等,在中間體或試劑具有羥胺�、肼�、酰肼和腙結(jié)構(gòu)的情況尤其需要關(guān)注。就如上文所說(shuō)的肼����、腙等結(jié)構(gòu)可以直接被氧化成亞硝胺����。
同時(shí)也要考慮使用到二級(jí)胺�����、三級(jí)胺被氧化降解為亞硝胺的情況�,尤其是回收溶劑可能含有二級(jí)胺、三級(jí)胺的情況����,多次回收套用的過(guò)程胺可能會(huì)被氧化成亞硝酸鹽甚至亞硝胺。例如氧化劑的存在下��,二甲胺可以在不額外添加亞硝化試劑的情況下生成NDMA[5]����。
4)存在還原劑��。
該因素主要是針對(duì)硝基胺被還原成亞硝胺的情況。同時(shí)�,如果存在任何還原劑����,硝基烷烴����、鹵代硝基烷烴、Fremy 's鹽、亞硝基磺酰胺和硝基芳烴(例如通過(guò)氟化物脫硝)在某些情況下都可以產(chǎn)生亞硝化試劑�����。
三��、 結(jié)束語(yǔ)
本文首次提出新的三要素評(píng)價(jià)體系更全面地考慮了亞硝胺的生成機(jī)制和潛在風(fēng)險(xiǎn)因素�,包括亞硝化試劑或其前體、可能形成亞硝胺的底物以及促進(jìn)反應(yīng)的條件��。這個(gè)評(píng)價(jià)體系有助于更好地評(píng)估亞硝胺的風(fēng)險(xiǎn)���,并提供指導(dǎo)以降低亞硝胺污染物的風(fēng)險(xiǎn)����。
最后,我們相信通過(guò)各方共同努力����,亞硝胺在藥品中的問(wèn)題可以得到有效解決����。持續(xù)的科學(xué)研究和技術(shù)創(chuàng)新將為解決亞硝胺問(wèn)題提供更多的解決方案���。我們期待著未來(lái)的進(jìn)一步發(fā)展�����,以確保藥品的質(zhì)量和安全性,為患者提供更好的醫(yī)療保健服務(wù)��。
參考文獻(xiàn):
1. López-Rodríguez, R.; McManus, J. A.; Murphy, N. S.; Ott, M. A.; Burns, M. J., Pathways for N -Nitroso Compound Formation: Secondary Amines and Beyond. Organic Process Research & Development 2020, 24 (9), 1558-1585.
2. Keeper, L. K.; Roller, P. P., N-Nitrosation by Nitrite Ion in Neutral and Basic Medium. Science 1973, 181 (4106), 1245-1247.
3. Ashworth, I. W.; Dirat, O.; Teasdale, A.; Whiting, M., Potential for the Formation of N-Nitrosamines during the Manufacture of Active Pharmaceutical Ingredients: An Assessment of the Risk Posed by Trace Nitrite in Water. Organic Process Research & Development 2020, 24 (9), 1629-1646.
4. EFPIA workflows for quality risk management of nitrosamine risks in medicines (ver 2.0)5. Jireš, J.; Douša, M.; Gibala, P.; Kubelka, T., N-Nitrosation in the absence of nitrosating agents in pharmaceuticals? Journal of Pharmaceutical and Biomedical Analysis 2022, 218, 114872.