摘要:美國食品藥品監(jiān)督管理局(FDA)于2023 年4 月發(fā)布了“評估簡化新藥申請仿制透皮和局部給藥系統(tǒng)可能的刺激性和致敏性的供企業(yè)用的指導原則草案”��,全面而又具體地闡明FDA對仿制透皮和局部給藥系統(tǒng)(TDS)可能的刺激性和致敏性人體內(nèi)研究的設計和實施的建議�����。其中包括一般原則(一般考慮)�、研究設計和實施�����、統(tǒng)計分析(刺激性分析和致敏性分析)、輔料TDS 和陽性對照TDS 以及部分(切割)TDS 等�����。而中國目前還沒有類似的指導原則,詳細介紹FDA該指導原則主要內(nèi)容��,期望對中國仿制TDS 刺激性和致敏性人體內(nèi)研究與監(jiān)管有所裨益。
美國食品藥品監(jiān)督管理局(FDA)于2023 年4月發(fā)布了“評估簡化新藥申請仿制透皮和局部給藥系統(tǒng)可能的刺激性和致敏性的供企業(yè)用的指導原則草案”[1]�����,修訂了2018 年10 月發(fā)布的“評估簡化新藥申請仿制透皮和局部給藥系統(tǒng)的可能的刺激性和致敏性的指導原則草案”[2]�����。該修訂的指導原則由FDA藥物評價與研究中心(CDER)的仿制藥辦公室與CDER 的轉(zhuǎn)化科學辦公室合作編寫�����,為評估擬議的透皮或局部給藥系統(tǒng)(TDS)可能的體內(nèi)皮膚刺激性和致敏性(I/S)�,提出了設計和實施研究的建議�。該指導原則修訂草案中的建議涉及為支持簡化新藥申請(ANDA)而提交的研究資料,修訂后的指導原則草案��,旨在闡明FDA 關于體內(nèi)皮膚I/S 研究的建議和期望���。
中國目前還沒有類似的指導原則���,本文詳細介紹FDA 該指導原則草案的內(nèi)容����,期望對中國仿制TDS 的人體I/S 的研究和監(jiān)管有益���。
1��、 該指導原則的前言
該指導原則對研究設計和實施提出了建議�,這些研究用以評價擬議的TDS 可能的體內(nèi)I/S。首字母縮寫TDS 指的是透皮給藥系統(tǒng)和局部給藥系統(tǒng)��,包括可能在其他地方描述或稱為貼片(patches)�、局部貼片(topical patches)或緩釋膜(extended-releasefilms)的產(chǎn)品��。該指導原則中的建議����,涉及為支持ANDA 而提交的研究資料����。新藥申請或補充新藥申請中表征可能的TDS 刺激性或致敏性研究的建議,可能與支持ANDA的建議不同�。在支持新藥申請的研究中�,TDS 刺激性和致敏性的設計、實施和評估本質(zhì)上是不同的,因為在這種情況下����,TDS 刺激性或致敏性通常不與參比制劑(RLD)對比評價���。有關新藥申請�,請查閱“用于皮膚的局部藥物引起的接觸性皮炎:人體安全評估供企業(yè)用的指導原則”(2020 年3 月)[3]。FDA定期更新指南����,最新版本的指南,請查看美國食品藥品管理局指南網(wǎng)頁https://www. fda. gov/regulatory-information/searchfda-guidance-documents。
該指導原則修訂了“評估ANDA透皮和局部給藥系統(tǒng)可能的刺激性和致敏性的供企業(yè)用的指導原則草案”[2]�,此次修訂對2018 年原來的指導原則草案做了如下更新:(1)闡明了評價擬議TDS 的可能的體內(nèi)皮膚I/S 研究設計和實施的建議;(2)明確了何時可能不需要評估����,TDS 產(chǎn)品可能的致敏性的體內(nèi)研究;(3)為擬使用替代評分量表或替代方法���,比較受試和參比TDS 之間的I/S 的申請人提供指導。
在該指導原則中�����,字母T(代表試驗)將指作為ANDA對象的擬議仿制藥�����,字母R(代表參照)將指參比制劑(RLD)和( 或)標準制劑(referencestandard product)���。
FDA 建議申請人在考慮設計和實施可能適合支持擬用仿制TDS 產(chǎn)品與其RLD生物等效性的研究時,參考該指導原則以及任何相關的具體產(chǎn)品指導原則(PSG)[4]和任何相關的企業(yè)用的指導原則[5-6]�。FDA還建議申請人,定期訪問FDA的網(wǎng)站���,因為可能有其他的指導原則����,有助于開發(fā)仿制TDS產(chǎn)品�����。
FDA鼓勵尋求使用FDA在相關PSG中建議的替代方法設計和實施研究�。評價T 和R 產(chǎn)品之間TDS 的體內(nèi)可能的I/S 的申請人����,與FDA聯(lián)系,討論擬議的替代方法����,以評價該藥物產(chǎn)品可能的I/S[7-9]��。
一般來說�����,F(xiàn)DA的指導原則文件并沒有規(guī)定法律上可強制執(zhí)行的責任�����。相反,指導原則描述了該機構(gòu)目前對某一主題的想法�,除非引用了具體的監(jiān)管或法定要求�,否則僅應視為建議���。在該機構(gòu)指導原則中使用“should”一詞意味著建議或推薦某事�,但不是規(guī)定。
2、 該指導原則出臺的背景
TDS 制劑的成分和組成,包括原料藥的性質(zhì)和(或)TDS 材料阻止水蒸氣從皮膚發(fā)散的程度�,以及其他因素,如環(huán)境濕度或皮膚狀態(tài)�����,可能刺激皮膚或?qū)е轮旅舴磻?。皮膚致敏反應是指以前暴露過的物質(zhì)引起的過敏性皮膚反應(即變應性接觸性皮炎),通常以紅、腫和癢為特征。這種反應可能使患者感到不舒服����,并可能影響患者的依從性�、皮膚滲透性和(或)TDS 與皮膚的黏附性��。這些可能影響的總體后果����,可能對由此產(chǎn)生的藥物輸送特點產(chǎn)生不確定性��,并對TDS 的藥物吸收速率和程度產(chǎn)生不確定性�。因此在適當?shù)那闆r下,申請人應使用適當設計的人體受試者皮膚I/S 研究�����,對T和R TDS 產(chǎn)品進行比較評估�,以證明T TDS 引起皮膚刺激或致敏反應的可能性并不比R TDS 引起的反應更差(有關何時這類研究合適的信息,見下文的“一般考慮”)���。
3�����、 一般考慮
皮膚I/S 研究旨在比較T 和R TDS 產(chǎn)品之間的相似性�,以確定引起刺激和(或)致敏反應的可能性�����。TDS 可能只在一些使用該產(chǎn)品的患者中引發(fā)這些反應,但即使這種情況發(fā)生的頻率很低,不良反應也可能影響數(shù)千人����。為了評價這種I/S 的可能性,申請人應在至少200 例可評價受試者中,比較T和R TDS 產(chǎn)品(見第“4.1 節(jié)”),并且該研究應在激發(fā)條件下進行(在同一個皮膚部位重復去除和重新給予TDS)���,以最大限度地提高研究期間����,受試者群體發(fā)生刺激和(或)致敏反應的可能性��。
在某些情況下�����,如果有充分的理由,或者FDA確定進行致敏評估是不必要的或不道德的�,則可能沒有必要進行體內(nèi)研究,評估ANDA中提交的TDS產(chǎn)品的致敏可能性(如已知活性成分是皮膚增敏劑����,或基于與TDS 產(chǎn)品的成分和組成有關的信息或數(shù)據(jù))���,以表明T產(chǎn)品不太可能比R產(chǎn)品更致敏���。
環(huán)境溫度或濕度的變化,包括常規(guī)淋浴期間TDS 每天暴露在熱和水中,可暫短地影響TDS 制劑成分釋放和滲透皮膚的速率�。這種變化也可能影響TDS 中和(或)TDS 下的截留水分,這可能改變皮膚水合作用并影響制劑成分的生物利用度,進而可能改變I/S 反應���。因此��,在設計其I/S 研究時,申請人應考慮RLD的說明書任何使用條件,這些條件可能影響TDS 產(chǎn)品的I/S 可能性(如TDS 偶然暴露在水中,如在洗澡或淋浴時�,特別是對于耗時長達或大于24 h 的TDS)。
除了可能由制劑成分的腐蝕性或免疫調(diào)節(jié)性質(zhì)或皮膚對TDS 封閉的藥效反應引起的I/S 反應外�����,皮膚也可能因去除TDS 期間可能發(fā)生的物理損傷�����,而受到刺激�����。例如,如果TDS 的黏附性使其在去除過程中剝離大部分角質(zhì)層,則皮膚屏障損傷可能導致TDS 去除部位的刺激�����,這也可能增加致敏反應的可能性�����。
4��、 皮膚刺激性和致敏性的綜合評價
4.1 研究設計和實施
一般來說���,F(xiàn)DA建議申請人進行評估者盲法隨機研究,以支持他們對T和R產(chǎn)品的皮膚I/S 特點的比較評估�����。研究人群通常應包括健康男性和未妊娠�、非哺乳的女性,除非某些TDS 產(chǎn)品與RLD說明書的使用條件一致的具體考慮,另有說明�����。在研究方案中��,應預先規(guī)定擬使用的TDS 規(guī)格的選擇����,并應視情況,根據(jù)擬議研究人群中TDS 的使用�,說明其合理性。
本文所述���,如果包括足夠數(shù)量的評價致敏性的受試者����,F(xiàn)DA建議申請人在1 項研究中評價皮膚刺激性和致敏性�����。建議的研究由下列2 個階段組成�,每個階段依次描述:(1)21 d 的誘導期�����,隨后是14~17 d 的休息期;(2)激發(fā)期����。
在誘導期,申請人應同時將所有TDS 單元(即每個全部或部分(Partial)[10]T 產(chǎn)品和每個全部或部分R 產(chǎn)品)用于每個受試者�。Partial 是指原TDS 單元(matrix TDS)被切割成更小尺寸的TDS 單元。T和R產(chǎn)品用于同一解剖部位的對側(cè)位置(例如�,T 產(chǎn)品在左臀部,R 產(chǎn)品在右臀部)�;申請人應根據(jù)RLD說明書中的給藥建議,選擇解剖部位�����。
(1)在連續(xù)21 d 內(nèi)���,應使用����、移除TDS 裝置���,并用新的TDS 裝置更換���,與初始應用相同的皮膚部位的重復持續(xù)時間�;除非相關PSG 中另有說明��,否則每個持續(xù)時間應代表RLD說明書的使用期���。例如�����,3 d 使用期的TDS���,可以每3 天去除1 次,評估I/S�����,并每3 天更換到相同的皮膚部位��,總共21 d�����。
(2)申請人應在每次TDS 變化時��,通過使用單獨的評分表�,分別評估受試者的“皮膚反應”和“其他效應”評分(兩者均在下文中描述),評價受試者的刺激反應�。
(3)對于經(jīng)歷過度刺激的受試者,TDS 可以轉(zhuǎn)移到新的部位�,以完成21 d 的誘導期,并繼續(xù)研究的致敏部分�。申請人應在其方案中預先定義,哪些標準可觸發(fā)TDS 移到新部位(由于被確定為過度刺激的皮膚反應)��。例如�,標準可以規(guī)定,如果綜合評分大于或等于3�,TDS 可被移到新部位。
在激發(fā)期���,申請人應同時將所有TDS 單元(即每個全部或部分T 產(chǎn)品和每個全部或部分R 產(chǎn)品)用于每個受試者�。T 和R產(chǎn)品應用于同一解剖部位的兩對側(cè)位置(如T 產(chǎn)品在左臀部�,R 產(chǎn)品在右臀部);申請人應根據(jù)RLD說明書中的給藥建議選擇解剖部位��。
(1)TDS 組應在天然皮膚部位(即在誘導期未施用TDS 的部位)施用48 h���,然后移除�����。
(2)申請人應在去除TDS 后30 min�、24 h、48 h和72 h 評估受試者的皮膚反應����。
(3)申請人應記錄觀察到的任何皮膚反應,并使用單獨的評分表對受試者的“皮膚反應”和“其他效應”評分(兩者均在下文中描述)進行敘述性描述��。
(4)申請人應記錄���,研究人員對皮膚反應是否是接觸致敏的看法�。申請人應在其研究方案中預先規(guī)定����,研究人員如何確定是否存在接觸致敏。
(5)對于所有表現(xiàn)出潛在致敏反應的受試者�,申請人應在最初的激發(fā)后4~8 周進行再激發(fā)試驗,并以與上述激發(fā)期相同的方式進行�。
在誘導期和激發(fā)期,申請人應根據(jù)量表(表1�、2)對受試者皮膚反應進行評分。
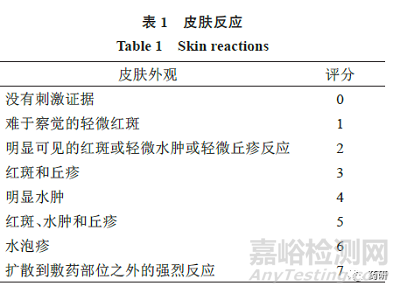
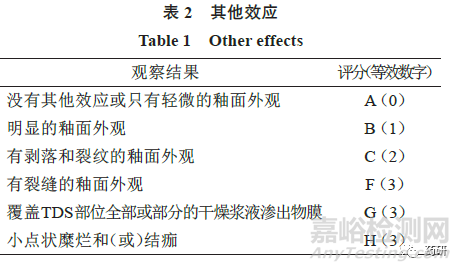
當觀察到1 個或多個“其他效應”時��,申請人應將每個評分報告為皮膚反應數(shù)(字母綜合評分)和數(shù)字總數(shù)(即數(shù)字“皮膚反應”評分+ 等效數(shù)字的“其他效應”字母的評分)。例如���,皮膚反應6 分加上有裂縫的釉面外觀[F(3)]將等于9 分。當沒有觀察到“其他效應”時���,零分應適用于觀察的“其他效應���。”
擬使用這2 種量表以外的替代量表的申請人,應在進行研究之前申請與FDA召開會議�����,討論替代量表和擬議的統(tǒng)計分析方案(即提交ANDA前會議申請)�����。如果申請人使用這2 個量表之外的量表(如捕捉皮膚反應的漸進變化的單個數(shù)字量表)�,對觀察到的皮膚反應評分,則他們應該報告�����,根據(jù)其選擇的替代量表的每個評分以及根據(jù)這2 個量表的評分���。
如果申請人認為可能需要使用膠帶或覆蓋物�,在I/S 研究的相關持續(xù)時間內(nèi),保持TDS 與皮膚的最大接觸����,那么使用膠帶或覆蓋物可能是合適的。申請人應在其研究方案中預先規(guī)定���,使用膠帶或覆蓋物加固任何可脫離TDS 的標準�����。如果TDS 用膠帶或覆蓋物加固�,則應將膠帶或覆蓋物區(qū)域的皮膚刺激�,與TDS 敷用區(qū)域相關的皮膚刺激分開報告。
在整個研究期間���,申請人應在去除TDS 之前的每個時間點���,評估TDS 對皮膚的黏附性,以監(jiān)測適當激發(fā)誘導I/S 必要的皮膚接觸的充分性�����。因此,即使在使用膠帶或覆蓋物的情況下���,也應根據(jù)TDS 的表面積(不包括任何膠帶或覆蓋物)評估黏附性�����,以確保TDS 在整個誘導期和激發(fā)期都能很好地黏附。FDA評估TDS 黏附性的建議��,在“評估ANDA透皮和局部給藥系統(tǒng)黏附性”的供企業(yè)用的指導原則草案(2023 年4 月)中被描述[10]�����。
如果TDS 完全脫離�����,受試者應在24 h 內(nèi)更換新的TDS 并繼續(xù)研究����。受試者應在脫離發(fā)生時立即記錄脫離的日期和時間���,申請人應保存受試者生成的原始文件(如受試者日記)���。如果TDS 在21d 的誘導期內(nèi)完全脫離超過24 h���,申請人應將其排除在該產(chǎn)品的刺激性和致敏性分析之外,除非受試者因過度刺激而故意去除TDS�。如果TDS 在48 h 激發(fā)期完全脫離超過24 h,申請人應將受試者排除在致敏性分析之外��,除非受試者因過度刺激而故意去除TDS���。
對于I/S 研究���,申請人應納入足夠數(shù)量的受試者,以確保其每個方案(PP)人群中至少包括200 例可評價的受試者��;然而�����,對于僅刺激性研究���,PP 人群中可評價受試者的數(shù)量可能有所不同(見第“4.2.1”節(jié)����。用于僅進行刺激性研究的樣本量的確定)�����。受試者不應在放置TDS 的皮膚區(qū)域涂抹化妝品、護膚霜����、乳液、粉末��、酒精或其他局部產(chǎn)品,因為這些產(chǎn)品可能影響TDS 的黏附性或刺激的可能性���。此外��,在施用TDS 之前,應剪掉(而不是剃掉)受試者在施用部位的毛發(fā)�。此外,申請人應建議����,受試者避免將TDS 敷用部位,暴露在外部直接熱源下����,如加熱墊、電熱毯�����、加熱燈���、桑拿浴室、熱水浴缸�����、熱水床和(或)長時間的陽光直射�����。
下列清單規(guī)定了一些入選和排除標準���,申請人可以用其選擇受試者;然而����,這些清單并不詳盡,申請人可以酌情使用其他標準選擇受試者���。申請人應作為方案的一部分,描述納入和(或)排除標準的依據(jù)�����,這些標準是下述標準的補充或與其不同�。
(1)入選標準
① 年齡在18 至65 歲( 含)之間的男性和女性(未妊娠�、非哺乳)健康受試者。健康受試者通常是指18 歲或18 歲以上的不吸煙成年人�,不存在病癥或需要發(fā)揮生理作用的藥物�。
②有生育潛力的女性必須在研究之前至少14 d內(nèi)和整個研究期間�,準備避免性交或使用可靠的屏障避孕方法[如女用避孕套�、子宮帽、宮內(nèi)節(jié)育器�、避孕海綿,或讓她們的伴侶使用屏障方法(含殺精劑的避孕套)]�,或在研究前至少30 d,使用激素方法避孕并將在研究期間繼續(xù)使用相同類型的激素避孕措施�。
(2)排除標準
①受試者正在妊娠或哺乳。
②重大皮膚病或病癥的病史�,如特應性�、銀屑病、白癜風�,或已知改變皮膚外觀或生理反應的病癥(如糖尿病或卟啉病)�。
③明顯影響免疫反應的疾病病史[如原發(fā)性或獲得性免疫缺陷(如HIV 或艾滋?。⑦^敏性疾?。ㄈ邕^敏反應�、哮喘或全身藥物反應)、腫瘤(如淋巴瘤或白血?。㈩愶L濕性關節(jié)炎或系統(tǒng)性紅斑狼瘡]�。
④嚴重皮膚癌(如黑色素瘤或鱗狀細胞癌)病史�,但淺表性基底細胞癌除外,且不涉及TDS 敷用部位�。
⑤在研究治療開始的3 周內(nèi)�,使用以下藥物或療法:顯著影響或增強對T或R藥品的反應�,或改變對T或R藥品的炎癥或免疫反應(如環(huán)孢菌素�、他克莫司�、全身或局部皮質(zhì)類固醇、細胞毒性藥物�、免疫球蛋白、卡介苗免疫療法�、單克隆抗體或放射療法)�。
⑥研究治療開始72 h 內(nèi),使用抗組胺藥或在TDS 部位使用局部用藥�。
⑦受試者兩手臂之間的皮膚顏色有明顯差異�,或存在皮膚病癥、涂抹部位毛發(fā)過多�、疤痕組織、紋身�、開放性潰瘍�、近期曬傷或身體穿孔,這些都會干擾受試品的放置�、皮膚評估或受試者對TDS 的反應�。
申請人應提供受試者在研究期間禁用的處方藥和非處方藥產(chǎn)品清單�,例如可顯著影響或增強受試者對T 或R 產(chǎn)品的反應�,或可改變受試者對于該產(chǎn)品的炎癥或免疫反應的藥物或療法(如抗組胺藥�、全身或局部皮質(zhì)類固醇�、環(huán)孢菌素、他克莫司�、細胞毒性藥物、免疫球蛋白�、卡介苗免疫療法�、單克隆抗體或放射療法)。
一般來說�,受試者的身體活動在研究過程中不應受到限制�。對于敷用時間長達或超過24 h 的產(chǎn)品,F(xiàn)DA建議在研究期間可以按照RLD的說明書使用方式�,常規(guī)洗澡或淋浴,并且在此類常規(guī)活動中�,不應保護TDS 不直接暴露在水中�。
申請人應將他們的T 和R 產(chǎn)品,隨機分配給皮膚部位�,在方案中描述他們的隨機化方法�,并以XPT格式將隨機化方案作為SAS 傳輸數(shù)據(jù)集提供。
經(jīng)過培訓的觀察者應在每次去除TDS 時�,對TDS 的依從性和受試者的皮膚反應評分�,申請人應盡量確保所有觀察都采用同一評分者�。如果不是所有觀察都采用同一評分者�,申請人應提供確保不同評分者評分一致的證據(jù)。由于T產(chǎn)品和R產(chǎn)品之間TDS 的外觀可能存在差異�,觀察者盲法是不可能的�,尤其是需要直接觀察TDS 的黏附性時。然而�,申請人應盡可能對I/S 的評估采用盲法。
FDA 推薦的評價刺激性的主要終點是平均刺激性評分(MIS)�。在每例受試者和每個產(chǎn)品的每個評估時間點�,申請人應通過“皮膚反應”分數(shù)加“其他效應”字母分數(shù)的等效數(shù)字,計算綜合刺激性評分�。對于每例受試者和每種產(chǎn)品,申請人應將MIS計算為評估時間點上的綜合刺激評分之和�,除以評估總數(shù)�。
申請人應在頻率表中提交描述性刺激評分數(shù)據(jù),說明每個TDS 單元的數(shù)量和比例�,以及每個評價時間點的皮膚反應數(shù)字評分和“其他效應”字母評分的每個組合�。如果TDS 因過度刺激而被移動或移除,則移除前在原始施用部位觀察到的最后1次刺激評分被視為剩余時間點該部位TDS 刺激程度的合理表示。這種方法被稱為原始敷用部位的末次觀測值結(jié)轉(zhuǎn)法(LOCF)�。頻率表應反映LOCF后的刺激性評分�。
4.2 統(tǒng)計分析考慮
4.2.1 刺激性分析
對于刺激性分析�,申請人應在方案中定義,他們每個TDS 的每個方案(PP)人群�,而不是每個受試者�。PP 人群應包括在整個21 d 的誘導期內(nèi)順序敷用于同一解剖部位的所有TDS 單元,而沒有任何超過24 h 的脫離期�。如果TDS 因過度刺激而被移動或移除�,則應將其包括在PP 人群中,并使用原始敷用部位的LOCF�。
申請人應比較T 和R 產(chǎn)品的每個受試者MIS(即上述主要終點)的總平均數(shù)。為了證明T 產(chǎn)品與R 產(chǎn)品相比�,在MIS 方面的非劣效性(NI)�,應根據(jù)評價T 產(chǎn)品和R 產(chǎn)品的MIS 總平均數(shù)的差值,證明T 產(chǎn)品在統(tǒng)計學上不劣于R 產(chǎn)品�,NI 界值為0.20(δ=0.20)。0.20 的NI 界值表示基于先前描述的刺激量表的T和R產(chǎn)品之間的MIS 總平均數(shù)的差值�;該NI 界值可能不適合用于基于其他刺激量表或數(shù)據(jù)轉(zhuǎn)換(例如對數(shù)轉(zhuǎn)換或向所有刺激評分添加常數(shù))的MIS 總平均數(shù)的差值或T 和R 產(chǎn)品之間的MIS 總中位數(shù)的差值。
申請人應在0.05 顯著性水平檢驗下列假設:
H0:μT−μR≥δ
H1:μT−μR<δ
μT 和μR 分別是T 和R 產(chǎn)品MIS 的群體總平均數(shù)�,以及替代假設H1表示,T產(chǎn)品刺激性相對于R產(chǎn)品刺激性的NI�。這些假設也可以表示為:
H0:μD≥δ
H1:μD<δ
μD等于T 和R 產(chǎn)品MIS 的總平均數(shù)之差:μD=μT−μR�。當在配對研究中�,沒有缺失數(shù)據(jù)時,針對個體受試者j�,對配對每個受試者MIS( jR)之間的差值Dj來講�,μD與群體平均數(shù)是一樣的[Dj=-XjT--XjR,E(Dj)=μD]�。
為了證明T 產(chǎn)品具有可容許的刺激反應,申請人應設計并進行該指導原則的“第4.1 節(jié)”所述的刺激性研究�。如果只設計刺激性研究,申請人應招募足夠數(shù)量的受試者�,以使研究達到0.80 或更高的水平。由于刺激量表的離散性和刺激數(shù)據(jù)的其他潛在問題�,F(xiàn)DA 建議申請人使用足夠大的樣本量�,以確保任何大樣本(漸進)高斯(Gaussian)假設的有效性(如果使用的話)。
申請人應最終確定其統(tǒng)計分析計劃�,詳細描述計劃分析的各個方面�,然后再對數(shù)據(jù)進行揭盲;在提交ANDA時�,應向FDA提供統(tǒng)計分析計劃。
不完整的數(shù)據(jù)和與不依從性相關的數(shù)據(jù),可嚴重影響NI 研究的有效性�。因此,F(xiàn)DA建議良好的研究設計和實施�,以防止患者退出和不依從。如果出現(xiàn)任何1 種情況�,申請人應詳細記錄退出和(或)不依從的原因�。盡管FDA建議將PP 人群作為NI 研究的主要分析人群�,但FDA也對信息缺失和不依從的可能性特別關注。如果將使用LOCF 以外的方法�,估算因過度刺激而移動或移除的TDS 的數(shù)據(jù),申請人應在其方案中預先規(guī)定這些估算方法�。FDA 建議申請人進行預先規(guī)定的敏感性分析,以評價任何不平衡或信息缺失和不依從對NI 結(jié)論的潛在影響�。
對于刺激性評估,F(xiàn)DA還考慮其他臨床相關數(shù)據(jù)�,包括達到最大刺激性評分的TDS 單元敷用數(shù)量,以及因過度刺激而停止產(chǎn)品敷用的受試者數(shù)量�。相同的MIS 可以通過少量的高分(如3 分或更高)達到�,這可能具有較大的臨床意義,或者通過大量的低分(如1 分)達到�,其可能具有較小的臨床意義。因此�,很難確定給定MIS 或給定的產(chǎn)品之間MIS 差異的臨床意義。
因此,除MIS 外�,F(xiàn)DA 建議申請人評價每種產(chǎn)品過度刺激的受試者比例。T產(chǎn)品過度刺激的受試者比例不應高于R 產(chǎn)品�,并且T 產(chǎn)品的刺激在敷藥期不應早于R 產(chǎn)品出現(xiàn)�。就MIS 而言,T 產(chǎn)品應不劣于R產(chǎn)品�,并且在刺激程度方面,T 產(chǎn)品與R產(chǎn)品相比�,不應顯示有意義的差異�。
4.2.2 致敏性分析
申請人應在方案中根據(jù)TDS而不是每個受試者定義用于致敏分析的PP 人群。
用于致敏分析的PP 人群應包括�,在整個21 d 誘導期和整個48 h 激發(fā)期(沒有任何超過24h 的脫離期)�,敷用所有TDS 單元。每個受試者返回試驗�,應在移除激發(fā)TDS 后48 h 和72 h,經(jīng)過至少1 次預先規(guī)定的評估�。如果由于過度刺激而在48 h 激發(fā)期結(jié)束前移除TDS 單元�,則應在移除TDS 后24 h、48 h和72 h 評估敷用部位�,并使用原始敷用部位的LOCF,將其納入致敏分析�。
對于每個TDS 單元,應單獨評價激發(fā)期去除TDS 后�,48 或72h 綜合評分為2 或更高的PP 受試者的潛在致敏性。如果符合下列所有標準�,申請人應考慮為可能致敏的受試者:
(1)受試者至少有1 個評價時間點�,處于激發(fā)期TDS 去除后24 h 以上(如48 h 或72 h)。
(2)受試者在激發(fā)期的最后1 次評價中�,綜合刺激評分至少為2 分�。
(3)如果受試者完成了再激發(fā)期�,則在激發(fā)期和再激發(fā)期都符合上述兩個標準。
48 h 前消退的皮膚反應�,通常被認為是由刺激而非致敏引起的�。對于在激發(fā)或再激發(fā)期觀察到的任何潛在致敏反應,申請人應提供理由支持T 產(chǎn)品的致敏率與使用R產(chǎn)品觀察到的致敏率相當�。
申請人應報告�,被認為可能對T 和(或)R 產(chǎn)品過敏的受試者的各自數(shù)量。
申請人應提供描述性統(tǒng)計數(shù)據(jù)�,比較可能對每個TDS 單元過敏的受試者的數(shù)量和比例�,以及對每個TDS單元過敏的受檢者數(shù)量和比例。
申請人應提供頻率表�,顯示每個TDS 單元在激發(fā)期的敷用數(shù)量�,以及每個評價時間點的每個具體綜合“皮膚反應”數(shù)字評分和“其他效應”字母評分�。
對于所有受試者�,在激發(fā)期去除TDS 后48 h 或72 h,至少有1 個2 分或以上的綜合刺激評分�,申請人應提供表格�,顯示每個受試者在誘導和激發(fā)期,每個評價時間點的實際評分�。
在某些情況下,如果提供了充分的理由�,或者FDA確定進行致敏評估是不必要或不道德的(如已知活性成分是皮膚致敏劑�,或者基于與TDS 產(chǎn)品成分和組成相關的信息或數(shù)據(jù)),以表明T產(chǎn)品不太可能比R產(chǎn)物更致敏�,則可能沒有必要對TDS 產(chǎn)品進行體內(nèi)致敏性評價�。
4.3 輔料TDS和陽性對照TDS
如果安全問題,不允許通常的比較研究(包括使用T和R產(chǎn)品)�,則可以通過試驗輔料TDS 與產(chǎn)生輕度刺激的陽性對照TDS(如小于或等于0.1%的十二烷基硫酸鈉),評估T 產(chǎn)品引起皮膚I/S 的評價�。輔料TDS 應包含T 產(chǎn)品中的所有非活性成分�,并且除不存在活性成分外,其他方面均與T 產(chǎn)品完全相同�。如果輔料TDS 中的非活性成分與T 產(chǎn)品中所含的成分不同�,或含量與T產(chǎn)品不同�,則申請人應清楚地描述其差異�,并提供數(shù)據(jù)表明差異不影響T 產(chǎn)品的安全性或申請人對研究結(jié)果的解釋。
對于將輔料TDS 與陽性對照TDS 比較的皮膚I/S 研究�,申請人應使用與該指導原則的“第4.1”和“第4.2”節(jié)中�,建議的T 和R 產(chǎn)品比較,基本相同的方法�,但輔料TDS 應作為T 產(chǎn)品,陽性對照TDS應作為R產(chǎn)品�。
申請人應確保陽性對照在誘導期能夠持續(xù)引發(fā)并維持刺激反應�。陽性對照既不能持續(xù)引發(fā)刺激反應�,也不能維持刺激反應,這可能會混淆研究結(jié)果的解釋�,并損害研究的有效性。
不建議在I/S 研究中包括多個候選陽性對照TDS 產(chǎn)品�,并此后在統(tǒng)計分析中選擇一個作為陽性對照TDS 與輔料TDS 比較�。相反,建議在I/S 研究之前預先選擇一個合適的陽性對照�,作為陽性對照TDS�。
4.4 部分(切割)TDS
如果安全問題不允許在21 d 的綜合I/S 研究中�,在同一受試者同時敷用2 種完整的TDS�,則可以將原TDS 單元切割成更小尺寸的TDS 單元�。在這種情況下,T 和R產(chǎn)品都應該有�,可以非破壞性切割成較小貼片的設計。申請人不應為了在該研究中使用較小的TDS 而單獨生產(chǎn)1 批產(chǎn)品�。當使用切割TDS 時�,該指導原則的第IV.A節(jié)和第IV.B節(jié)中提供的一般建議適用。
5�、 不良事件數(shù)據(jù)的總體評估
申請人應在其分析中包括所有至少接受1 次給藥的TDS 的受試者。該分析應包括所有TDS 單元(如T產(chǎn)品和R產(chǎn)品)有關任何敷用部位不良事件的比較�。申請人應報告所有不良事件�,包括全身不良事件。對于任何與敷用部位相關的不良事件�,申請人都應報告不良事件是否與T 產(chǎn)品或R 產(chǎn)品有關。
申請人應在其研究報告中記錄所有敷用部位反應(包括受試者主訴�,如干燥�、瘙癢、燒灼感�、疼痛或酸痛),與“皮膚反應”和“其他效應”評分分開�。此外�,申請人應詳細說明主訴適用的任何敷用部位�。研究報告還應包括頻率表�,該表應列出敷用部位反應,并比較T 產(chǎn)品和R 產(chǎn)品之間敷用部位反應的嚴重程度�。
6、 提交數(shù)據(jù)的格式
申請人應查閱提交給CDER 研究數(shù)據(jù)的網(wǎng)頁�,了解有關數(shù)據(jù)標準的信息�。
申請人應提供規(guī)定文件的XPT 格式的SAS 傳輸數(shù)據(jù)集。如果申請人采用估算�,則應在估算后提交原始數(shù)據(jù)和分析數(shù)據(jù)�。
7、 結(jié)語
FDA的“評估簡化新藥申請仿制透皮和局部給藥系統(tǒng)可能的刺激性和致敏性的供企業(yè)用的指導原則草案”全面而又具體地闡明了�,F(xiàn)DA 對仿制透皮和局部給藥系統(tǒng)可能的刺激性和致敏性人體內(nèi)研究的設計和實施的建議�。其中包括一般原則(一般考慮)�、研究設計和實施、統(tǒng)計分析(刺激性分析和致敏性分析)�、輔料TDS 和陽性對照TDS 以及部分(切割)TDS 等。該指導原則草案啟發(fā)最大的有下列兩個方面�。
7.1 中國有必要制定仿制透皮和局部給藥系統(tǒng)對人體刺激性和致敏性研究的指導原則
FDA該指導原則草案是其2018 年發(fā)布的“評估ANDA 仿制透皮和局部給藥系統(tǒng)的可能的刺激性和致敏性的指導原則草案”[2]修訂版�。5 年后的第1次修訂版內(nèi)容更趨完善和實用�。
而中國目前還沒有類似的指導原則�,國家藥品監(jiān)督管理局藥品審評中心2021 年3 月發(fā)布的“皮膚外用化學仿制藥研究技術指導原則(試行)”[11]�,提出了對這類仿制藥開發(fā)過程中藥學研究、非臨床研究和生物等效性研究的技術要求�,但沒有涉及人體刺激性和致敏性研究要求。國家藥品監(jiān)督管理局藥品審評中心2022 年5 月發(fā)布的“局部給藥局部起效藥物臨床試驗技術指導原則”[12]的“結(jié)語”中�,雖然提及局部給藥局部起效藥物的臨床試驗中�,應特別關注對局部藥代、局部藥效�、局部安全性、耐受性等的充分探討�。但該文件也并未涉及具體的人體刺激性和致敏性研究。因此�,我國有必要制定和發(fā)布仿制透皮和局部給藥系統(tǒng)對人體刺激性和致敏性研究的指導原則,以便使其研究和監(jiān)管規(guī)范化�。
7.2 在仿制透皮和局部給藥系統(tǒng)的刺激性和致敏性研究中應特別注意的事項
FDA的“評估簡化新藥申請仿制透皮和局部給藥系統(tǒng)可能的刺激性和致敏性的供企業(yè)用的指導原則草案”[1]�,對仿制透皮和局部給藥系統(tǒng)的人體刺激性和致敏性研究,提出了許多有意義的研究建議�。其中有些對我國這方面的研究和監(jiān)管有重要參考價值,應特別關注�,尤其是在我國還沒有類似指導原則的情況下。下面列舉一些內(nèi)容(實際工作中不限于此):(1)在1 項研究中包括評價皮膚刺激性和致敏性�;(2)皮膚反應評分的兩個量表—皮膚反應量表和其他效應量表;(3)每個方案人群中至少包括200 例可評價的受試者�;(4)應盡量確保所有觀察都采用同一評分者。應對皮膚反應的評估采用盲法�;(5)T 產(chǎn)品和R產(chǎn)品的MIS 總平均數(shù)差值的NI 界值為0.20。







