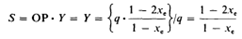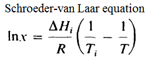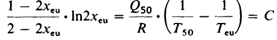前言:結(jié)晶手性拆分的方法有以下三種:優(yōu)先結(jié)晶拆分(Preferential Crystallization)���、成鹽拆分(diastereomeric salt formation)和共結(jié)晶拆分(diastereomeric corystallization)��。對于產(chǎn)業(yè)端來說,成鹽手性拆分是目前獲取單一手性化合物最經(jīng)濟(jì)��、最易于產(chǎn)業(yè)化的拆分方法。
(1)成鹽拆分原理
成鹽�,顧名思義,是有酸堿基團(tuán)反應(yīng)�����。成鹽拆分要求起始手性化合物存在酸����、堿基團(tuán),通過選擇合適的手性酸堿拆分劑��,反應(yīng)形成的非對映異構(gòu)體鹽理化性質(zhì)存在顯著差異�,其“相圖”是非對稱的,因此可以通過結(jié)晶的方法分離得到RR*或者SR*����,最后再脫去拆分劑R*,即可拆分得到單一對映異構(gòu)體��。下圖1是手性成鹽步驟的示意圖����。
圖1成鹽手性拆分示意圖
(2)成鹽手性拆分效率評估的“底層邏輯”
成鹽結(jié)晶拆分的根本依據(jù)是,利用成鹽形成的“非對映異構(gòu)體鹽”理化差異實(shí)現(xiàn)高效分質(zhì)結(jié)晶���。結(jié)晶的“底層邏輯”永遠(yuǎn)是“熱力學(xué)數(shù)據(jù)”���,是“相圖”�����。例如��,我們結(jié)晶工藝開發(fā)中��,總是強(qiáng)調(diào)需要先收集粗略溶解度數(shù)據(jù)�����,溶解度就是熱力學(xué)數(shù)據(jù)�,本質(zhì)就是“相圖”的數(shù)據(jù)的組成部分��。產(chǎn)業(yè)端咱們更多的注重效用��,收集大量復(fù)雜基礎(chǔ)數(shù)據(jù)繪制“非對映異構(gòu)體鹽的混合物體系”的三元相圖肯定不現(xiàn)實(shí)����,而且矛盾的是,拆分成功前我們也沒辦法獲得較大量純的異構(gòu)體樣品用于相圖繪制的測試����。
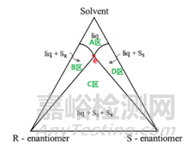
那為什么我們產(chǎn)業(yè)應(yīng)用過程中,還是要強(qiáng)調(diào)“相圖”呢����?因?yàn)?ldquo;相圖”可以分析出最優(yōu)結(jié)晶操作路徑在哪,理解相圖可以幫助我們按“地圖”操作�����,知道在哪個(gè)位置就需要停止了�。圖2是外消旋混合物(conglomerates)三元相圖的示意圖,它將恒溫條件下的結(jié)晶系統(tǒng)分成了四個(gè)區(qū):A區(qū)是單相液相區(qū)����;B區(qū)是液相+固體R兩相區(qū);C區(qū)是液相+固體S+固體R三相區(qū)����;D區(qū)是液相+固體S兩相區(qū)。那如果我們的目標(biāo)是結(jié)晶拆分分離得到純的固體S����,那結(jié)晶操作條件必須控制在D區(qū)域,即控制溶液中S組分的組成不能超過點(diǎn)e的組成����。點(diǎn)e有個(gè)專有名稱eutectic composition(共組分點(diǎn))�����。
圖2 相圖分區(qū)示意圖
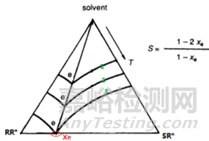
具體到成鹽拆分系統(tǒng)來說�����,成鹽相圖是拆分劑R*與外消旋化合物反應(yīng)形成RR*和SR*的混合物���,它是非對稱相圖,示意圖如下圖3所示���。SR*是更難溶解的組分��,結(jié)晶過程會優(yōu)先析出����。數(shù)字1,2,3標(biāo)識的是恒溫濃度曲線��?���?梢岳斫鉃?,曲線1是溫度恒定為T1時(shí)���,在一定量的溶劑中����,不同比例的RR*和SR*熱力學(xué)平衡溶解量�,當(dāng)溫度從T1升高至T2和T3曲線時(shí)��,曲線出現(xiàn)下移��,代表溶解所需的溶劑更少�����,也代表更高的濃度曲線����。
圖3 非對映異構(gòu)體混合物三元結(jié)晶相圖的示意圖
解釋完成鹽相圖示意圖后,重點(diǎn)得說結(jié)論了:
結(jié)論1拆分效率轉(zhuǎn)化公式:操作點(diǎn)停留在共組分點(diǎn)e (Eutectic Composition)時(shí)����,可以得到光學(xué)純度OP=1的異構(gòu)體SR*,且此時(shí)SR*收率最高�����。根據(jù)定義拆分效率S=OP(光學(xué)純度)*Y(收率),那結(jié)晶操作停留在e點(diǎn)�����,即為最優(yōu)拆分效率��,根據(jù)物料衡算得出拆分效率S的計(jì)算公式如下�����,xe為目標(biāo)難溶組分SR*在溶液中的組成:
結(jié)論2 共組分點(diǎn)e與溫度幾乎無關(guān)為恒定組成����,xe=xeu:Leclercq和Jacques研究發(fā)現(xiàn),不同溫度下溫度曲線�����,e點(diǎn)在同一條直線上(圖3)�����,即共組分點(diǎn)幾乎不受溫度影響,xe為恒定值�����。前面解釋過����,溫度升高曲線向三角下方移動,所需要溶劑越少����,當(dāng)溫度升高至低共熔點(diǎn)溫度及以上時(shí)�����,固體開始熔化成液體�����,則不需要溶劑來溶解固體�����,此時(shí)的“相圖”變成“二元熔融相圖”����。如下圖4所示����,xeu是二元熔融相圖的“低共熔組分點(diǎn)”�����, xe=xeu�����。因此成鹽劑拆分效率S����,可以轉(zhuǎn)化為尋找二元熔融相圖的低共熔組分xeu。而固體混合物的二元熔融相圖可以通過DSC測定��,因此使得快速評估不同拆分劑的“最優(yōu)拆分效率”變的簡單易操作��。
圖4 非對映異構(gòu)體混合物三元結(jié)晶相圖和二元熔融相圖關(guān)系示意圖
(3)熱分析DSC數(shù)據(jù)如何計(jì)算混合物的低共熔組分點(diǎn)xeu
二元混合物的熔融相圖����,主要由兩條液相線組成(圖4標(biāo)識所示),兩條液相線的交點(diǎn)即是低共熔組分點(diǎn)����,此時(shí)的組成即為xeu��。依據(jù)Schroeder-van Laar equation簡化二元固體為理想混合物����。
Schroeder-van Laar equation中��,x是摩爾組成�����,△Hi是純異構(gòu)體鹽的熱焓����,Ti是純異構(gòu)體鹽的熔點(diǎn)����。T是摩爾組分為x的混合物熔點(diǎn)“終值”。
解釋二元熔融相圖����,目的一樣是理解“底層邏輯”。不是說必須花費(fèi)大量物料和人力資源去把二元熔融相圖整出來從而得到xeu�����,產(chǎn)業(yè)端永遠(yuǎn)強(qiáng)調(diào)“多快好省”的應(yīng)用。Schroeder-van Laar equation表明二元熔融相圖可以通過熱分析收集的DSC數(shù)據(jù)計(jì)算獲得相圖�����,且選擇兩個(gè)點(diǎn)��,就可以畫出一條液相線�����。
工業(yè)應(yīng)用中����,怎么選擇兩個(gè)點(diǎn)最高效呢?回到最開始的目的:選擇合適的手性拆分試劑�����,與外消旋化合物反應(yīng)��,實(shí)現(xiàn)成鹽拆分����。那么第一點(diǎn)直接以目標(biāo)為導(dǎo)向選擇組分為xeu點(diǎn)����,可以得到拆分效率��;第二個(gè)點(diǎn)的選擇����,以可操作性為導(dǎo)向,起始物料的外消旋化合物SR中加入等摩爾比的不同拆分劑�����,充分反應(yīng)后��,旋蒸除去液體可以非?����?旖莸牡玫絉R*:SR*=1:1的非對映異構(gòu)體鹽��,所以選擇第二點(diǎn)為x=0.5的點(diǎn)��。對應(yīng)的方程迭代后��,最終計(jì)算公式如下(具體公式推導(dǎo)過程見文末附圖):
(4)DSC評估拆分效率具體操作流程
不同拆分劑����,等摩爾比的與外消旋化合物反應(yīng),旋蒸除去溶劑后形成1:1非對映異構(gòu)體鹽��,送檢DSC�����,會計(jì)算得到不同的C值�����,C值得到后�����,通過圖表法或者數(shù)值計(jì)算法�����,可以得到xeu
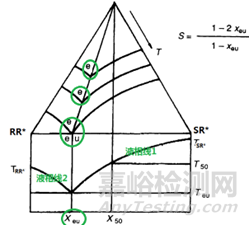
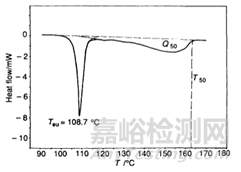
圖5 非對映異構(gòu)體鹽SR*/RR*=1:1混合物的DSC典型圖譜示意圖
文獻(xiàn)中一個(gè)應(yīng)用實(shí)例:圖5是典型的1:1非對映異構(gòu)體鹽的DSC��,DSC收集對應(yīng)計(jì)算需要的參數(shù):Teu=381 K�����,T50=417K,Q50=19.6 KJ/mol����,計(jì)算得到的xeu=0.13,最優(yōu)的拆分效率S=(1-2xeu)/(1-xeu)=0.85�����。成鹽篩選中����,比較一系列拆分鹽的拆分效率,拆分效率越高����,則拆分劑越優(yōu)。
(5)應(yīng)用場景分析
基于DSC計(jì)算的拆分效率�����,前提是DSC分峰較好�����,如上圖5典型示意圖所示����。如果通過旋蒸得到的1:1固體只有一個(gè)DSC峰,表明形成了手性共晶或者固體溶液�����,此時(shí)無法拆分����,拆分效率為0。另外當(dāng)旋蒸得到的是無定型����、溶劑化物或者DSC測試中樣品出現(xiàn)分解,雖然上述計(jì)算方法不再適用�����,但依然可以對拆分效果有一定的評估:1��,出現(xiàn)分解的溫度越高�����,表明難溶鹽和易溶鹽溫差越大,拆分劑傾向更有效�����;2�����,如果有一種鹽是無定型����,則無定型容易留在母液中,從而使得分質(zhì)結(jié)晶更有效果��;3��,形成溶劑化物的情形��,則拆分時(shí)�����,選用能形成溶劑化物的溶劑進(jìn)行結(jié)晶拆分��,有利于手性分離……
小結(jié):本文主要總結(jié)了產(chǎn)業(yè)中應(yīng)用最廣的成鹽手性拆分比較實(shí)用且簡單的預(yù)測方法��,希望對大家拆分工作有所裨益,期待大家積極討論建議�����。
附公式推導(dǎo)過程圖:
參考文獻(xiàn):
[1] Dávid Kozma,György Pokol,Mária Ács.Calculation of the efficiency of optical resolutions on the basis of the binary phase diagram for the diastereoisomeric salts[J].Journal of the Chemical Society Perkin Transactions, 1992, 3(3):435-439.DOI:10.1039/P29920000435.
[2] Kozma, David , Mária Ács, and Elemér Fogassy. "Predictions of which diastereoisomeric salt precipitates during an optical resolution via diastereoisomeric salt formation." Tetrahedron 50.23(1994):6907-6912.
[3] Emese.Pálovics,János.Madarász, Pokol G ,et al.Economic Separations of Organic Acidic or Basic Enantiomeric Mixtures-A Protocol Suggestion[J].International journal of molecular sciences, 2023, 24(1).DOI:10.3390/ijms24010846.
[4 ]Putman J I, Armstrong D W. Recent advances in the field of chiral crystallization[J]. Chirality, 2022, 34(10): 1338-1354.