一般信息
“General Information”描述了確保藥品質量所需的參考信息和參考測試方法��,附在JP上��。因此�����,一般信息被定位為JP的重要信息���,盡管它不應被視為藥品符合性的指示標準,但根據(jù)《藥品和醫(yī)療器械等產(chǎn)品的質量�����,有效性和安全性確保法律》批準藥品時指定的情況除外。
結合使用一般信息和JP有助于提高JP的質量和用戶的便利性�����。一般信息根據(jù)其內容分為以下幾類��,每個一般信息都單獨編號��。
G1. 物理與化學
G2. 固態(tài)特性
G3. 生物技術/生物制品
G4. 微生物
G5. 生藥(或中草藥)
G6. 藥物制劑
G7. 容器和包裝
G8. 標準物質
GZ. 其他
凡例
1���、日本藥典的官方名稱是:第十八改正日本薬局方���,或簡稱為局十八,日局18�����, JP XVIII orJP 18�����。英文名為:The Japanese Pharmacopoeia, Eighteenth Edition.
2��、在藥品中 ��,日本藥典藥品(JP藥品)是各論中指定的藥品。各論中采用的標題名稱和常用名稱應作為正式名稱���。在藥品各論中���,除英文名稱外,還可酌情在標題中提及化學名稱或拉丁名稱�����。
3��、生藥及其相關產(chǎn)品放在官方各論后部的“Crude Drugs and Related Drugs”中�����。這些包括:以生藥為活性成分的提取物��、粉末��、酊劑�����、糖漿���、烈酒���、液體提取物或栓劑,以及以生藥為主要活性成分的組合制劑���。
4���、日本藥品應按照相關各論、凡例(General notice)���、生藥通則(General Rules for Crude Drugs)���、制劑通則(General Rules for Preparations)和一般檢驗(General Tests)中的規(guī)定進行檢驗,以確定其是否符合日本藥典��。但是��,制劑各論中的“Description”以及“Containers and storage”和“Shelf life”僅供參考�����,不應被視為指示符合性標準�����。 然而,關于以生藥為主要活性成分的制劑專著中“Containers and storage”下的容器則是符合性標準�����。
5�����、原則上��,除非另有說明�����,否則用于制備JP藥物或其來源材料的動物必須是健康的���。
6���、在英文版本中,各論中描述的JP藥物以大寫字母開頭�����。
7�����、藥物或化學品名稱后面括號()中的分子式或結構式表示化學純物質���。分子量表示為小數(shù)點后兩位���。
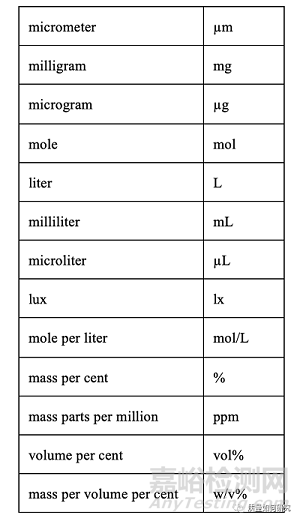
8、以下是主要單位的縮寫:
注意:核磁共振波譜學中使用的“ppm”表示化學位移��,“w/v%”用于制劑的配方或組成�����。
9�����、用于表示JP藥物效力的單位被認為是藥物的數(shù)量��。通常它由一定量的確定標準物質表示���,該標準物質具有一定的生物活性�����,并且根據(jù)每種藥物而有所不同��。原則上��,通過生物方法與每個參考標準進行比較來確定單位���。JP藥品中使用的術語“Unit”表示日本藥典中定義的單位���。
10、各論中的“Being Specified separately”一詞是指根據(jù)藥品和醫(yī)療器械等產(chǎn)品的質量�����、有效性和安全性保障法批準藥品時應指定測試方法�����。
11��、從質量保證的角度來看���,除了質量標準之外�����,制造過程中應注意的要求(如果適用)會顯示在各論的“Manufacture”標題中���。它可能包含有關材料、制造過程和中間體控制的要求��,以及生產(chǎn)過程中的測試和省略放行測試的要求��。 即使在各論中沒有 “Manufacture”的情況下���,也要注意對單個藥物的原材料�����,制造過程和中間體進行適當控制���。
12、當從制造工藝驗證研究���、適當?shù)闹圃旃に嚳刂朴涗浐唾|量控制的測試結果中獲得一致的產(chǎn)品具有JP藥品質量的保證時���,各論中某些測試項目在產(chǎn)品放行時的要求可根據(jù)場合需要被省略���。此外,基于過程數(shù)據(jù)(包括過程測試結果和過程參數(shù)監(jiān)測數(shù)據(jù))對最終產(chǎn)品(原料藥和藥品)進行質量評估��,可以代替各論中的具體規(guī)定和測試方法�����,或者在適當?shù)那闆r下作為測試方法���。
13���、日本藥典中規(guī)定的測試方法可以用替代方法代替,這些方法應具有更好的準確性和精密度���。但是���,如果懷疑測試結果存在差異,則只有通過藥典中給出的程序獲得的結果才對最終判斷有效��。
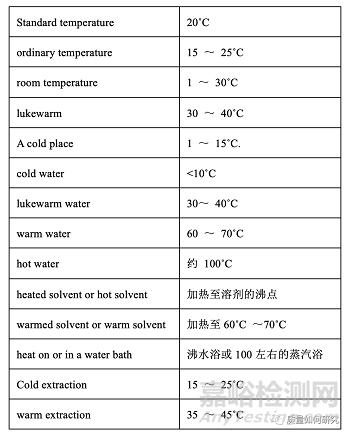
14��、原則上測試或儲存的溫度應以具體數(shù)字描述。但是��,以下表達式可能會用到��。
15���、為了測量滴的數(shù)量���,應使用在20°C下輸送20滴重0.90 ~ 1.10克的水的滴注裝置�����。
16��、除非另有說明���,“真空”一詞表示壓力不超過2.0kPa�����。
17��、除非另有說明��,否則溶液的酸度或堿度由藍色或紅色石蕊紙確定��。若需更精確地指示這些特性�����,則使用pH值�����。
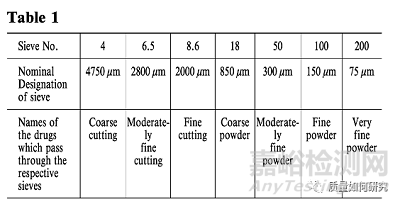
18��、下表中的術語用于表示生藥的切割程度或粉末藥物的細度���。
19�����、用于藥物試驗的水應為適合進行相關試驗的水��,如不含任何會干擾試驗的物質���。
20、若在描述溶液時未指明溶劑�����,通常指水溶液。
21��、(1 in 3)��、(1 in 10)或(1 in 100)的溶液表述是指1g溶質或1ml溶質用溶劑溶解或稀釋到相應的體積3mL��、10mL或100mL中��。用(10:1)或(5:3:1)表述的混合液是指各液體按體積比進行混合�����。
22�����、“準確稱量”是指考慮測試目的和相關稱量裝置將重量稱到0.1mg��,10 µg�����,1µg或0.1µg�����。“精確稱量”是指稱量到給定的小數(shù)位�����。
23��、在JP藥物測試中��,應通過將“n+1”的數(shù)字四舍五入來獲得“n”數(shù)字的值��。
24���、除非另有說明�����,否則JP藥物的所有測試應在常溫下進行�����,并在操作后立即觀察結果��。但是�����,對受溫度影響的測試的判斷應基于標準溫度下的條件���。
25��、JP藥物測試中使用的術語“immediately”/“at once”意味著該程序將在前一個程序后30秒內進行�����。
26��、在“Description”部分��,“白色”通常是指白色或幾乎白色�����,“無色”是指無色或幾乎無色。除非另有說明���,顏色的觀察是將1g固體藥品鋪在一張白紙上或放在白紙上的表面皿上���。液體藥品則是放在15mm內徑的無色試管中�����,在白色背景下透過30mm的溶液觀察�����。對于溶液澄清度的測試��,操作方法相同���,背景可以為黑色或白色。對于液體藥品的熒光檢查��,則只能使用黑色背景��。
27�����、在“Description”部分�����,“無味”是指無味或幾乎無味��。除非另有規(guī)定,氣味的測試是將1g固體藥品或1ml液體藥品放在燒杯中��。
28�����、在“Description”部分���,溶解度的表達有以下類型��。除非另有規(guī)定�����,溶解度是指JP藥品的溶解程度���。對于固體藥品必要時預先粉碎,在20 ± 5?C條件下��,每隔5min強烈振搖30s��,觀察它在溶劑中的溶解情況��。
29��、在藥物測試中�����,術語“溶解”或“混溶”表示它溶解或以任意比例與溶劑混合以形成澄清溶液或混合物���。除藥物以外的不溶性物質(包括纖維)不應被檢測到或幾乎看不見���。
30、 鑒定是根據(jù)藥物的特定特性識別藥物活性成分的測試���。
31�����、 純度是檢測藥物中雜質/污染物的測試���,它以及各論中的其他要求通常通過限制雜質/污染物的種類/性質和數(shù)量來指定藥物的純度。進行純度測試的雜質/污染物是指在制造過程或儲存過程中產(chǎn)生/污染的雜質/污染物���,包括重金屬���、砷等有害物質���。如果使用或添加任何異物,則必須進行測試以檢測或限制此類物質的存在�����。
32�����、原則上���,JP藥品根據(jù)一般測試中的元素雜質要求進行適當控制��。當藥品中的元素雜質按照指示進行適當控制時�����,無需對各論中規(guī)定的重金屬和砷等元素雜質進行測試��,包括但不限于藥品�����、原料藥和輔料的元素雜質��。
33��、原則上�����,除非各論中另有說明�����,否則JP藥物將根據(jù)一般測試中的殘留溶劑下的要求進行適當控制��。
34��、考慮到故意摻入藥品中的有害物質���,必要時可在各論的“Potential adulteration”中描述是否存在污染物的控制要求。這些物質通過對材料���、制造工藝���、中間體或最終產(chǎn)品的測試來控制。根據(jù)質量風險管理部分的控制策略,每個藥品單獨指定這些檢查的必要性和頻率���。
35���、除另有規(guī)定外,在干失或熾灼中“恒重”是指經(jīng)過額外1小時的干燥或熾灼后重量的差異不超過上一次干燥樣品或熾灼殘渣的0.10%�����。對于生藥�����,重量的差異為不超過0.25%���。與此同時��,當用分析天平秤重時差異不超過0.5mg���,半微量天平秤重不超過50µg,或微量天平秤重不超過5µg時���,也可認為達到了恒重��。
36�����、含量測定是通過物理���,化學或生物程序確定藥物的組成,活性成分的含量和效力單位的測試��。
37���、在表達含量測定的合適數(shù)量時��,使用“about”一詞表示在指定質量的10%以內的量��。 “dry”一詞表示樣品應按照各論中的干燥失重方法在相同條件下完成干燥���。
38、對于各論中含量測定中確定的成分的含量��,如果簡單地表示為“不低于一定百分比”而不標明其上限�����,則101.0%被理解為上限。
39�����、無菌是指通過指定方法未檢測到目標微生物的條件���。滅菌是指殺死或去除待滅菌物體中的所有活微生物的過程�����。無菌技術是維持無菌狀態(tài)的受控技術��。
40���、容器是盛放JP藥物的設備。塞子或蓋子等被視為容器的一部分��。容器沒有影響內容物的指定描述和質量的物理和化學反應性�����。
41���、密閉的容器(A well-closed container)可保護內容物免受外來固體的影響�����,并在常規(guī)或自定義的處理���、運輸和儲存條件下防止藥物丟失��。如果指定了密閉容器���,也可以用密封容器代替(tight container)��。
42���、密封的容器(tight container)可保護內容物免受外來固體或液體的影響��,防止內容物丟失��,以及在常規(guī)或自定義的處理�����、運輸和儲存條件下風化�����、潮解或蒸發(fā)�����。如果指定了密封容器�����,則可以用熔封容器(hermetic container)代替��。
43���、熔封容器(hermetic container)在常規(guī)或自定義的處理���、運輸和儲存條件下不受空氣或任何其他氣體的影響。
44���、“遮光”(light-resistant)是指它可以防止光的透射影響內容物的特定特性和質量��,并在常規(guī)或自定義的處理�����、運輸和儲存條件下保護所含藥物免受光照�����。
45��、就JP藥物而言�����,各論中活性成分單位的含量或效力必須在其直接容器或包裝上顯示��。
46���、JP藥物的來源���,數(shù)值或物理性質�����,及各論中的特殊標簽要求規(guī)定���,必須在其直接容器或包裝上顯示�����。
47�����、 日本藥典���、歐洲藥典和美國藥典之間的統(tǒng)一一般測試和各論中有這樣的聲明��。文本的各個部分中不協(xié)調的用下面的符號圖片表示��。