MDSAP英文全稱是“Medical Device Single Audit Program”��,中文全稱是醫(yī)療器械單一審核程序���,是由國際醫(yī)療器械法規(guī)論壇(IMDRF)發(fā)起,以ISO13485為基礎(chǔ)��,結(jié)合五個參與國(美國��、加拿大�����、巴西��、澳大利亞和日本)的法規(guī)要求���,來實現(xiàn)各成員國對醫(yī)療器械生產(chǎn)企業(yè)質(zhì)量管理體系檢查結(jié)果的互認,以減少監(jiān)管機構(gòu)的重復(fù)檢查對有限檢查資源的浪費和企業(yè)的負擔�����。
目前���,MDSAP的成員是:澳大利亞治療品管理局 TGA/巴西衛(wèi)生局 ANVISA/加拿大衛(wèi)生部 HC/日本厚生勞動省以及醫(yī)藥醫(yī)療器械管理局 MHLW、PMDA以及美國食藥品監(jiān)督管理局 FDA�����。此外歐盟/ 英國藥品和保健產(chǎn)品監(jiān)管局MHRA和世衛(wèi)組織也擔任官方觀察員���。
2. 實施MDSAP的目的和涉及的法規(guī)有哪些���?
2.1 實施MDSAP對制造商有以下好處:
對醫(yī)療器械制造商的質(zhì)量管理體系進行適當?shù)谋O(jiān)管監(jiān)督,同時最大限度地減少行業(yè)的監(jiān)管負擔;
通過監(jiān)管機構(gòu)之間的工作共享和相互接受,在尊重每個機構(gòu)主權(quán)的同時,促進監(jiān)管資源的更高效和靈活使用��;
從長遠來看���,在全球范圍內(nèi),基于國際標準和最佳實踐,促進監(jiān)管方法和技術(shù)要求的更大一致性�����;
通過標準化促進監(jiān)管計劃的一致性,可預(yù)測性和透明度��;
參與監(jiān)管機構(gòu)監(jiān)督第三方審核機構(gòu)的做法和程序,以及參與第三方審核機構(gòu)的做法和程序��。
2.2 MDSAP涉及的法規(guī)
Australia
Therapeutic Goods (Medical Devices) Regulations 2002 Schedule 3
Canada
Medical Device Regulations SOR/98-282
Brazil
RDC ANVISA n.665/2022
RDC ANVISA n.551/2021
RDC ANVISA n.67/2009
FDA
21 CFR Part 803
21 CFR Part 806
21 CFR Part 807
21 CFR Part 820
Japan
MHLW Ministerial Ordinance No.169
3. MDSAP怎么審�����?誰來審���?
3.1 審核流程
MDSAP的審核借鑒了FDA QSIT審核思路和模式���,將質(zhì)量管理體系分為七大流程,主要分為:
·管理(Management)
·器械批準和工廠登記(Device marketing authorization and facility registration)
·測量���、分析和改進(Measurement, analysis and improvement)
·不良事件報告和忠告性通知(Medical device adverse events and advisory notices reporting)
·設(shè)計開發(fā)(Design and development)
·生產(chǎn)和服務(wù)控制(Production and service controls)
·采購(Purchasing)
每個流程包括不同的審核任務(wù)(Task)���。其中管理流程、測量分析改進流程���、設(shè)計開發(fā)流程和生產(chǎn)服務(wù)控制流程是主流程���,其它三個流程為支持性流程。
3.2 審核周期
MDSAP的審核周期和ISO 13485一樣�����,也是3年一個循環(huán)��,包括初次的正式審核�����、正式審核之后的第一年和第二年為監(jiān)督審核���、第三年為再認證審核�����。初次的正式審核包括第一階段和第二階段�����,第二階段會對醫(yī)療器械制造商的質(zhì)量管理體系(QMS)進行完整的審核���。和ISO13485不同的是審核時間的計算�����,ISO 13485的審核以企業(yè)的員工人數(shù)計算人天���,而MDSAP以審核的任務(wù)(Task)來計算人天。申請企業(yè)因為需要滿足的法規(guī)��、產(chǎn)品�����、體系的流程和任務(wù)不同���,人天會有差異��。
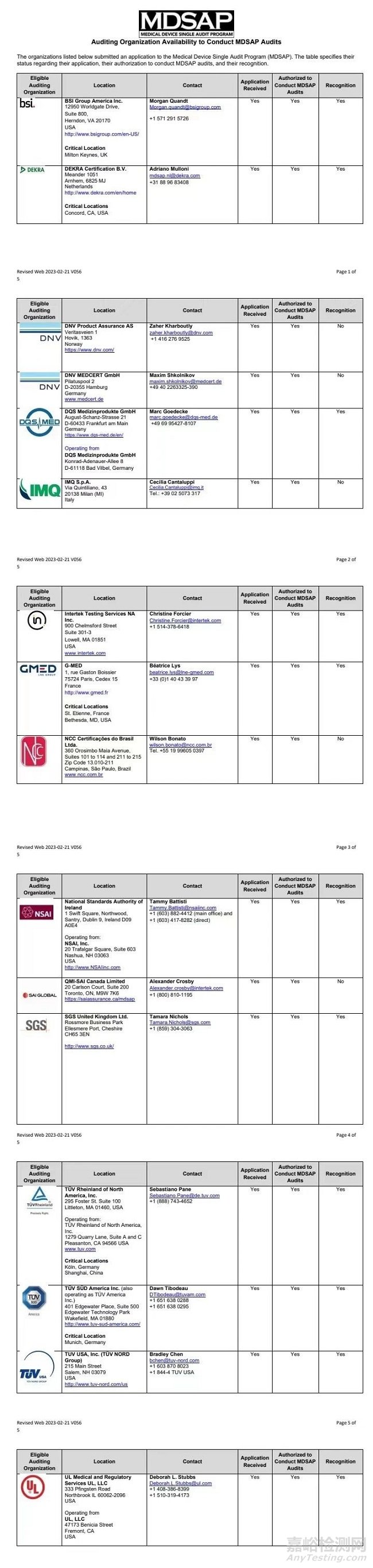
3.3 審核機構(gòu)
和CE-MDR/IVDR認證類似�����,五個參與國按照流程認可了一些審核機構(gòu)(AO)的資格���,由AO機構(gòu)來進行審核���。截至目前,已有以下幾家第三方機構(gòu)獲得資質(zhì)�����,F(xiàn)DA官網(wǎng)7月份的最新信息哈���,大家可以看看,可以參考下問問這些中國區(qū)第三方機構(gòu)的sales
3.4 MDSAP必須申請5個國家嗎�����?
MDSAP認證的法規(guī)的選擇可以根據(jù)目標市場而確定�����,如果已經(jīng)在該國市場銷售了醫(yī)療器械產(chǎn)品��,就應(yīng)該在MDSAP的認證中包括該國適用的法規(guī)要求�����,如果沒有在該國銷售產(chǎn)品���,制造商可以根據(jù)自身的情況確定是否要包括該國的法規(guī)要求���。初次認證審核沒有包括的國家和法規(guī)��,可以再后續(xù)的審核中進行擴證�����。